비만유도 노화 흰쥐의 복합 운동이 대동맥, 골격근 및 심근의 HSP70 및 SOD1 발현에 미치는 영향
Abstract
PURPOSE
Exercise improve myocardial cell protection and vascular function through cell repair and suppression of oxidative stress in cardiovascular diseases caused by aging. This study aimed to investigate the effect of combine exercise on HSP70 and SOD1 protein expression of aorta, skeletal muscle and myocardium in high fat diet induced obese aging rats.
METHODS
Male 50-week-old Sprague Dawley rats (n=40) were divided into normal diet (ND, n=10), normal diet+exercise (NDEx, n=10), high fat diet (HFD, n=10), and high fat diet+exercise (HFDEx, n=10) groups. After six weeks on a high fat diet to induce obesity, a 12-week combine exercise program was implemented, which combine exercise (treadmill running+ladder climbing) three times a week for 45 minutes per session.
RESULTS
Body weight was significantly decreased after 12 weeks combine exercise program compared to the ND group (p<.05) and HFDEx group compared to the HFD group (p<.05), respectively. After completing the 12-week exercise program, heat shock protein 70 (HSP70) and superoxide dismutase 1 (SOD1) expressions were significantly (p<.05) higher in the NDEx group compared to the ND group in the myocardium. Also, SOD1 protein expression was significantly (p<.05) higher in the NDEx group compared to the ND group and HFDEx group compared to the HFD group in the skeletal muscle.
CONCLUSIONS
In conclusion, combine exercise intervention of high fat diet-induced obesity resulted in decreased cell repair protein and antioxidant enzyme protein in the myocardium. Therefore, it is thought that combine exercise intervention for obese induced rats improved the cell repair protein and antioxidant enzyme activity of the myocardium.
색인어: 노화, 운동, 비만, 심근, HSP70, SOD1
Keywords: Aging, Exercise, Obese, Myocardium, HSP70, SOD1
서 론
심혈관질환 발병은 세포사멸, 심장근 비대, 섬유화 초래등 대사적 기전에 영향을 받고, 염증성 물질 생성과 산화적 스트레스 상승의 복잡한 상호작용으로 이루어진다. 특히 관상동맥질환의 허혈에 의한 심근의 손상[ 1]은 심장 기능을 저하시켜 심근 세포 사멸을 유도한다[ 2]. 열 쇼크 단백질(heat shock protein, HSP)은 허혈에 의해 손상된 심근의 단백질 구조 변성 및 높은 산화적 스트레스 수준을 억제하거나 감소시키는데 관여하는 조직 특이적으로 발현되는 단백질이다[ 3]. 그 중 HSP70은 대부분의 세포 종류에서 존재하며 샤페론(cheparones)의 기능을 통해 미토콘드리아 막을 통한 단백질의 수송이 원활히 이루어지도록 하며 세포의 항상성을 유지시키고 단백질을 형성시키고, 변성 및 기형이 된 단백질을 복원시키며, 세포사멸 억제와 면역반응을 유도한다[ 4]. 특히 운동을 통한 HSP70 단백질 과발현은 미토콘드리아 손상을 억제하여 조직손상을 억제하는데[ 5], 골격근뿐만 아니라 심장근육 내 세포사멸을 억제할 뿐만 아니라 세포들을 보호한다[ 6]. 운동은 산소섭취량의 증가와 반응성 산소종(reactive oxygen species, ROS)이 증가하여 세포가 산화성 스트레스를 받게 된다. 그러나 체내항산화 효소인 superoxide dismutase (SOD)가 활성화되어[ 7], 활성산소의 증가로 단백질, 핵산 및 세포막이 손상에 대한 세포의 적응 효과가 일어나 심근세포를 보호한다[ 8]. 특히 심혈관계의 산화적 스트레스 억제 조절자 역할을 하는 것으로 알려져 있는 SOD는 규칙적인 유산소운동에 의해 발현량이 증가한다[ 9]. 노화 쥐의 운동처치 연구에서 총 SOD, 미토콘드리아 SOD, 세포질 SOD, 세포외 SOD의 활성을 유의하게 증가시켰다고 보고되었다[ 10]. 20개월 이상 노화 쥐의 트레드밀 달리기 운동은 심근에서 HSP70 단백질 발현이 증가되었다고 보고되었지만[ 11, 12], 14주 동안 수영훈련을 한 수컷쥐의 심실조직에서는 HSP70 단백질 변화가 나타나지 않았다[ 13]. 또한 노화 쥐의 운동 후 SOD1 단백질 발현이 심장근에서 증가[ 11, 14] 혹은 감소[ 15]하였으며, 대동맥과 장간막동맥(mesenteric artery)에서도 증가[ 16], 혹은 감소[ 17] 등의 결과가 나타났으며 급성운동[ 12, 14]과 만성적 장기간 운동[ 16, 18]에서도 상이한 연구결과가 보고되고 있다. 이와 같이 상이한 연구결과에서 운동은 활성산소를 생성하는 동시에 항산화 효소의 활성을 높여줌으로써, 활성산소의 생성과 소멸에 영향을 미쳐 심근보호 효과를 발휘할 것[ 19]으로 예측되지만, 심혈관질환자의 건강개선을 위한 중요한 처치방법인 운동 트레이닝은 운동형태, 운동기간 및 분석조직에 따라 HSP70 및 SOD1 단백질 발현의 결과가 일치되지 않음을 알 수 있다. 이에 노화에 따른 심근의 산화적 스트레스로 인한 세포내 방어 시스템 손상과 함께 세포사멸이 가속되어 심근경색 유발로 인한 사망률이 증가하고 있는 측면에서 볼 때 조직 간의 세포회복 및 항산화 대사기전에는 차이가 있을 것이다. 특히 운동은 혈관죽종에 의한 허혈, 심근괴사 및 심근세포 내 산화적 스트레스 증가에 대한 심혈관질환의 심장보호 효과 발휘에 대하여 명확하게 규명되지 않은 상태이며 운동에 의해 각 조직에서 유발되는 심장 보호 효과를 규명하는 기전연구는 불분명하다.
그러므로 본 연구는 세포회복기전과 항산화효소활성 측면에서 대동맥, 골격근 및 심근의 각 조직에서 HSP70 및 SOD1 단백질 발현을 분석하고 비교함으로서 노화과정에서 운동이 체내 적응 반응을 유도하여 각 조직 세포의 스트레스에 대한 저항력을 증진할 수 있는 가능성을 확인하고자 한다.
연구 방법
1. 실험동물
실험동물은 50주령 Wistar계 수컷 흰쥐 40마리를 1주간의 예비사육을 통해 환경에 적응시킨 후, 1주간 저항성 운동형태인 사다리 등반운동 및 트레드밀 운동을 적응시키면서 6주간 고지방식이로 비만을 유도하였다. 그 후 운동그룹은 12주간 활동적 저항성 운동처치를 실시하였다. 그룹의 구성은 Table 1에서 나타난 바와 같이 각각 10마리씩 무작위로 4그룹으로 배정하였다. 사육실 환경온도는 24±1°C, 상대습도는 60% 내외로 유지하였다. 본 실험은 (재)대구테크노파크 바이오헬스융합센터 실험동물윤리위원회(BHCC-IACUC)의 승인을 얻어 실시하였다.
2. 연구방법
1) 식이구성 및 비만유도
식이구성은 일반식이 및 고지방식이에 vitamins (22 g/kg Teklad vitamins mix no. 40077), minerals (51 g/kg Teklad mineral mix no. 170915), methionine (5 g/kg, Teklad Premier no. 10850), choline chloride (1.3 g/kg)을 혼합하여 사용하였다[ 20]. 식수는 2차 이온 교환수로 하여 사료와 함께 마음껏 섭취하도록 하였다. 구성성분은 Table 2 에서 나타난 바와 같다.
2) 복합 운동프로그램
복합 운동 트레이닝은 노화에 따른 근력증진을 목적으로 사다리 등반 저항성운동과 트레드밀 유산소운동을 복합적으로 하루 총 운동시간 45분으로 주당 3회의 빈도로 12주간 실시하였다. 저항성운동은 Lee et al. [ 21]의 방법을 수정 적용한 사다리 등반운동을 실시하였다. 초기 1주간 사다리(경사도 75°, 1 m) 등반운동에 적응하기 위하여 꼬리에 무게를 달지 않고 실시한 이후 꼬리에 체중의 30-50%정도 되는 무게를 점증하여 실시하였으며, 2분 간격으로 8회 반복하여, 1세트에서는 체중의 70% 무게로 저항을 주고, 2-3세트는 체중의 80%, 4-5세트는 체중의 90%, 6세트는 체중의 100%, 7세트는 체중에 20 g을 더하고, 8세트는 체중에 40 g을 더하여 사다리 등반운동을 실시하였다. Ivy et, al. [ 22]의 방법을 부분적으로 수정하여 적용한 트레드밀 유산소운동은 경사도를 0°로 고정하여 15-20 m/min 속도로 전동식 실험동물용 트레드밀(Quinton Instrument, Seattle, WA)을 이용하여 15분 운동하였다[ 23]. 운동 중간 휴식기에는 사료와 물의 섭취를 자유롭게 하였다.
3) 조직 적출
본 연구의 실험동물들은 각각의 희생단계에서 1회성 운동의 효과를 배제하기 위하여 운동프로그램을 종료한 후 48시간 휴식 후 희생하여 분석에 필요한 샘플을 수집하였다. 체중은 1주일 단위로 일정한 시간에 측정하였다. 흰쥐를 희생시키기 전 70 mg/kg의 ketamine (중외제약, 서울, 한국)과 10 mg/kg 의 Xylazine (중외제약, 서울, 한국)을 복강 내에 투여하여 전신마취시켰다. 조직적출을 위하여 이틀 전 운동을 중지하고 12시간 금식을 실시하고 sodium (5 mg/100 g of body mass)으로 마취하여 대동맥(arota), 골격근(tibialis anterior muscles) 및 심근(myocardium) 조직을 적출하였다[ 11]. 적출된 조직들은 clamp frozen하여 분석 전까지 -80°C에서 보관하였다.
4) Western immunoblotting analysis
각 조직세포의 HSP70 및 SOD1 단백질 발현은 western immunoblotting 방법으로 분석하였다[ 11]. 80°C에서 보관하였던 조직을 ice-cold buffer [250 mM sucrose, 10 mM HEPES/1 mM EDTA (pH 7.4), 1 mM Pefabloc (Roche), 1 mM EDTA, 1 mM NaF, 1 g/mL aprotinin, 1 g/mL leupeptin, 1 g/mL pepstatin, 0.1 mM bpV (phen), 2 mg/mL glycerophosphate]로 균질화하였다. 균질된 시료의 상층액에 2X SDS loading buffer (BIO-RAD, 161-0737)를 첨가한 후 10% seperating gel (30% acrylamide, 1.5 M tris pH 8.8, 10% Ammonium persulfate, TEMED)과 5% stacking gel (30% acrylamide, 1 M tris pH 6.8, 10% Ammonium persulfate, TEMED)을 조성하여 분주하였다. 각 샘플들이 완전히 내려갈 때까지 80 volt로 전기 영동하였다. Nitrocellulose Blotting Membrane (Life science, Germany)과 3 M paper (Whatman), 전기영동이 완료된 gel을 겹쳐 Transfer buffer (190 mM glycine, 50 mM Tris-base, 0.05% SDS, 20% methanol)에 넣은 채 80 volt로 90분 동안 전기영동하여 gel에서 Membrane으로의 단백질을 이동시켰다. 단백질 이동이 완료된 membrane은 90분간 5% BSA 용액 (10 mM Tris-base, HCl-pH 7.6, 0.5 M NaCl, 0.05% Tween20)으로 Blocking 시키고 1차 항체인 HSP70 (1:1,000, ab2787, abcam, USA), SOD1 (1:1,000, ab16931, Abcam, USA), β-actin (sc-47778, Santa Cruz, USA)을 blocking 용액과 12시간 동안 4°C에서 incubation시켰다. 1차 antibody incubation이 끝나면 TBS-T wash 용액으로 10분간 3회 washing한 후 2차 항체를 5% skim milk 용액과 1:5,000의 농도로 상온에서 2시간 동안 incubation시켰다. 2차 항체 incubation 후 TBS-T 용액으로 10분간 3회 washing을 실시한 후 WBLR solution (Millipole, USA)으로 단백질을 발광시켜 이미지 분석 시스템(Molecular Imager ChemiDoc XRS System, Bio-Rad, USA)으로 발색시킨 후 각 표본의 단백질량을 densitometry (sigma-plot 8.0 system)로 산출하였다.
3. 자료처리방법
모든 자료는 SPSS 21.0 통계 프로그램을 이용하여 각 그룹별 평균과 표준편차를 산출하였다. 측정변인들에 대한 그룹 및 시기 간 상호작용을 검정하기 위하여 one-way repeated ANOVA를 이용하였으며, 사후검정은 Tukey법을 적용하여 실시하였다. 통계적 유의수준은 5%(p<.05)를 기준으로 설정하였다.
연구 결과
1. 노화 흰쥐의 신체 구성
50주령 수컷 노화 흰쥐의 최종 체중은 HFD 그룹이 다른 세 그룹(ND, NDEx, & HFDEx)에 비해 유의하게 높게 나타났다( Fig. 1). 특히 일반식이 및 고지방 식이 그룹 모두 운동 그룹이 비운동 그룹에 비해 유의하게 감소하였다(ND vs. NDEx, HFD vs. HFDEx).
2. 복합 운동이 노화 흰쥐의 대동맥, 골격근 및 심장의 세포회복 단백질 발현에 미치는 영향
50주령 수컷 흰쥐의 12주간 사다리 저항성 운동과 트레드밀 유산소 운동이 복합적으로 구성된 복합 운동 트레이닝 수행결과 대동맥에서의 HSP70 단백질 발현은 NDEx 그룹과 HFD 그룹이 ND 그룹에 비해 유의하게( p<.01) 높게 나타났고, HFDEx 그룹이 NDEx 및 HFD 그룹보다 유의하게( p<.05) 낮았다( Fig. 2A). 그러나 골격근에서는 그룹 간 유의차가 나타나지 않았다( Fig. 2B). 심장근에서는 NDEx 그룹 및 HFDEx 그룹이 ND 그룹보다 유의하게( p<.01) 높게 나타났다( Fig. 2C).
3. 복합 운동이 노화 흰쥐의 대동맥, 골격근 및 심장의 항산화 효소 단백질 발현에 미치는 영향
50주령 수컷 흰쥐의 12주간 사다리 저항성 운동과 트레드밀 유산소 운동이 복합적으로 구성된 운동 트레이닝 수행 결과 대동맥에서의 SOD1 단백질 발현은 HFDEx 그룹에서 ND 그룹 및 NDEx 그룹에 비해 유의하게( p<.01) 높게 나타났다( Fig. 3A). 골격근에서는 NDEx 그룹 및 HFDEx 그룹이 ND 그룹보다 유의하게( p<.01) 높게 나타났다. 또한 HFD 그룹이 NDEx 그룹에 비해 유의하게( p<.01) 낮게 나타났으며 HFDEx 그룹이 HFD 그룹보다 유의하게( p<.01) 높게 나타났다( Fig. 3B). 심장근에서는 NDEx 그룹이 ND 그룹에 비해 유의하게( p<.05) 높게 나타났으며, HFD ( p<.01) 그룹 및 HFDEx ( p<.05) 그룹은 NDEx 그룹에 비해 낮게 나타났다( Fig. 3C).
논 의
운동은 노화에 의해 손상된 심근조직 및 세포의 대사적 기질 산화와 운반에 관련된 단백질의 발현량을 증가시켜, 심근의 대사적 효율성 증가와 심근 보호 기능을 향상시키는데 영향을 미친다[ 24, 25]. 산화적 스트레스를 제어하기 위해 운동은 신체 내 조직에서 SOD, 등의 항산화효소의 활동을 자극시켜 조직을 보호하며, 특히 심근경색 부위를 감소시킨다[ 26]. 혈청 HSP70의 높은 수준은 죽상(atherogenesis) 생성을 억제하여 관상동맥경화증 발생을 감소시킨다[ 27]. 또한 HSP70 유전자 형질주입(transfection) 연구에서 허혈-재관류 손상(ischemia-reperfusion injury)에 대하여 심근을 보호한다고 보고하였다[ 28]. 그러나 간헐적 파행(claudication), 심각한 하지 허혈 및 동맥류(aneurysms) 환자에서는 HSP70 항체 수준이 낮게 나타났다고 하였다[ 29]. 그러나 죽상 경화증 발병에서 HSP70의 역할은 연구결과에 따라 다소 논쟁의 여지가 있다. Fig. 2에서 나타난 바와 같이 NDEx 그룹 및 HFDEx 그룹의 운동 그룹은 심근조직에서 HSP70 단백질 발현이 높게 나타났다. 24개월된 노화 쥐의 연구에서 분당 30 m 속도로 하루 45분 동안 주당 5일, 6주간 트레드밀 러닝 운동 결과 심장조직에서 HSP70 단백질 발현이 증가되었으며[ 11], 2개월된 수컷 흰쥐의 주당 3일, 14주 동안 트레드밀 운동 후 심장조직에서 HSP70 단백질 발현이 증가하였고[ 18], 70-75%VO 2max 강도의 60분 동안 급성운동 후 4개월 젊은 수컷 쥐와 21개월 노화 쥐의 심장에서 HSP70 단백질 발현이 증가되었다고 보고되어[ 12] 본 연구의 심근조직에서의 운동효과와 비슷한 결과를 나타내었다. 그러나 하루 60분 동안 주당 5일, 12주 동안 트레드밀 운동을 한 연구에서 좌심실의 HSP70 단백질 발현이 6개월된 젊은 쥐는 비운동군에 비해 증가되었으나 27개월 노화 쥐에서는 변화가 없었다고 보고[ 30]되었으며, 6-8주령 수컷 쥐의 14주 동안 수영훈련 결과 심실근 조직에서 HSP70 단백질 발현의 변화가 나타나지 않았다[ 13]. 이러한 결과 운동이 심근조직의 세포회복인자 발현에 영향을 미친다고 생각되지만 연령, 운동기간, 운동형태 및 운동강도에 따라 결과의 차이가 있어 후속적인 연구가 필요할 것이다. 아울러 본 연구의 골격근에서는 4그룹 간에 HSP70 단백질 발현의 유의한 차가 나타나지 않았다. 그러므로 조직에 따라 단백질 발현 수준 및 발현 양상이 다를 수 있으며 각 조직 세포 특성의 차이인지 중간기전의 차이인지에 대한 본 연구에서는 알 수 없으며 지속적인 연구가 필요할 것이다.
Fig. 3에서 나타난 바와 같이 심근조직에서 운동 그룹이 SOD1 단백질 발현이 비교적 높게 나타났으며 특히 골격근에서는 운동 그룹이 비운동 그룹에 비해 유의하게 높게 나타났다(ND vs. NDEx, HFD vs. HFDEx). 24개월 노화 수컷 쥐의 분당 30 m 속도로 1일 45분씩 6주간 트레드밀 운동을 한 연구에서 심장조직에서 SOD1 단백질 발현이 증가하였으며[ 11], 성인 암컷 쥐의 20주간 운동 후 심실에서 SOD1 단백질 발현이 증가하였다고 보고되어[ 31] 본 연구의 심근조직 결과와 일치하였다. 그러나 연령에 따른 동물 연구에서 젊은 쥐(3개월)와 노화 쥐(30개월)의 저항성 운동을 4주간 실시한 결과 골격근에서 SOD1 단백질 발현이 젊은 쥐에서는 증가하였으나 노화 쥐는 오히려 감소하였으며[ 15], 젊은 수컷 쥐(3-5개월)와 노화 쥐(24-27개월)의 탈진적인 운동을 한 결과 골격근과 심장 조직에서 젊은 쥐는 두 조직 모두 SOD1이 활성화 되었으며 노화 쥐는 심장에서만 SOD1가 활성화되었다[ 14]. 또한 암컷 쥐의 탈진적인 급성 트레드밀 운동 후 골격근에서 SOD1 단백질은 증가하였으나 SOD1 mRNA는 활성화되지 않았다[ 32]. 이상의 선행연구에서도 연령, 운동형태 및 운동기간에 따라 결과의 차이가 나타났으며, 노화 쥐의 심근 및 골격근 조직에서도 발현정도가 일치하지 않았다.
고지방식이를 한 수컷 쥐의 60분씩 주당 5일, 12주간 달리기 운동은 대동맥과 장간막동맥(mesenteric artery)에서 비운동군에 비해 상대적으로 SOD1가 증가하였으며[ 16], 당뇨병성 젊은 수컷 생쥐의 10주간 트레드밀 운동 후 대동맥에서 SOD1 단백질 발현이 증가하였다고 보고되어[ 33] 본 연구결과를 뒷받침하였다. 본 연구의 대동맥에서의 HFDEx 그룹은 12주간 운동 프로그램 수행 후 SOD1 단백질 발현이 ND 및 NDEx 그룹보다 높게 나타났으며, 골격근에서는 ND 및 HFD 그룹보다 높게 나타났다. 이러한 결과는 대동맥에서는 식이처치에 따라 유의차가 나타났으며, 골격근에서는 운동처치에 의한 유의차가 나타났다. 세포의 분자생물학 수준에서의 발현이 전체 기전 및 기능에 직접적인 연관이 강력하지는 않다. 그러나 표적세포의 세포회복 측면에서 역으로 고려해볼 때 중요하고 강조되어야 할 부분은 예측할 수 있지만 본 연구에서는 분명히 알 수 없다. 그러므로 골격근의 결과에서 중강도 장기간 신체활동이 미토콘드리아를 통해 발생시키는 활성산소는 세포 내에서 적응성 역반응을 하는데 이는 활성산소 신호를 활성화시켜 오히려 심한 산화적 스트레스에 의한 항산화 능력이 증진된 것[ 34]으로 생각된다. 그러나 생쥐의 분당 15 m 속도로 하루 30분씩 주당 5일, 3주간 트레드밀 달리기 운동 후 대동맥에서 SOD1 단백질 발현의 변화는 없었다고 보고되어[ 17] 운동의 강도와 기간에 따라 세포 내 다양한 요인들의 상호작용에 의해 체내 적응 반응이 다른것으로 생각된다. 또한 9주된 고혈압 암컷 쥐의 5주동안 자발적 휠(wheel) 러닝을 한 후 대동맥에서는 HSP70 유전자 발현이 감소하였으나, 대동맥 혈관벽에서는 산화적 스트레스가 감소되어 대동맥 조직에서 CuZnSOD의 높은 상향 조절 기능과 염증성 사이토카인 분비가 감소되어 운동이 새로운 항죽종성 기전 역할을 한다고 보고하였다[ 35]. HSP는 세포사멸 또는 세포손상 동안 세포외기질(extracellular)로 배출될 수 있으며, 세포외기질의 HSP60 및 HSP70은 염증성 사이토카인의 생성 및 분비를 유도하는 것으로 나타났다[ 36]. 그러므로 본 연구결과에서도 대동맥의 높은 항산화효소 발현이 세포회복기전과 패턴이 일치하지 않아 대동맥 벽 확장성 개선과 함께 HSP 발현과 혈관 기능 사이의 잠재적 인과관계가 있으므로 지속적인 연구가 필요할 것이다. HSP의 샤페론 활성은 전사(transcription), 번역(translation), 분비(release)를 제어하는 명확한 기전이 있을 수 있지만 HSP 발현의 조절은 주전사 수준에서 발생하는 것으로 나타났으며, HSP의 세포 내 과발현은 단백질을 세포 표면으로 전위시키는 것으로 나타났다[ 37]. HSP 발현은 분석된 조직에 따라 발현정도가 다르게 나타나는데 양의 소뇌 또는 연수에서 전사 수준의 변화가 관찰되지 않았지만, 전두엽 피질에서 HSP27 및 HSP90의 현저한 감소가 검출되어 HSP는 뇌손상의 항세포사멸 과정보다 신경 교착 및 염증 반응에 관여하는 것으로 보인다고 보고되었다[ 38]. 본 연구에서도 대동맥, 골격근 및 심근의 HSP70 단백질 발현 정도의 차이나 나타나 세포사멸 과정과 더불어 다른 과정도 발생 가능성이 있지만 아직 불분명하므로 세부적인 추후연구가 필요할 것이다. 특히 장기간 운동은 골격근 적응이 완벽히 이루어져 미토콘드리아 생합성이 충분히 이루어져 산화적 스트레스 생성자체가 감소되고, 산화적 스트레스가 생성되더라도 미토콘드리아에 존재하는 항산화 효소에 의한 효과적인 방어능력의 증가로 인해 조절된다[ 39]. 그러므로 선행연구의 결과에 의해 골격근에서의 단백질 발현은 대동맥 및 심근보다 운동기간이 좀 더 영향을 미치는 것으로 판단된다. 아울러 장기간의 운동 적응이 골격근뿐만 아니라 대동맥 및 심근의 HSP70 단백질 발현을 높은 수준으로 유지시켜줌으로써 심근세포의 스트레스에 대한 저항력을 증진할 수 있는 가능성을 확인한 것으로 생각된다. 그러나 HSP70 및 SOD1 단백질의 활성이 운동에 의해 나타났다 하더라도 세포사멸의 변화로 세포손상에 직접적인 영향을 규명하지 못한 한계점이 있기에 세포회복기전의 측면에서 세포사멸 관련인자들의 변인과 연령에 따른 운동프로그램의 강도와 시간에 대한 추가적인 연구가 필요하다.
결 론
50주령 비만 유도 흰쥐의 12주간 복합운동은 심근에서 HSP70 단백질 발현이 높게 나타났으며 대동맥, 골격근 및 심근 세포에서 SOD1 단백질 발현이 증가하였다. 그러므로 비만 노화 쥐를 대상으로 한 운동처치는 심근 세포 회복 단백질 및 항산화 효소 활성 기능을 개선시킨 것으로 생각된다.
Acknowledgements
본 연구는 한국연구재단의 재원(NRF-2017R1A2B1008644)으로 연구되었다.
Fig. 1.
Fig. 1.Changes in body weight during high fat diet-induced obesity induction and exercise intervention.*p<.05 vs. ND group by one-way ANOVA; #p<.05 vs. the NDEx group by one-way ANOVA; !p<.05 vs. the HFD group by one-way ANOVA. ND, normal diet; NDEx, normal diet+exercise; HFD, high fat diet; HFDEx, high fat diet+exercise. 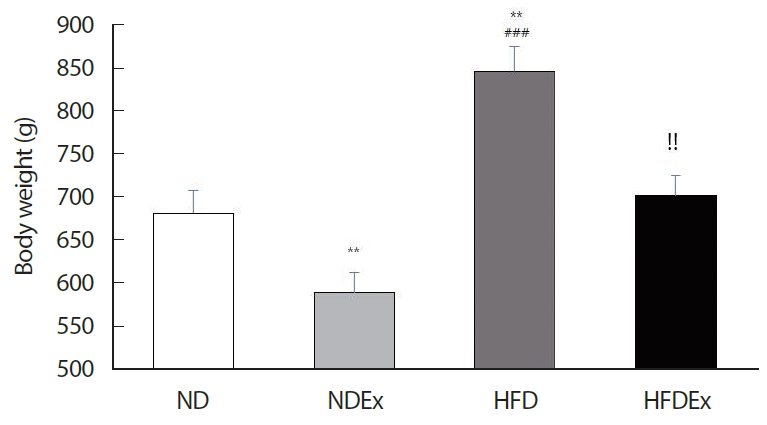
Fig. 2.
Fig. 2.Comparison of HSP20 protein expression in ND, NDEx, HFD, and HFDEx groups. (A) Arota, (B) Skeletal muscle, (C) Myocardium. Results represent the mean±SE. *p<.05 vs. ND group by one-way ANOVA; #p<.05 vs. the NDEx group by one-way ANOVA; !p<.05 vs. the HFD group by one-way ANOVA. ND, normal diet; NDEx, normal diet+exercise; HFD, high fat diet; HFDEx, high fat diet+exercise. 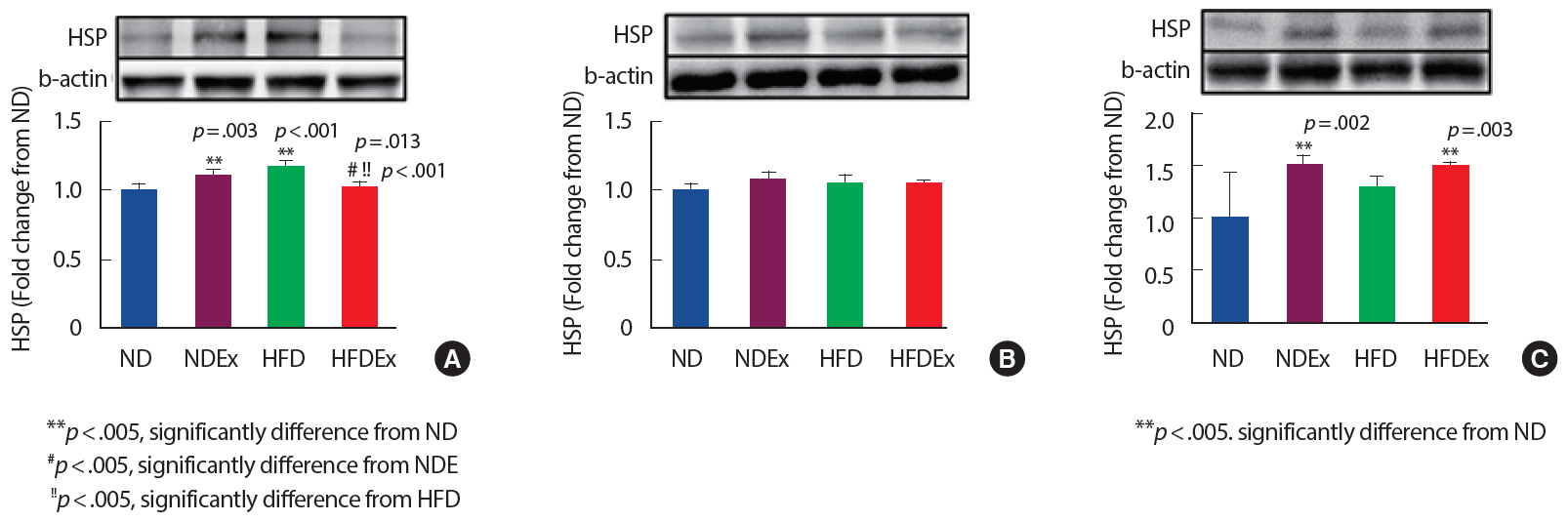
Fig. 3.
Fig. 3.Comparison of SOD1 protein expression in ND, NDEx, HFD, and HFDEx groups. (A) Arota, (B) Skeletal muscle, (C) Myocardium. Results represent the mean±SE. *p<.05 vs. ND group by one-way ANOVA; #p<.05 vs. the NDEx group by one-way ANOVA; !p<.05 vs. the HFD group by one-way ANOVA. ND, normal diet; NDEx, normal diet+exercise; HFD, high fat diet; HFDEx, high fat diet+exercise. 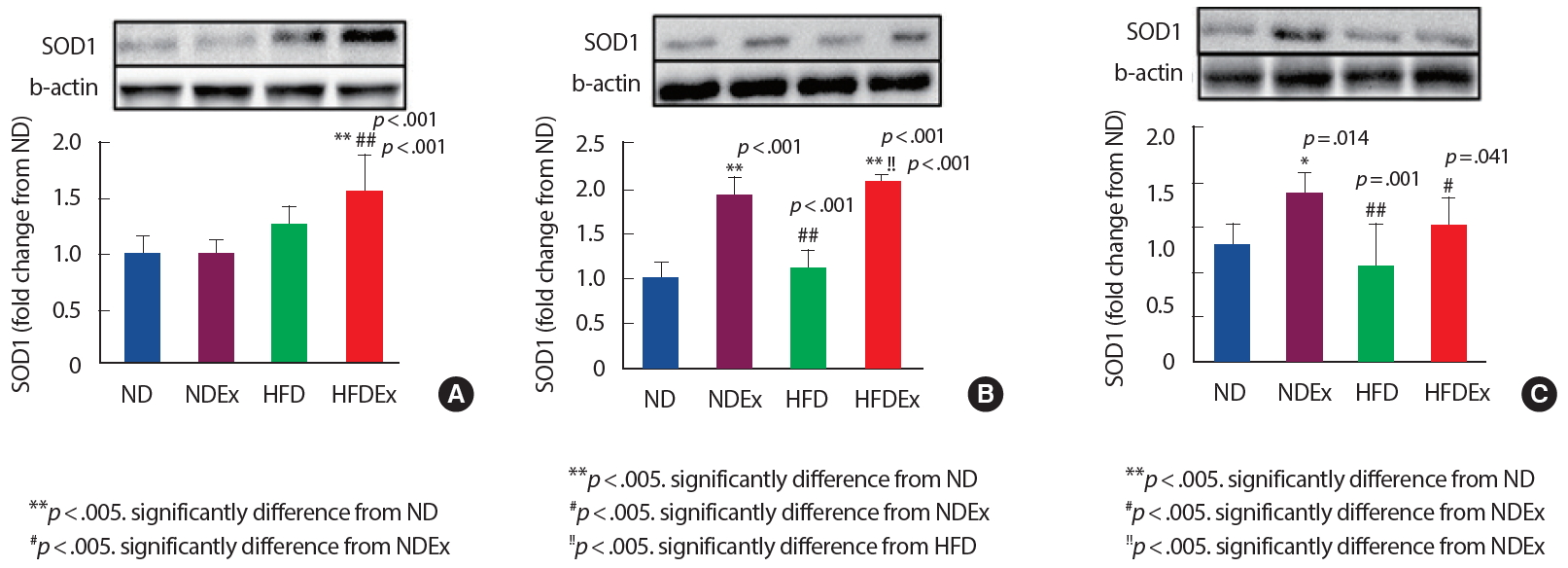
Table 1.
Classification of experimental groups in 50 week old rats
|
Group |
n |
Classification |
|
ND |
10 |
Normal diet |
|
NDEx |
10 |
Normal diet+Combine exercise |
|
HFD |
10 |
High fat diet |
|
HFDEx |
10 |
High fat diet+Combine exercise |
Table 2.
Dietary compositions of normal diet and high fat diet induced groups
|
Variable |
Dietary compositions |
|
Normal diet |
Carbohydrate 64.5%, fat 11.8%, protein 23.5%/total kcal |
|
High fat diet |
Carbohydrate 30%, fat 50%, protein 20%/total kcal |
REFERENCES
1. Reeve JL, Duffy AM, O’brein T, Samali A. Don’t lose heart therapeutic value of apoptosis prevention in the treatment of cardiovascular disease. J Cell Mole Med. 2000;9:609-22.  2. Powers SK, Quindry JC, Kavazis AN. Exercise-induced cardioprotection against myocardial ischemia-reperfusion injury. Free Radic Biol Med. 2008;44:193-201.   3. Niku KJ, Oksala E, David E, Laaksonen J, Savita L, et al. Heat shock protein 60 response to exercise in diabetes effects of a-lipoic acid supplementation. J Diabetes Complications. 2006;20:257-61.   4. Schmitt E, Parcellier A, Gurbuxani S, Cande C, Hammann A, et al. Chemosensitization by a non-apoptogenic heat shock protein 70-binding apoptosis-inducing factor mutant. Cancer Res. 2003;63(23):8233-40.  5. Rajdev S, Hara K, Kokubo Y, Mestril R, Dillmann W, et al. 2000. Mice overexpressing rat heat shock protein 70 are protected against cerebral infaction. Ann Neurol. 2000;47:782-91.   6. Delgado J, Gonzalez B, Manso R, Megias A. Responses of rat myocardial antioxidant defences and heat shock protein HSP72 induced by 12 and 24-week treadmill training. Acta Physiol Scand. 2004;180:157-66.   7. De Haan JB, Crack PJ, Flentjar N, Iannello RC, Hertzog PJ, et al. An imbalance in antioxidant defense affects cellular function: the pathophysiological consequences of a reduction in antioxidant defense in the glutathione peroxidase-1 (Gpx1) knockout mouse. Redox Rep. 2003;8(2):69-79.   8. Powers SK, Quindry J, Hamilton K. Aging, exercise, and cardioprotection. Annals of the New York Academy of Sciences. 2004;1019:462-70.   9. Durrant JR, Seals DR, Connell ML, Russell MJ, Lawson BR, et al. Voluntary wheel running restores endothelial function in conduit arteries of old mice: direct evidence for reduced oxidative stress, increased superoxide dismutase activity and down-regulation of NADPH oxidase. J Physiol. 2009;587:3271-85.  11. Rinaldi B, Corbi G, Boccuti S, Filippelli W, Rengo G, et al. Exercise training affects age-induced changes in SOD and heat shock protein expression in rat heart. Exp Gerontol. 2006;41(8):764-70.   12. Starnes JW, Taylor RP, Park Y. Exercise improves postischemic function in aging hearts. Am J Physiol Heart Circ Physiol. 2003;285(1):H347-51.   13. Ascensão A, Magalhães J, Soares J, Ferreira R, Neuparth M, et al. Endurance training attenuates doxorubicin-induced cardiac oxidative damage in mice. Int J Cardiol. 2005;100(3):451-60.   14. Navarro-Arévalo A, Ca˜navate C, Sánchez-del-Pino MJ. Myocardial and skeletal muscle aging and changes in oxidative stress in relationship to rigorous exercise training. Mech Ageing Dev. 1999;108(3):207-17.   15. Murlasits Z, Cutlip RG, Geronilla KB, Rao KMK, Wonderlin WF, et al. Resistance training increases heat shock protein levels in skeletal muscle of young and old rats. Exp Gerontol. 2006;41(4):398-406.  17. Fukai T, Siegfried MR, Ushio-Fukai M, Cheng Y, Kojda G, et al. Regulation of the vascular extracellular superoxide dismutase by nitric oxide and exercise training. J Clin Invest. 2000;105(11):1631-9.  19. Powers SK, Lennon SL, Quindry J, Mehta JL. Exercise and Cardioprotection. Curr Opin Cardiol. 2002;17:495-502.   20. Hancock CR, Han DH, Chen M, Terada S, Yasuda T, et al. High-fat diets cause insulin resistance despite an increase in muscle mitochondria. Proc Natl Acad Sci USA. 2008;105(22):7815-20.   21. Lee S, Barton ER, Sweeney HL, Farrar RP. Viral expression of insulin-like growth factor-I enhances muscle hypertrophy in resistance-trained rats. Journal of Applied Physiology. 2004;96(3):1097-104.   22. Ivy JL, Young JC, MclLane JA, Fell RD, Holloszy JO. Exercise training and glucose uptake by skeletal muscle in rats. J Appl Physiol. 1983;55:1393-6.   23. Haddad F, Adams GR. Aging-sensitive cellular and molecular mechanisms associated with skeletal muscle hypertrophy. J Appl Physiol. 2006;100:1188-203.   24. Atalay M, Oksala NK, Laaksonen DE, Khanna S, Nakao C, et al. Exercise training modulates heat shock protein response in diabetic rats. J Appl Physiol. 2004;97:605-11.   25. Siu PM, Bryner RW, Martyn JK, Alway SE. Apoptotic adaptations from exercise training in skeletal and cardiac muscles. FASEB J. 2004;18:1150-2.   26. Domennech RJ. Precondition. A new concept about the benefit of exercise. Circulation. 2006;113:e1-e3.   27. Zhu J, Quyyumi AA, Wu H, Csako G, Rott D, et al. Increased serum levels of heat shock protein 70 are associated with low risk of coronary artery disease. Arterioscler Thromb Vasc Biol. 2003;23:1055-9.   28. Jayakumar J, Suzuki K, Sammut IA, Smolenski RT, Khan M, et al. Heat shock protein 70 gene transfection protects mitochondrial and ventricular function against ischemia-reperfusion injury. Circulation. 2001;104:303-7.  29. Pockley AG, De Faire U, Kiessling R, Lemne C, Thulin T, et al. Circulating heat shock protein and heat shock protein antibody levels in established hypertension. J Hypertens. 2002;20:1815-20.   31. Brown DA, Jew KN, Sparagna GC, Musch TI, Moore RL. Exercise training preserves coronary flow and reduces infarct size after ischemia-reperfusion in rat heart. J Appl Physiol. 2003;95(6):2510-8.   32. Hollander J, Fiebig R, Gore M, Ookawara T, Ohno H, et al. Superoxide dismutase gene expression is activated by a single bout of exercise in rat skeletal muscle. Pflügers Archiv. 2001;442(3):426-34.   33. Ristow M, Schmeisser S. Extending lifespan by increasing oxidative stress. Free Radic Biol Med. 2011;51:327-36.   35. Hägg U, Johansson ME, Grönros J, Naylor AS, Jonsdottir IH, et al. Gene expression profile and aortic vessel distensibility in voluntarily exercised spontaneously hypertensive rats: potential role of heat shock proteins. Physiol Genomics. 2005;22(3):319-26.   37. Pirkkala L, Nykanen P, Sistonen L. Roles of the heat shock transcription factors in regulation of the heat shock response and beyond. FASEB J. 2001;15:1118-31.   39. Kim SH, Ahn NY, Hong CB, Kim KJ. The effect of acute and prolonged endurance awim exercise on antioxidant and mitochondrial enzymes in rat skeletal muscle. Exerc Sci. 2011;20(4):359-66. 
|
|








