운동중지가 기억력 장애 흰쥐 뇌조직의 ACh, AChE, β-amyloid, Apolipoprotein 발현 및 인지기능에 미치는 영향
Abstract
PURPOSE
The purpose of this study was to investigate the effects of detraining on ACh, AChE, β-amyloid, apolipoprotein expression and cognitive function in brain tissue of memory impairment rats.
METHODS
Sparague-Dawley rats (n=40) were randomly divided into 4 groups (age=7 weeks, n=10 in each group): control group (CON), scopolamine-induced control group (SCO-CON), scopolamine+low intensity exercise group (SCO-LEX), and scopolamine+high intensity exercise group (SCO-HEX). The exercise groups were trained progressively on a treadmill, five days per a week for eight weeks following treadmill running programs: i) low intensity (1-4 weeks: 10 m/min for 30 min, 5-8 weeks: 12 m/min for 30 min), ii) high intensity (1-4 weeks: 15 m/min for 30 min, 5-8 weeks: 16 m/min for 30 min). After 8 weeks-exercise programming, detraining was conducted for the same period.
RESULTS
After detraining for 8 weeks, both exercise groups significantly increased Ach concentration compared with SCO-CON. Exercise groups significantly reduced AChE activity, β-amyloid and ApoE ε4 protein volumes compared to the SCO-CON. Both exercise groups showed a significant decrease of escape latency compared to the control group.
CONCLUSIONS
In spite of the effects of detraining, regular exercise is still considered to have a positive influence on the changes of memory impairment related factors.
색인어: 운동중지, 스코폴라민, 인지기능, 기억손상, 콜린성 시스템
Keywords: Detraining, Scopolamine, Cognitive function, Memory impairment, Cholinergic
서 론
알츠하이머(Alzheimer’s disease, AD)는 기억력과 일상적 활동을 수행하는 데 필요한 인지 기능의 점진적인 저하를 나타내며, 치매(Dementia)의 가장 주요한 유형의 하나로 알려져 있다[ 1]. 현재까지 AD에 대한 기전은 명확히 밝혀지고 있진 않지만 대다수의 선행연구들은 산화스트레스와 cholinergic damage를 AD의 주요 요인으로 간주하고 있으며[ 2, 3], 이와 더불어 amyloid plaques, neurofibrillary tangles는 AD에 관여하는 단백질로 보고되고 있다[ 4]. 중추 콜린성 신경계의 감퇴는 인지기능과 기억력 저하를 초래하고 Acetylcholin (Ach)은 신경전달물질로 대뇌피질과 해마의 발달에 중요한 역할을 하는 것으로 이들의 순환 농도는 Acetylcholinesterase (AchE)에 의해 조절되는데, AchE는 Ach를 빠르게 가수분해 시킴으로써 인지능력을 저하시키는 것으로 보고되고 있다[ 5]. 이와 함께 지난 10년 동안 가장 널리 수용되고 있는 패러다임으로써 amyloid 이론은 세포 외 amyloid plaques가 뇌 세포 사멸에 관여하여 결과적으로 치매증상이 나타나는 것으로 인식되고 있으며 이 밖에도 과인산화 tau 단백질로 구성된 neurofibrillary tangles는 AD와 연관된 또 다른 위험 요인이다[ 6- 10]. Apolipoprotein E (ApoE)는 뇌 주요 아포지단백의 하나로 지질과 Aβ를 수송하는 역할을 한다. ApoE는 세가지 variants (ApoE-ε2, ApoE-ε3, ApoE-ε4)가 존재하고 ε2는 AD에 방어적인 반면, ε4 대립형질은 AD 발생에 가장 큰 위험인자로 특히 AD 환자들에서 ε4가 높은 빈도를 보이며 증가하는 것으로 보고된바 있다[ 11, 12]. AD 개선과 치료를 위한 가장 효율적인 방법 중 하나로 약리적 접근은 방출된 Ach 분해를 억제하기 위하여 AchE 억제제를 투여함으로써 cholinergic 신경전달을 강화시키는 것으로 알려져 있다[ 13]. 이와 더불어 최근 식이요법과 운동 및 신체활동 등의 다양한 라이프스타일 중재는 AD 초기 치료와 예방을 위한 뇌 형태 및 기능 조절에 긍정적 결과를 가져올 수 있는 것으로 보고되고 있다. 이와 관련하여 Maliszewska-Cyna et al. [ 14]은 신체활동이 AD와 관련된 인지 장애 및 병태를 지연 또는 경감시켜 전반적인 뇌 건강을 향상시키는 잠재력을 지니고 있으며, 다양한 형태의 운동은 해마의 신경발달을 증가시키고 기억력 개선에 긍정적 영향을 미치는 것으로 보고되고 있다[ 15, 16]. 하지만 선행연구의 결과들은 AD의 개선에 대한 운동의 효과성에 초점을 두고 있어 규칙적인 운동의 효과가 어느 정도 지속되는지에 대한 연구는 희소한 실정이다. 운동의 지속적 실천은 다양한 외부적 환경에 의해 제약을 받을 수 있으며, 운동중지(detraining)가 AD와 관련된 위험요인의 변화에 미치는 영향을 보고한 선행연구는 다소 제한적이며 미흡한 실정이다. 따라서 본 연구에서는 기억력 장애 흰쥐를 대상으로 8주간의 운동 강도별 트레드밀 운동 효과에 대한 후속 연구로서 뇌 조직에서 detraining에 의한 기억력 장애 요인들의 변화를 살펴보고자 하였다.
연구 방법
1. 실험동물 및 식이방법
실험동물은 7주령의 SD계 수컷 흰쥐(body weight: 187.8±5.6 g) 40마리를 통제그룹(CON: n =10), scopolamine 투여그룹(SCO-CON: n =10), scopolamine 투여+저강도 트레드밀 운동그룹(SCO-LEX: n =10), scopolamine 투여+고강도 트레드밀 운동그룹(SCO-HEX: n =10)으로 구분하였다. 식이는 전 실험기간 동안 고형사료(단백질 22.5%, 지방 3.5%, 저섬유 7.5%, 회분 9.0%, 칼슘 0.7%, 인 0.5%)와 물을 충분히 섭취하도록 하였으며, 실험기간에 동물실험윤리규정에 따라 동물의 고통과 불편을 최소화 하도록 노력하였다.
2. 연구절차
1) 운동 처치
운동강도는 선행연구[ 17, 18]를 참고하여 scopolamine 투여 +저강도 트레드밀 운동그룹(SCO-LEX)은 1-4주에는 주당 5일간 10 m/min, 5-8주에는 주당 5일간, 12 m/min의 속도로 1회당 30분 운동을 실시하였다. Scopolamine 투여 고강도 +트레드밀 운동그룹(SCO-HEX)은 1-4주에는 주당 5일간 15 m/min, 5-8주에는 주당 5일간, 16 m/min의 속도로 운동을 실시하였다. 8주간의 운동이 종료된 후 8주 동안 동일한 식이와 실험실 환경조건을 유지한 상태에서 detraining을 실시하였다.
2) 기억력 손상 유도
실험동물은 3일간의 실험실 환경의 적응기간을 거쳐 노인성 치매의 특징인 아세틸콜린계의 효소를 감소시키기 위해 무스카린 수용체 길항제(muscarinic receptor antagonist)로 알려진 scopolamine (Sigma-Aldrich Co, USA) 1 mg/kg을 0.9% 식염수 1 mL에 용해하여 7일동안 1일 1회 복강 내에 주사하여 기억력 손상을 유발하였다[ 19].
3) 인지능력 평가
인지능력 사전훈련은 scopolamine 투여 전에 1회 실시하였으며, 트레드밀 운동 8주 후에 운동이 끝나고 24시간이 지난 다음 실시하였다. 모리스 수중미로는 원형풀(지름 120 cm, 높이 60 cm)이며, 여기에 수심 35 cm로 물(25°C±2°C)을 채웠다. 그 후 수중미로를 4개의 동일한 4분원으로 나누어 구분하고, 남서(SW) 사분원의 중심부에 원형 platform (지름 10 cm, 높이 30 cm)을 설치한 후 실험동물이 육안으로 platform을 볼 수 없도록 오징어 먹물 가루로 물을 불투명하게 하였다. platform의 표면은 거칠게 처리해 실험동물이 쉽게 기어오를 수 있도록 하였다( Fig. 1). 60초 동안 수중미로 내부를 자유롭게 이동한 실험동물이 60초 후에도 platform에 도달하지 못할 경우 실험동물을 자연스럽게 platform으로 유도한 후 30초 동안 머물러 있게 함으로서 시각적 단서에 익숙해지도록 하였다. 최종 테스트는 8주후 실험동물을 희생시키기 전에 60초간 자유수영 검사를 실시하여 platform에 도달하는 시간을 영상추적 프로그램(Panlab, S.L.U, Spain)을 이용하여 인지능력을 평가하였다[ 20, 21].
4) 조직시료의 준비
모든 동물은 실험이 종료된 24시간 경과 후 Zoletil 50 Ⓡ (10 mg/kg, i.p.; Vibac Laboratories, Carros, France)을 이용하여 마취한 후 Mathis et al. [ 22]의 방법을 참고하여 대뇌 피질과 해마 조직을 추출하였다. 조직을 추출한 후 증류수로 혈액을 완전히 제거하고 4°C 0.25 M sucrose를 포함하는 5 mM potassium phosphate buffer (pH 6.5) 용액을 각 시료조직의 3배(w/v) 가한 후 autohomogenizer (GTR-1000, Tokyo Rikak-Mikai Co., Ltd., Tohyo, Japan)로 파쇄하여 25,000 rpm에서 30분간 원심분리하고 상층액을 취하여 시료로 사용하였다.
5) Ach 함량 측정
대뇌피질의 Ach은 Lee et al. [ 23]의 방법으로 측정하였다. 대뇌피질 부위를 적출한 균질액(12 mM sodium phosphate buffer pH 7.0. 400 mM NaCl) 50 mL를 취하여 1% hydroxylamine 50 mL를 첨가하여 혼합한 후 HCl을 이용하여 pH를 1.2±0.2로 조절한 후 Fecl3 (10% in 0.1 N HCl)을 500 mL를 첨가하여 분광광도계(UV-160A, Shimadzu Co., Kyoto, Japan)를 이용하여 540 nm에서 흡광도를 측정하였다.
6) AchE 활성 측정
대뇌피질의 AChE 활성의 측정은 선행연구[ 24, 25]방법을 참고하여 측정하였다. 각 microplate well에 0.1 M Tris buffer, pH 8.0 (Trizma HCl+ Trizma base)을 300 μL, 0.01 M dithionitrobenzoic acid (DTNB; Sigma Aldrich Corporation, St. Louis, MO, USA) 20 μL, enzyme suspension 10 μL을 연속적으로 첨가하고 흡광도 측정직전에 기질인 0.1 M acetylthiocholine chlo ride (Sigma, Aldrich Corporation ) 10 μL을 첨가한 후, 96 well microplate reader (ELISA reader)를 이용하여 405 nm에서 흡광도 변화를 5분 동안 관찰하여 AChE의 활성(unit/min/mg protein)을 측정하였다.
7) Western blotting을 이용한 Aβ, apolipoprotein 분석
해마의 Aβ, apolipoprotein 발현을 분석하기 위하여 Gel상의 단백질을 15 mM Tris-glycine buffer (190 mM glycine, 50 mM Tris-base, 0.05% SDS, 20% methanol)를 사용하여 100 V에서 1시간 동안 PVDF membrane (Pall Corporation, USA)에 transfer 하였다. 그 후 membrane을 TBS 시약으로 10분씩 3차례 washing하고, blocking buffer (TBS 34 mL, BSA 1.05 g)에서 1시간 동안 shaking시킨 후, primary antibody (Aβ: santactuz, ApoE: santacruz)를 blocking buffer에 1:1,000의 비율로 희석하여 cold room에서 overnight하였다. Membrane을 씻어내고 secondary antibody (anti-rabbit IgR)를 1:2,000의 비율로 희석하여 상온에서 1시간 동안 처리하고 washing 후, 마지막으로 membrane에 부착된 단백질을 western blotting detection system을 이용하여 측정하였으며, density meter (Sharp jx-330)를 이용하여 스캔한 후, 단백질의 정량분석은 이미지 분석 프로그램(Image Master ver. 3.0, Pharmacia Biotechnology, Piscataway., NJ, USA)을 이용하여 산출하였다.
3. 자료처리방법
통계적 자료 분석을 위해서 SPSS version 20을 이용하여 각 집단의 평균 및 표준편차를 산출하였다. 운동 중지에 따른 뇌 조직 Ach, AchE, 인지기능, Aβ, apolipoprotein 발현 차이를 알아보기 위하여 일원변량분석(One-way between measures ANOVA) 실시하였다. 일원변량분석 후 통계적 차이가 있을 경우, 사후검증으로 Duncan을 이용하여 그 차이를 알아보았다. 통계적 유의수준(α)은 .05로 설정하였다.
연구 결과
1. 8주간의 운동 중지 후 대뇌피질의 Ach 농도
8주간의 운동 중지 후 대뇌피질의 Ach 농도 변화에 대해 분석한 결과 모든 그룹 간 유의한 차이가 나타났으며( p<.05), 사후 검증결과 Ach 농도는 운동그룹이 scopolamine 투여 통제그룹에 비하여 통계적으로 유의하게 높게 나타났으나( p<.05) ( Fig. 2), 운동 강도별 유의한 차이는 없었다.
2. 8주간 운동 중지 후 대뇌피질의 AchE 활성
8주간의 운동 중지 후 대뇌피질의 AchE 활성을 비교한 결과, 통제그룹(CON: n =10), Scopolamine 투여 통제그룹(SCO-CON: n =10), Scopolamine 투여+저강도 트레드밀 운동그룹(SCO-LEX: n =10), Scopolamine 투여 고강도+트레드밀 운동그룹(SCO-HEX: n =10) 간 유의한 차이가 나타났으며( p< .05) 사후검증 결과, AchE 활성은 트레드밀 운동그룹이 Scopolamine 투여 통제 그룹보다 유의하게 감소되었다( p< .05) ( Fig. 3). 운동강도에 따른 집단 간 차이는 고강도 운동그룹이 저강도 운동그룹에 비해 증가하는 경향을 나타내었지만 유의한 차이는 나타나지 않았다.
3. 8주간 운동 중지 후 도피잠재기
8주간의 운동 중지 후 도피잠재기를 비교한 결과 Fig. 4와 같이 통제그룹(CON: n =10), Scopolamine 투여 통제그룹(SCO-CON: n =10), Scopolamine 투여+저강도 트레드밀 운동그룹(SCO-LEX: n =10), Scopolamine 투여+고강도 트레드밀 운동그룹(SCO-HEX: n =10) 간 유의한 차이가 나타났으며( p<.05) 사후검증 결과, 도피잠재기는 트레드밀 운동집단이 Scopolamine 투여 통제 집단보다 유의하게 감소하였다( p< .05) ( Fig. 4).
4. 8주간 운동 중지 후 해마 β-amyloid 발현
8주간 운동 중지 후 해마 β-amyloid 발현을 비교한 결과 Fig. 5와 같이 통제그룹(CON: n =10), Scopolamine 투여 통제그룹(SCO+CON: n =10), Scopolamine 투여+저강도 트레드밀 운동그룹(SCO-LEX: n =10), Scopolamine 투여+고강도 트레드밀 운동그룹(SCO-HEX: n =10) 간 유의한 차이가 나타났으며( p< .05). 사후검증 결과, β-amyloid 발현은 트레드밀 운동집단이 Scopolamine 투여 통제 집단보다 유의하게 감소하였다( p< .05) ( Fig. 5).
5. 8주간 운동 중지 후 해마 ApoE ε4 발현 변화
8주간의 운동 중지 후 해마의 ApoEε4 발현을 비교한 결과 Fig. 6과 같이 통제그룹(CON: n =10), Scopolamine 투여 통제그룹(SCO-CON: n =10), Scopolamine 투여+저강도 트레드밀 운동그룹(SCO-LEX: n =10), Scopolamine 투여+고강도 트레드밀 운동그룹(SCO-HEX: n =10) 간 유의한 차이가 나타났으며( p< .05) 사후검증 결과, ApoEε4 발현은 트레드밀 운동집단이 Scopolamine 투여 통제 집단보다 유의하게 감소하였다( p< .05) ( Fig. 6).
논 의
기억력 감퇴 및 인지기능의 저하는 신경퇴행성 질환을 앓고 있는 환자에게서 흔히 발생할 수 있는 증상으로 중추 cholinergic system은 무스카린 및 니코틴 수용체를 통해 학습과 기억력에 밀접한 관련이 있고, AchE 활성증가에 따른 Ach 감소 및 독성 Aβ, ApoE ε4발현 증가는 AD와 같은 신경퇴행성 질환을 가속화 시킬 수 있다. 본 연구는 후속연구로써 규칙적인 강도별 트레드밀 운동 후, 8주간 detraining이 scopolamine으로 유도된 기억력 장애 쥐 뇌 조직에서 Ach, AchE, β-amyloid, ApoE ε4 발현 및 인지기능에 미치는 영향을 관찰함으로써 운동의 트레이닝 지속효과에 대해 규명하고자 하였다. Scopolamine은 비선택적 무스카린 수용체의 길항제로 중추 콜린성 신경 활성을 억제시킬 뿐 아니라, 노화 동안 발생되는 퇴행성 신경, 신경정신병 병리 및 외상성(traumatic) 뇌손상을 가정한 기억장애의 약리학적 모델에 자주 사용되고 있다[ 26- 28]. 규칙적인 운동이 AD와 관련된 인자들에 긍정적 개선 효과가 있음이 밝혀지고 있는데, 이와 관련한 선행 연구에서, scopolamine의 주입은 해마 CA1 영역의 AChE 발현을 증가시켜 ACh의 분해를 가속화 시킬 수 있고, 이에 대한 방어적 형태로써 트레드밀 운동은 scopolamine에 의해 유도된 AChE 발현을 억제시킬 수 있는 것으로 보고되었다[ 29]. Wang et al. [ 30]은 C57bl/6 mice를 대상으로 한 연구에서 12일 동안의 자발적 달리기 운동이 Aβ25-35로 발생된 기억 손실을 감소시키는 것으로 보고하였으며 이와 유사한 연구결과로써, 우리의 이전 연구에서도 8주간의 저강도 및 고강도의 트레드밀 운동이 기억력 장애 흰쥐의 대뇌피질과 해마에서 Ach, AchE, β-Amyloid, ApoE ε4 및 Morris water maze test의 수행에 긍정적 변화를 확인할 수 있었다[ 31]. 이를 통해 규칙적인 운동이 단기 및 공간 학습 및 인지기능과 같은 뇌 기능을 개선시키고, 신경발생 및 신경영양인자의 발현에 긍정적 영향을 미칠 수 있음을 유추해 볼 수 있다. 반면, 기억력과 관련된 운동의 긍정적 효과와 달리 운동 중지 후 이전의 운동 효과가 어느 정도 지속되는지에 대한 연구는 제한적이며 잘 알려지지 않았다. 본 연구에서 8주 동안 트레드밀 운동 후 동일한 기간에 따른 운동 중지 효과에 대해 분석한 결과, 해마의 ACh 농도 차이는 운동 강도와는 독립적으로 운동집단(SCO-LEX, SCO-HEX)이 scopolamine 투여 집단(SCO-CON)보다 유의한 차이를 보이며 높게 나타났으며, ACh 농도에 직접적 영향을 미치는 AChE 활성을 살펴본 결과, 운동 강도별 유의한 차이는 나타나지 않았으나, 운동집단이 scopolamine 투여 집단에 비하여 유의한 차이를 보이며 낮은 활성을 나타내었다. 또한, 인지기능과 기억력에 중추 역할을 하는 해마의 Aβ 및 ApoE ε4의 발현에 대한 결과, 도피잠재기는 모든 집단 간 유의한 차이가 나타났으며 운동집단이 scopolamine 투여 집단에 비하여 유의한 차이를 보이며 감소하였고, Aβ 및 ApoE ε4 발현에서도 두 요인 모두 운동집단이 scopolamine 투여 집단과 비교하여 유의한 차이를 보이며 감소됨을 확인할 수 있었다. 우리의 결과는 규칙적인 운동의 효과에 대해 보고한 이전의 결과와는 직접적인 비교는 어려우나, 8주 간의 운동 중지에도 불구하고 ACh, AChE 활성 및 Aβ, ApoE ε4 발현이 통제집단과 비교하여 비교적 긍정적 지속효과를 확인할 수 있었고, 이는 일반적으로 저항성 운동을 통한 근비대 현상이 운동 중지와 동시에 이전의 상태로 급격히 돌아가지 않는 것과 유사한 것으로 판단된다. 아직까지 AD rat 모델을 대상으로 운동중지가 콜린성 신경계와 해마 Aβ 및 ApoE ε4 발현에 미치는 영향은 보고되지 않고 있어 이에 대한 다각적인 논의는 제한될 수 있으나, 우리의 결과는 운동이 장기증강(long-term potentiation, LTP) 강화와 BDNF mRNA 발현의 상위조절에 의해 AD 모델 APP/PS1 transgenic mouse의 학습과 기억능력을 개선시킬 수 있음을 보고한 연구[ 32]와, 운동이 뇌 기능과 신경계에 긍정적 영향을 가져올 수 있으며 특히, 기억의 주요 영역인 해마에서 운동의 효과는 Wnt 신호전달체계와 관련되고, 시냅스 가소성과 장기증강(long-term potentiation, LTP)을 개선시킬 수 있다고[ 33, 34] 보고한 선행 연구 결과와 밀접한 관련이 있는 것으로 생각된다. 또한, Kim et al. [ 35]은 STZ로 유도된 당뇨 쥐에서 12주간의 트레드밀 운동은 AD와 관련된 기억손실을 완화시키는 연구결과를 보고하였는데, 이는 AD와 같은 신경퇴행성 질환에서 Wnt 신호전달체계 활성을 통한 신경생성의 증가와 관련이 있음을 제안하였다. 이러한 관점에서 지속적인 운동은 운동 중지 기간에 상관없이 Wnt 신호전달체계의 활성과 LTP 강화에 긍정적 영향을 미칠 수 있으며 이는 Aβ 독성에 대비한 신경보호 역할[ 36]을 하고, 해마의 기억력과 인지기능 개선에 기여할 수 있을 것으로 생각된다. 이와 같이 과거 운동 경험은 detraining 기간에도 불구하고 긍정적 효과가 보존되었지만, 본 연구에서는 기억력 감퇴 개선과 관련된 적정한 운동 강도를 명확히 제시하지는 못하였다. 이는 아마도 detraining 기간 동안 실험동물의 활동성 또는 환경적 요인 등과 같은 외적 요인이 작용한 것으로 판단된다. 또한, 아직까지 detraining과 관련된 선행 연구가 다소 제한적임으로 이를 뒷받침할 과학적 근거를 제시하지 못하는 것은 본 연구가 지니는 제한점이라 할 수 있다. 따라서 추후 이와 관련된 다양한 접근을 통한 연구가 꾸준히 실시되어야 할 것으로 생각된다.
결 론
이상의 결과를 종합해 볼 때, 이전의 규칙적인 운동 실천에 따른 운동 경험 및 효과는 detraining 영향에도 불구하고 기억력 감퇴와 관련된 인자들의 변화에 있어 여전히 긍정적 효과를 가져올 수 있는 것으로 생각된다.
Fig. 1.
Fig. 1.

Fig. 2.
Fig. 2.Comparison of Ach concentration on detraining in scopolamine-induced memory impairment rats. a,b,cDifferent: letters in the same column represent significantly different among the groups at p<.05. 
Fig. 3.
Fig. 3.Comparison of AchE activity on detraining in scopolamine-induced memory impairment rats. a,b,cDifferent letters in the same column represent significantly different among the groups at p<.05. 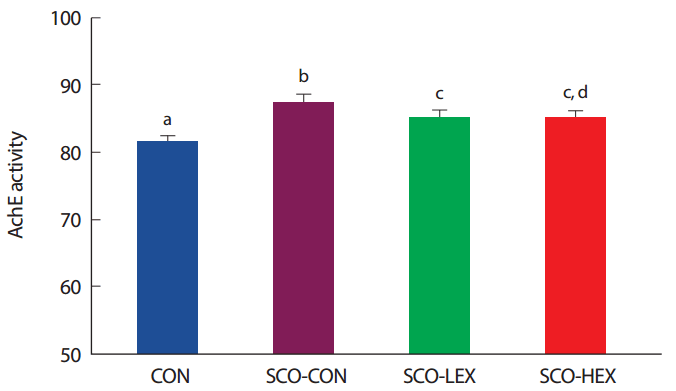
Fig. 4.
Fig. 4.Comparison of escape latency on detraining in scopolamine-induced memory impairment rats. a,b,cDifferent letters in the same column represent significantly different among the groups at p<.05. 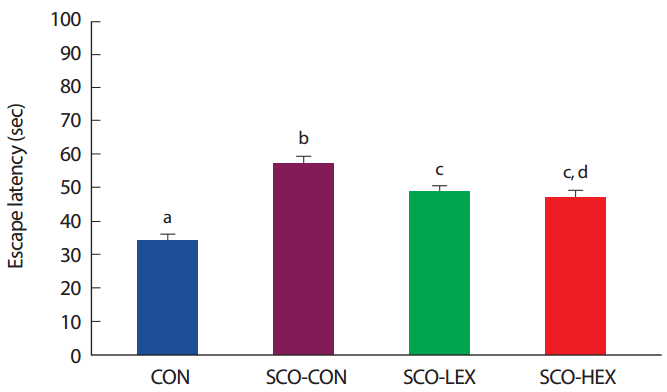
Fig. 5.
Fig. 5.Comparison of β-amyloid expression on detraining in scopolamine-induced memory impairment rats. a,b,cDifferent letters in the same column represent significantly different among the groups at p<.05. 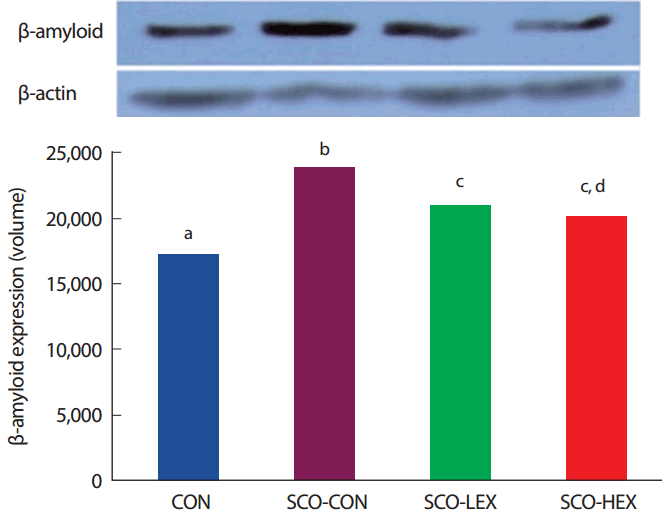
Fig. 6.
Fig. 6.Comparison of ApoE ε4 expression on detraining in scopolamine-induced memory impairment rats. a,b,cDifferent letters in the same column represent significantly different among the groups at p<.05. 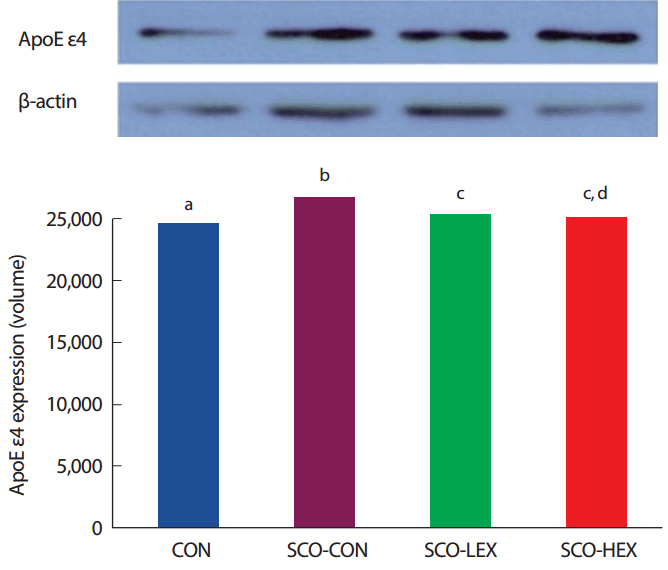
Table 1.
|
Group |
n |
Duration (weeks/division) |
Frequency (day/weeks) |
Intensity
|
Exercise time (min) |
Detraining |
|
Speed (m/min) |
Grade (%) |
|
CON |
10 |
8 |
|
× |
× |
× |
× |
8 weeks |
|
SCO-CON |
10 |
8 |
|
× |
× |
× |
× |
|
|
SCO-LEX |
10 |
8 |
1-4 |
5 |
10 m/min |
0 |
30 |
|
|
|
|
5-8 |
|
12 m/min |
|
|
|
|
SCO-HEX |
10 |
8 |
1-4 |
5 |
15 m/min |
0 |
30 |
|
|
|
|
5-8 |
|
16 m/min |
|
|
|
REFERENCES
1. Wimo A, Jönsson L, Bond J, Prince M, Winblad B. The worldwide economic impact of dementia 2010. Alzheimers & Dementia. 2013;9(1):1-11.  2. Kay C, Harper DN, Hunt M. Differential effects of MDMA and scopolamine on working versus reference memory in the radial arm maze task. Neurobiology Learning and Memory. 2010;93(2):151-156.  3. Chauhan V, Chauhan A. Oxidative stress in Alzheimer’s disease. Pathophysiology. 2006;13(3):195-208.   5. Silman I, Sussman JL. Acetylcholinesterase: ‘classical’ and ‘non-classical’ functions and pharmacology. Current Opinion in Pharmacology. 2005;5(3):293-302.   6. Blennow K, de Leon MJ, Zetterberg H. Alzheimer’s disease. Lancet. 2006;368(9533):387-403.   7. Gotz J, Lim YA, Ke YD, Eckert A, Ittner LM. Dissecting toxicity of tau and beta-amyloid. Neurodegenerative Diseases. 2010;7(1-3):10-12.   8. Ittner LM, Götz J. Amyloid-β and tau--a toxic pas de deux in Alzheimer’s disease. Nature Reviews Neuroscience. 2011;Amyloid-β and tau--a toxic pas de deux in Alzheimer’s. 12(2):65-72.  9. Kang J, Lemaire HG, Unterbeck A, Salbaum JM, Masters CL, et al. The precursor of Alzheimer’s disease amyloid A4 protein resembles a cell-surface receptor. Nature. 1987;325(6106):733-736.   10. Motter R, Vigo-Pelfrey C, Kholodenko D, Barbour R, Johnson-Wood K, et al. Reduction of beta-amyloid peptide42 in the cerebrospinal fluid of patients with Alzheimer’s disease. Annals of Neurology. 1995;38(4):643-648.   11. Williams JW, Plassman BL, Burke J, Benjamin S. Preventing Alzheimer’s disease and cognitive decline. Evidence Report/Technology Assessment. 2010;(193):1-727.
12. Meng X, D’Arcy C. Apolipoprotein E gene, environmental risk factors, and their interactions in dementia among seniors. International Journal of Geriatric Psychiatry. 2013;28(10):1005-1014.   13. Zhang J, Zhang L, Sun X, Yang Y, Kong L, et al. Acetylcholinesterase Inhibitors for Alzheimer’s disease treatment ameliorate acetaminophen-induced liver injury in mice via central cholinergic system regulation. The Journal of Pharmacology and Experimental Therapeutics. 2016;359(2):374-382.   14. Maliszewska-Cyna E, Lynch M, Oore JJ, Nagy PM, Aubert I, et al. The Benefits of Exercise and Metabolic Interventions for the Prevention and Early Treatment of Alzheimer’s Disease. Current Alzheimer Research. 2016;[Epub ahead of print].
16. Shin MS, Ko IG, Kim SE, Kim BK, Kim TS, et al. Treadmill exercise ameliorates symptoms of methimazole-induced hypothyroidism through enhancing neurogenesis and suppressing apoptosis in the hippocampus of rat pups. International Journal of Developmental Neuroscience. 2013;31(3):214-223.   17. Miura S, Kai Y, Kamei Y, Bruce CR, Kubota N, et al. Alpha2-AMPK activity is not essential for an increase in fatty acid oxidation during low-intensity exercise. American Journal of Physiology Endocrinology and Metabolism. 2009;Amyloid-β and tau--a toxic pas de deux in Alzheimer’s. 296(1):47-55.  18. Schefer V, Talan MI. Oxygen consumption in adult and AGED C57BL/6J mice during acute treadmill exercise of different intensity. Experimental Gerontology. 1996;31(3):387-392.   19. Kim DH, Kim DY, Kim YC, Jung JW, Lee SJ, et al. Nodakenin, a coumarin coumpound, ameliorates scopolamine-induced memory disruption in mice. Life Sciences. 2007;80(21):1944-1950.   20. Cassilhas RC, Lee KS, Fernandes J, Oliveira MG, Tufik S, et al. Spatial memory is improved by aerobic and resistance exercise through divergent molecular mechanisms. Neuroscience. 2009;202:309-317.  21. Morris RG, Garrud P, Rawlins JN, O’Keefe J. Place navigation impaired in rats with hippocampal lesions. Nature. 1983;297(5868):681-683.  22. Mathis DM, Furman JL, Norris CM. Preparation of acute hippocampal slices from rats and transgenic mice for the study of synaptic alterations during aging and amyloid pathology. Journal of Visualized Experiments. 2011;(49):pii:2330.  23. Lee MR, Sun BS, Gu LJ, Wang CY, Mo EK, et al. Effects of white ginseng and red ginseng extract on learning performance and acetylcholinesterase activity inhibition. Journal of Ginseng Researvh. 2008;32(4):341-346.  24. Galgani F, Bocquene G, Cadiou Y. Evidence of variation in cholinesterase activity in fish along a pollution gradient in the north sea. Marine Ecology progress Series. 1992;19:1-6.  25. Hallak M, Giacobini E. A comparison of the effects of two inhibitors on brain cholinesterase. Neuropharmacology. 1987;26(6):521-530.   26. Blokland A. Scopolamine-induced deficits in cognitive performance: a review of animal studies. Scopolamine Reviews. 2005;1-76.
27. Klinkenberg I, Blokland A. The validity of scopolamine as a pharmacological model for cognitive impairment: a review of animal behavioral studies. Neurosci Biobehavioral Reviews. 2010;34(8):1307-1350.  28. Tota S, Hanif K, Kamat PK, Najmi AK, Nath C. Role of central angiotensin receptors in scopolamine-induced impairment in memory, cerebral blood flow, and cholinergic function. Psychopharmacology (Berl). 2012;222(2):185-202.   30. Wang Q, Xu Z, Tang J, Sun J, Gao J, et al. Voluntary exercise counteracts Aβ25-35-induced memory impairment in mice. Behavioural Brain Research. 2013;256:618-625.   31. Hyun KS, Park SH, Yoon JH. Effects of treadmill exercise on ACh, AChE, β-amyloid, apolipoprotein expression and cognitive function in brain of memory impairment rat. The Korea Society of Living Environmental System. 2016;23(3):422-432.  32. Liu HL, Zhao G, Cai K, Zhao HH, Shi LD. Treadmill exercise prevents decline in spatial learning and memory in APP/PS1 transgenic mice through improvement of hippocampal long-term potentiation. Behavioural Brain Research. 2011;218(2):308-314.   33. Bayod S, Mennella I, Sanchez-Roige S, Lalanza JF, Escorihuela RM, et al. Wnt pathway regulation by long-term moderate exercise in rat hippocampus. Brain Research. 2014;1543:38-48.   34. Radahmadi M, Hosseini N, Alaei H. Effect of Exercise, Exercise Withdrawal, and Continued Regular Exercise on Excitability and Long-term Potentiation in the Dentate Gyrus of Hippocampus. Brain Research. 2016;1653:8-13.   36. Inestrosa NC, Varela-Nallar L. Wnt signaling in the nervous system and in Alzheimer’s disease. Journal of Molecular Cell Biology. 2014;6(1):64-74.  
|
|











