서 론
골격근의 위축(atrophy)은 나이에 따른 노화, 골다공증, 장기적 요독증, 근육의 탈신경 그리고 당뇨병과 같은 대사 질환으로 인해 발생되는 현상이며, 이로 인한 근재생 능력의 감소와 apoptosis의 증가에 의한 결과이다[1]. 특히, sarcopenia는 노화에 따른 골격근 위축(atrophy)이며, 이것은 신체장애, 질병률 그리고 사망률과 관련이 있다[2]. 이러한 sarcopenia의 병리, 생리학적인 상태는 만성 질환, 염증, 대사, 영양 그리고 호르몬 인자 등과 같은 많은 요인들의 복합적인 상호작용과 관련이 있다[3]. 하지만, 지속적인 운동 훈련은 노화로 발생되는 체내 항상성 저하 및 골격근 세포 손상의 회복을 위한 항상성 유지 및 근재생과 관련된 신체의 방어체계를 구축하고 추가적인 손상을 예방하기 위한 다양한 변화를 일으킨다[4]. 특히, 형태 및 강도에 따른 운동 훈련은 염증의 감소, 근육량과 골 형성의 개선과 유지, 노화와 관련된 질병의 예방을 통해 근육 감소증과 골다공증을 예방하는 데 중요한 역할을 한다[5-7]. 노화로 인한 근위축은 저항 및 유산소 운동을 통해 근육 비대, 기능 회복 및 골 질량 보존에 도움이 된다는 것을 제시하고 있다[8,9]. 이 운동들 중에서 신장성 수축(Eccentric contraction) 운동은 다른 형태의 근육 수축보다 내리막 운동 중에 더 많은 근육 손상을 일으킨다[9]. 최근 과도한 내리막 달리기(excessive downhill running)는 각기 다른 섬유 형태에서 골격근 비대를 억제시킨다고 보고하고 있다[10]. 반대로, 신체나이에 맞는 적당한 강도의 신장성 수축 운동은 중년 후기의 약화된 골격근에서 고강도 운동에 따른 손상 및 합병증 없이 골격근 보호 및 회복과 같은 긍정적인 생리학적 효과를 얻는 데 더 유익할 수 있음을 제시하고 있다[9,11]. 그러나, 최근까지 노화된 근육에서 내리막 달리기와 같은 운동형태가 근육 적응 및 형성에 미치는 영향은 아직 완전히 이해되지 않고 있다.
최근 연구에서 노화와 운동이 관련된 골격근 재생 및 조절, 그리고 진행과정에 중요한 역할을 하는 기전으로 Wnt signaling이 보고되고 있다[4,12]. 특히, 골격근의 비대(Hypertrophy)와 증식(Hyperplasia)에 긍정적인 영향을 미치고 있음을 제시하고 있다[12-14]. 흥미롭게도, 젊은 쥐보다 노화된 쥐의 근섬유 및 결합조직의 형성과 발달에 Wnt-1, 3a, 10a proteins를 포함하는 Canonical Wnt/β-catenin signaling 요인이 중요한 역할을 하며, 이것은 satellite cells의 분화를 일으켜 새로운 근섬유의 생성(Hyperplasia)을 유도하는 것으로 보고하고 있다[15,16]. 또한, Wnt-4, 5a, 7a, 11 등은 β-catenin의 level을 높이지 않고 protein kinase C (PKC)나 calmodulin-dependent protein kinase II (CaMKII) 등을 활성화시키는 칼슘 의존형 경로인 non-canonical Wnt pathway의 경우 세포의 부착 및 형태학적인 변화(Hypertrophy)를 조절하는 것으로 알려져 있다[17,18]. 지금까지 Wnt signaling pathway는 유전학적, 생화학적인 방법을 통하여 많은 연구가 canonical pathway의 규명에 집중이 되어 왔지만, 최근에는 “non-canonical pathway”의 생물학적 중요성이 인식되면서 이 분야의 연구가 점차 활성화되는 추세이다.
따라서 노화된 근조직에 영향을 줄 수 있는 운동형태 및 강도가 canonical & non-canonical pathway를 통해 골격근 세포 내 성장 및 산화적 스트레스에 의한 손상된 세포의 세포자멸 유도에 어떠한 영향을 끼치며, 그 작용기전에 대한 명확한 연구가 필요하다. 또한, Wnt signaling과 더불어 bone morphogenetic proteins (BMPs)는 골 형성 시 지속적인 항상성 유지와 골격의 성장을 위해 필수적인 요인이며, Smad1/5/8의 인산화와 mammalian target of rapamycin (mTOR) 활성은 BMPs 유발 근육 비대를 촉진시키고 근육 위축 예방을 보고하고 있다[19-21]. BMP-2는 pAkt를 통해 glycogen synthase kinase 3β (GSK3β)를 불활성화시켜 β-catenin의 일시적인 축적과 전사를 활성화시키는 것으로 나타났다[22].
Wnt/BMP signaling에 관련된 생화학적, 유전학적인 연구는 현재까지도 지속적으로 연구되고 있다. 하지만 지금까지의 연구는 세포 내분화 및 형성에 대한 실험결과들을 제시하고 있을 뿐 다양한 운동을 통한 근 형성 과정에 대한 연구는 아직까지 미비한 실정이다. 특히, 노화 및 운동과 관련된 분야의 연구는 거의 전무한 실정이다. 또한, 운동에 따른 Wnt/BMP signaling factors의 발현양상에 대한 연구는 일반 젊은 쥐를 대상으로 일회성 운동에 따른 골격근의 손상을 관찰하거나 손상 후 회복기를 살펴보는 정도의 실험으로, 국내외 모두 너무 병리학적인 연구만 되어 있고 운동 트레이닝을 통한 노화된 골격근 내 Wnt/BMP sjgnaling pathway 요인들의 명확한 관련 기전에 대한 연구는 아직까지 전무한 실정이다. 따라서 노화된 근조직에 영향을 줄 수 있는 운동 강도 및 형태에 따른 Wnt/BMP sjgnaling pathways의 mechanism이 골격근 세포 성장 및 산화적 스트레스에 의한 손상된 노화 세포에 어떠한 영향을 끼치며, 그 작용기전에 대한 이론적 근거를 제시할 수 있는 연구가 필요하다.
연구 방법
2. 실험설계 및 분석방법
1) 운동 프로그램
SD계 노화 및 젊은 쥐는 실험을 하기 전 대조군(young control, YC; old control, OC) 및 지구성 운동집단(old downhill exercise, ODE; old uphill exercise, OUE)으로 분리하였다. 운동 집단은 1주일 전 0°의 경사도에서 5-10 m/min의 속도로 10-15분 동안 설치류용 Treadmill (Omnipacer LC-4, Omnitech, Columbia)에서 사전운동을 실시하였다. 이러한 적응기간이 끝난 후 운동집단은 운동강도 16 m/min 및 21 m/min, 경사도 -16° 및 +10°에서 downhill과 uphill exercise training을 60분 동안, 주 5일, 8주간 treadmill 운동을 실시하였다[9,25]. 오르막 운동(uphill exercise) 훈련은 21 m/min의 최대 속도와 +10°의 경사도까지 Treadmill에서 점진적으로 실시되었으며, 내리막 운동(downhill exercise) 훈련은 16 m/min의 최대 속도와 -16°의 경사도까지 진행되었다. 점진적 운동강도는 60분/일, 주당 5일, 8주 동안 달리기 그룹은 속도 및 경사를 점차적으로 증가시켰다. 오르막 훈련에서 2주 간격으로 10, 13, 17, 21 m/min으로, 내리막 훈련은 7, 10, 13, 16 m/min의 속도로 증가시켰으며, 경사면은 오르막 훈련에서 +2°, +5°, +8°, +10°로, 내리막 훈련은 -5°, -8°, -12°, -16°로 증가시켰다. 그리고 60분/일 동안 운동 시작 10-15분 이내에 목표 강도에 점차적으로 도달하여 진행하였으며, 마지막 10-15분 이내에 속도와 경사도를 서서히 줄였다. 또한, Treadmill 운동 동안 전기적 충격은 사용하지 않았으며, 자체 제작한 소음발생기를 이용하였다.
2) Treadmill 운동 후 근육 샘플 채취
각각 8주 마지막 60분 운동 후 회복기 48시간이 지난 즉시 샘플을 적출하였다. 각 시기별로 운동이 종료된 후 모든 실험동물은 경추탈골을 실시하고 가자미근(soleus, SOL), 장지신근(extensor digitorum longus, EDL)을 적출하며, 면역조직화학법(immunohistochemistry) 및 hematoxylin and eosin (H & E) 염색 방법을 이용할 샘플은 포르말린 용액에 즉시 넣어 보관하고, 나머지 분석을 할 골격근은 튜브에 담아 분석 시까지 -80℃에 보관하였다.
3) Protein 추출 및 Western blotting 분석
Protein을 추출하기 위해 lysis buffer(Roche. manheim, Germany)에 protease inhibitor (Roche. manheim, Germany)가 함유된 용액을 첨가하여, 균질화기기로 분쇄한 다음 14,000 rpm에서 30분 동안 원심분리하였다. 원심 분리된 용액 중 상층액만을 분리한 후 상층액의 2 μL를 protein assay 용액(Bio-Rad, CA, USA) 1 mL에 첨가한 다음 spectrophotometer (Eppendorf, CA, USA)를 이용하여 560 nm의 흡광도에서 단백질량을 정량한다. 정량화된 단백질에서 각 샘플 당 동일한 단백질량(20 μg)을 SDS-gel loading 용액에 총 20 μL가 되도록 혼합한 다음 100℃에서 10분간 변성시킨다. 변성된 단백질(20 μL)을 스탠다드 단백질 마커(SDS-PAGE molecular weight maker, Bio-rad, CA, USA)와 함께 Mini-Protein II dual-lab apparatus (Bio-Rad, CA, USA)에 의해 만들어진 10% SDS-polyacrylamide gels에 각 샘플을 주입한 다음 100 V에서 2시간 동안 단백질이 바닥에 닿을 때까지 전기 영동한다. 전기 영동된 단백질을 PVDF membrane (Amersham, CA, USA)에 전이하기 위해 Mini trans-module (Bio-Rad, CA, USA)을 이용하여 transfer 용액 (190 mM glycine, 50 mM Tris-base, 20% methanol, .05% SDS) 속에 단백질이 전기 영동된 젤과 PVDF membrane (millipore) 및 3M paper를 차례로 겹치도록 한 다음 200 V에서 4시간 동안 전이한다. 단백질이 전이된 membrane은 phosphate-buffered saline (PBS) (Nacl 8 g, KCl 0.2 g, Na2HPO4 1.44 g, KH2PO4 0.24 g, pH 7.4)에 5% skim milk가 첨가된 용액에서 1시간 동안 rocker platform (Fine PCR, Korea)에서 blocking한다. 그 다음 membrane는 PBS에 0.1% tween-20이 함유된 용액 (PBST)에서 10분간 3번 세척되며, 세척된 membrane은 일차 항체인 Anti-Wnt7a, Wnt3a, Fzd7, PKC, BMP-2, -7 (Bioworld Technology, Louis Park, MN, USA), p-Smad-1/5/8 (Ser 463/Ser 465) (Santa Cruz Biotechnology, Santa Cruz, CA, USA), LEF-1, β-Catenin, GSK3β, p-mTOR (Ser2448) (Cell Signaling Technology, Beverly, MA, USA), p-AKT, MyoD, Myf5, Myogenin (Santacruz biotechnology, Santacruz, USA)이 첨가된 용액에서 2시간 동안 반응된 후 PBST 용액에서 1×15 minutes와 2×5 minutes 동안 세척한다. 일차 항체에서 반응된 membrane은 secondary antibody인 actin (Sigma-Aldrich, St. Louis, MO, USA)이 첨가된 용액에서 2시간 동안 반응된 다음 PBST용액에서 1×15 minutes와 2×5 minutes 동안 세척된다. 세척된 membranes은 ECL detection reagent (Amersham, CA, USA) 용액 (1 mL)에 1분간 노출된 후 imaging system인 Bio-Rad chemidoc XRS (Bio-rad, CA, USA)를 통해 immuno reactive bands의 상대적 강도가 정량화된다.
4) H & E 염색법
각각의 골격근 조직은 운동처치가 종료된 후 48시간 이후 적출하여 48시간 동안 10% formalin에 고정되고, Tissue embedding 장치(histochem 3, Leica, Germany)를 이용하여 paraffin 절편을 탈파라핀화시킨 후, rotary microtome (HM340E, Leica, Germany)를 이용하여, 5 μm 단위로 각각의 근육과 골격에 대한 절편을 제작한다. 젊은 쥐, 노화 쥐 통제군 노화 쥐 운동군의 골격근의 구조적 특징을 구분하기 위하여 조직염색법 중 하나인 H & E 염색을 실시하고 전자 현미경 (Carl Zeiss, Ostalbkreis, Germany) 200배 비율로 관찰한다.
연구결과
1. 체중, 근육량 그리고 골격근 내 조직 형태학적 변화
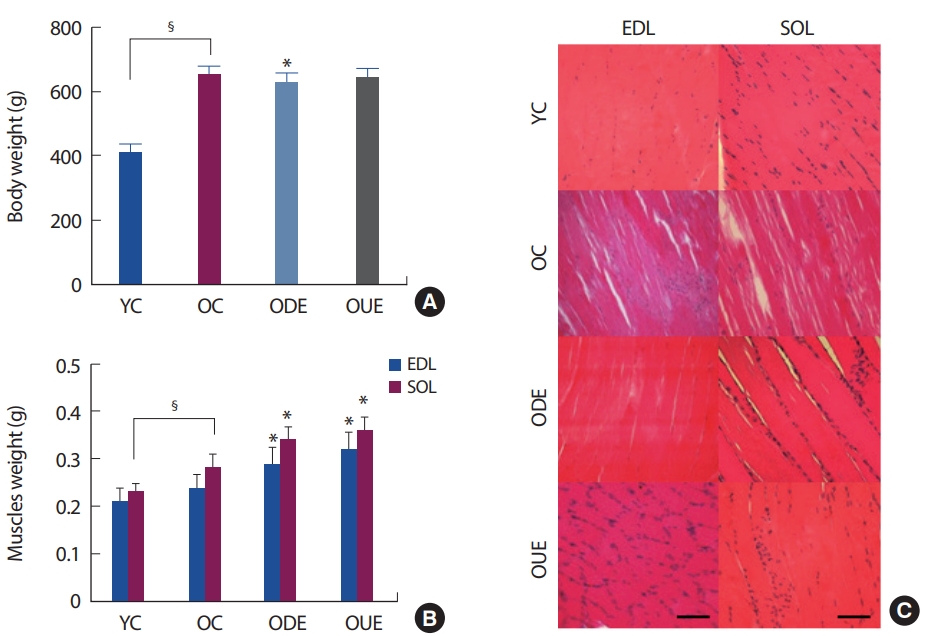
Downhill과 uphill 지구성 운동을 실시한 결과, 전체 몸무게는 YC와 OC 집단, OC와 ODE 집단에서 유의한 변화가 나타났으며(p<.05)(Fig. 1A), 근육의 무게는 YC와 OC 집단, OC 집단에 비해 ODE와 OUE 집단 모두에서 유의하게 증가양상을 나타냈다(p <.05)(Fig. 1B). 특히, ODE 집단보다 OUE 집단에서 더욱 증가를 나타내고 있다(Fig. 1B). 또한, 노화쥐의 골격근의 구조적 형태는 다발성 근육염과 같은 근육의 염증과 변성을 특징으로 가지고 있다. 하지만, 내리막과 오르막 달리기 운동 훈련을 실시한 결과, 노화 쥐의 EDL과 SOL 골격근의 조직 형태가 두 가지 형태의 운동을 통해 매우 긍정적인 구조적 변화가 나타났다(Fig. 1C).
3. Wnt pathway 관련 proteins의 발현 변화
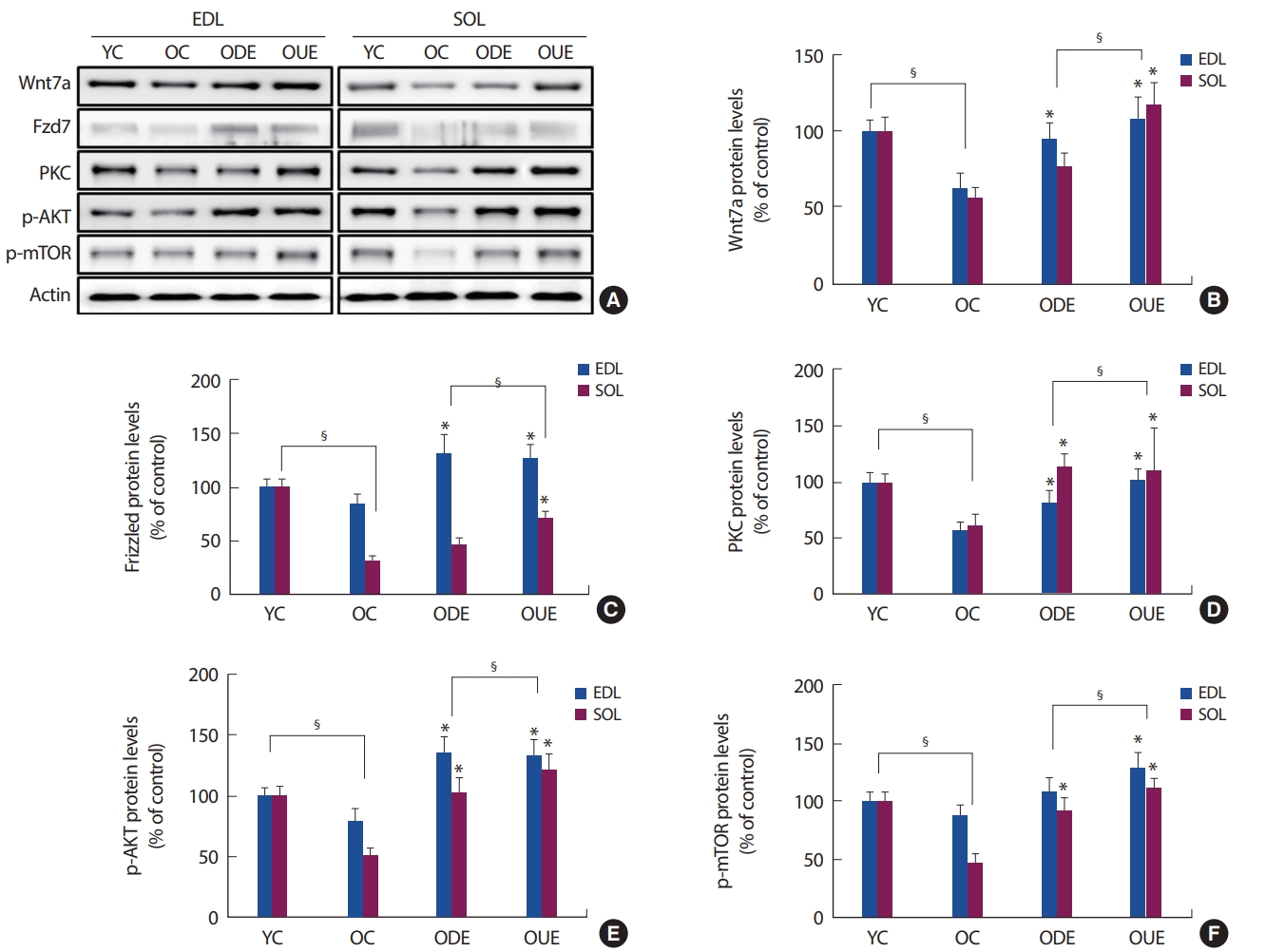
Downhill과 uphill 지구성 운동을 실시한 결과, EDL과 SOL 근육 내 Wnt7a, Frizzled 7 (Fzd7), PKC, p-AKT 그리고 p-mTOR의 발현은 YC와 OC 집단, OC 집단에 비해 ODE와 OUE 집단 모두에서 유의하게 증가된 양상을 나타냈다(p<.05)(Fig. 3). 특히, OUE 집단에서는 non-canonical Wnt pathway와 관련된 proteins의 발현양상이 ODE 집단에 비해 높게 나타났다(Fig. 3). 따라서 ODE 훈련 또한 노화쥐의 근육 약화에 대한 Wnt pathway의 보호 효과에 의해 골격근 형성을 개선시킨 것으로 사료된다.
논 의
격렬한 운동은 노화된 신체에 해를 입히며 무리한 운동으로 인해 발생하는 활성산소의 증가, 열, pH의 변화 등의 스트레스는 골격근을 산화시키고 운동을 지속할 수 없게 만들거나 근육통, 근육파열 등의 심각한 문제를 일어나게 된다. 이때 손상 후 회복을 위한 신체의 항상성 유지 및 추가적인 손상을 예방하기 위한 다양한 변화가 일어난다. 특히, 적절한 운동 형태 및 강도에 따른 지속적인 훈련은 염증의 감소, 근육량과 골 형성의 개선과 유지, 노화와 관련된 질병의 예방을 통해 근육 감소증과 골다공증을 예방하는 데 중요한 역할을 한다[5-7].
이 연구에서 우리는 점진적인 내리막(downhill; ODE) 및 오르막(uphill; OUE) 달리기 운동과 같은 두 가지 유형의 훈련이 산화적 스트레스에 의한 손상된 노화 세포에 골격근 세포 성장 및 치료에 Wnt/BMP pathways의 mechanism이 유익한 효과가 있는 것으로 나타났다. 이러한 Wnt와 BMP pathway는 운동과 노화로 인한 산화적 스트레스의 방어기전으로써 골격근 내 재생 및 조절, 그리고 진행과정에 중요한 역할을 하는 대표적 핵심인자로 거론되고 있다[15,16,20,21]. 특히, 내리막 훈련은 노화된 골격근을 보호하여 증가된 산화 스트레스와 항상성 저하에 적절히 대처하고 적응할 수 있게 하는 것으로 나타났다[26,27]. 이 연구에서 주요결과는 노화에 따른 약화된 골격근 회복 및 형성을 제공하기 위한 높은 강도의 오르막 달리기와 비슷한 운동효과의 결과로 내리막 달리기 또한 실용적인 운동 훈련이라는 것이다. 이는 8주간의 운동형태에 따른 달리기 훈련이 노화 쥐의 골격근의 무게와 구조적 조직 형태가 내리막 달리기 운동을 통해 매우 긍정적으로 변화가 향상되었기 때문이다.
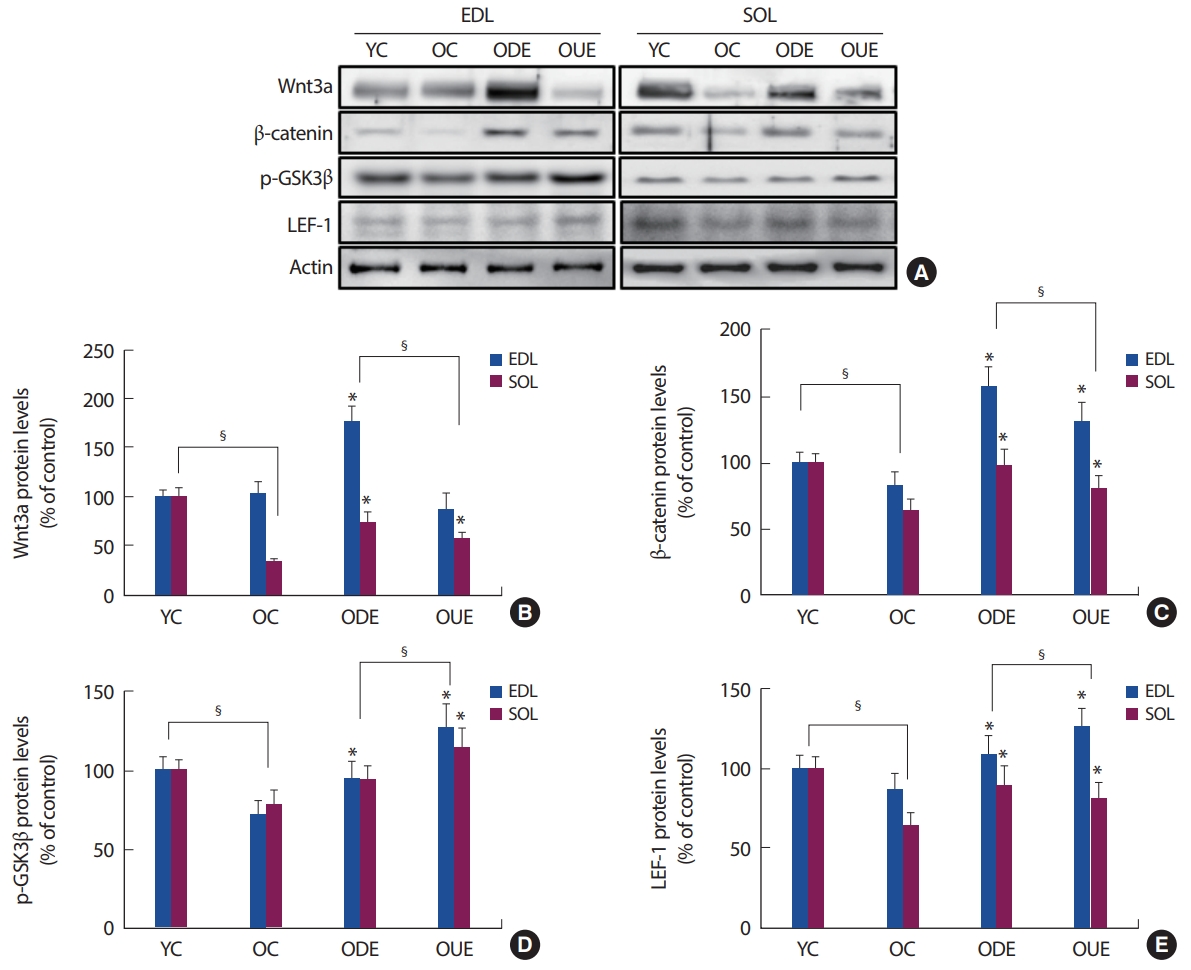
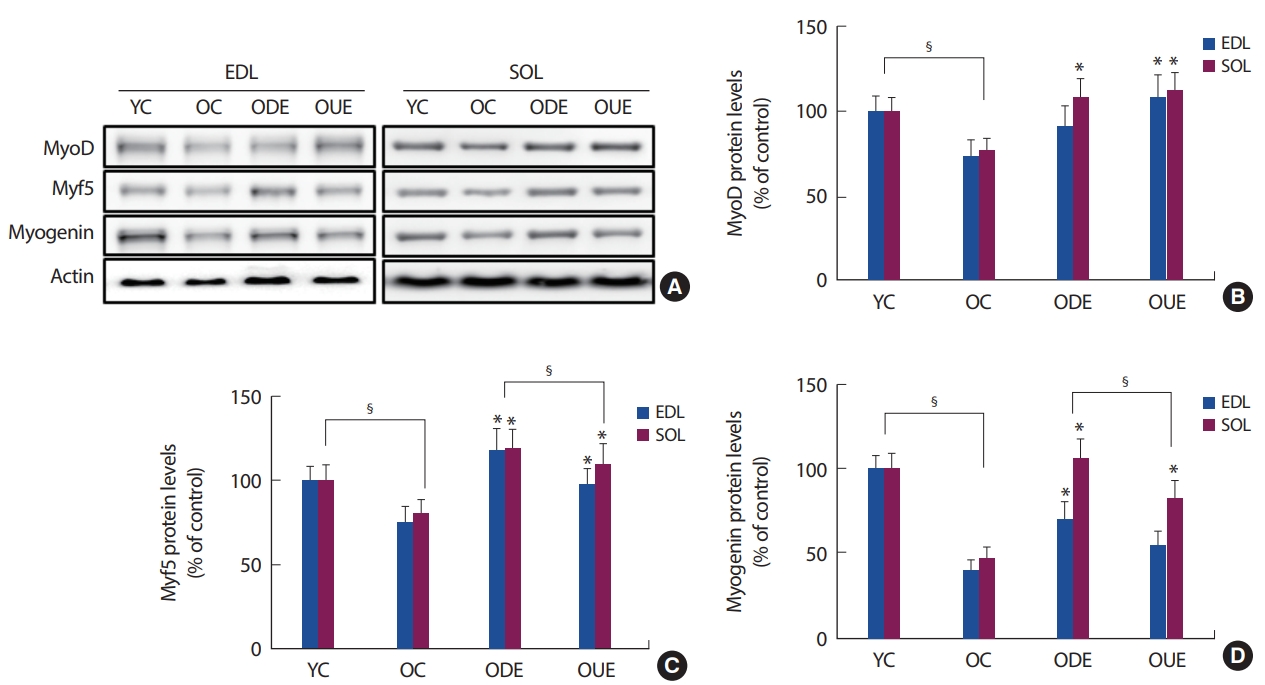
최근 연구에서 노화와 운동이 관련된 골격근 재생 및 조절, 그리고 진행과정에 중요한 역할을 하는 기전으로 Wnt signaling이 보고되고 있다[12,17,28]. 이러한 Wnt signaling은 세포로부터 분비되는 cystein이 많은 당 단백질로써, 주변세포의 receptor에 결합하여 활성화된 receptor를 통해 여러 가지 단계를 거쳐 많은 유전자의 발현과 세포 분화 및 증식을 조절하는 세포신호전달경로로써 배아의 발생과 성체의 항상성 유지와 같은 다양한 생명 현상, 특히, 골격근의 비대(Hypertrophy)와 증식(hyperplasia)에 긍정적인 영향을 미치고 있음을 제시하고 있다[12-14]. 이러한 Wnt 신호는 대표적으로 key effector molecule인 β-catenin을 통하여 전달되는 canonical Wnt pathway가 있으며, 이는 Wnt-1, 3a, 10a 등은 주로 세포의 운명과 증식을 조절(Hyperplasia)하는 것으로 알려져 있다[17,18]. 본 연구결과에서도 EDL과 SOL 근육 내 Wnt3a와 β-catenin의 발현양상은 OC집단에 비해 ODE와 OUE 집단 모두에서 유의하게 증가를 나타냈다. 특히, 내리막 달리기 운동 형태(ODE)가 EDL과 SOL 근육 내의 발현양상이 오르막 달리기(OUE)보다 긍정적인 발현증가를 나타냈다(Fig. 2). 이러한 β-catenin은 분해되지 않고 세포 내에 축적되어 안정화된 β-catenin은 GSK3β에 의해 비인산화되어 핵 내부로 들어가서 transcription factor인 LEF와 결합하여 MyoD, myogenic factor 5 (Myf5) 그리고 Myogenin과 같은 MRFs의 발현 증가로 세포의 성장과 증식에 관여하는 목표 유전자의 전사를 유도하게 된다[12,16,29]. 본 연구결과에서도 GSK3β는 OC 집단에 비해 ODE와 OUE 집단 모두에서 감소를 나타냈다. 반면에 LEF-1의 발현양상은 운동형태와 조직특성에 따라 다른 발현 증가가 나타났다(Fig. 2). 여기에서 GSK3는 세포노화와 관련된 대사적 변화의 주조절자로 노화의 진행과 관련된 단백질 발현에 중요한 역할을 수행하고 있을 가능성 또한 제시하고 있다[15,18]. 또한, MyoD, Myf5 그리고 Myogenin의 발현양상이 운동형태에 따라 발현 증가를 나타냈다. 특히, Myf5와 Myogenin의 발현이 내리막 달리기 훈련에서 더욱 증가한 것으로 나타났다(Fig. 5). 이러한 결과들은 8주간 실시된 지구성 운동의 형태 및 움직이는 근육조직의 특성에 따라 canonical Wnt pathway의 활성에 영향을 미친 것으로 생각된다.
또한, non-canonical Wnt pathway의 경우 Wnt-4, 5a, 7a, 11 등이 β-catenin의 level을 높이지 않고 PKC나 CamKII 등을 활성화시키는 칼슘 의존형 경로로서 세포의 부착 및 형태학적인 변화 (Hypertrophy)를 조절하는 것으로 알려져 있다[17,18]. 이 중 근육세포에서 Wnt7a는 phosphatidyl inositol-dependent kinase 1 (PDK1)을 차례로 활성화하고, PI3K의 활성화하는 결과로 Fzd7에 결합을 하게 된다. PDK1은 Akt가 ribosomal protein S6 kinase와 S6의 활성화 및 근비대의 유도로 활성화시킴을 보고하고 있다[28]. 특히, 단백질 합성과정과 관련하여 Akt는 골격근성장에 중요한 핵 내 전사인자인 mTOR을 활성화시키며, Akt-mTOR 신호체계에 의해 골격근 세포의 핵 내 전사요인이나 다른 신호전달계 또는 효소 등 세포질 내 여러 단백질들의 활성을 유발하여 세포의 성장과 증식에 관여함을 보고하고 있다[30]. 따라서 Wnt7a는 Fzd7 receptor complex 구성 요소와 결합하여 골격근 내 Akt/mTOR 성장 경로 활성화로 Wnt7a-Fzd7의 non-canonical anabolic signalling pathway가 근섬유의 크기 증가(hypertrophy)에 효과적인 것으로 보고하고 있다[16]. 본 연구결과에서 EDL과 SOL 근육 내 Wnt7, Fzd7, PKC, p-AKT 그리고 p-mTOR의 발현양상은 OC 집단에 비해 ODE와 OUE 집단 모두에서 유의하게 증가를 나타냈다. 특히, 오르막 달리기 운동 형태가 SOL 근육 내의 발현양상이 내리막 달리기보다 증가양상이 나타났다(Fig. 3). 이러한 결과는 증가된 non-canonical Wnt pathway 관련 proteins이 노화에 따른 세포 항상성 감소와 운동 훈련 형태에 따른 근육량 유지 및 크기를 증가시킬 수 있음을 시사한다. 즉, 오르막 달리기 운동 형태가 골격근 세포의 핵 내 전사인자 및 세포질 내 여러 단백질들의 활성을 유발하여 세포의 성장과 증식에 관여한 것으로 사료된다. 그러므로, Wnt pathway는 운동과 노화로 유도되는 산화 스트레스로부터 보호하기 위해 근육과 운동 형태에 의존적으로 표현됨을 확인할 수 있었다.
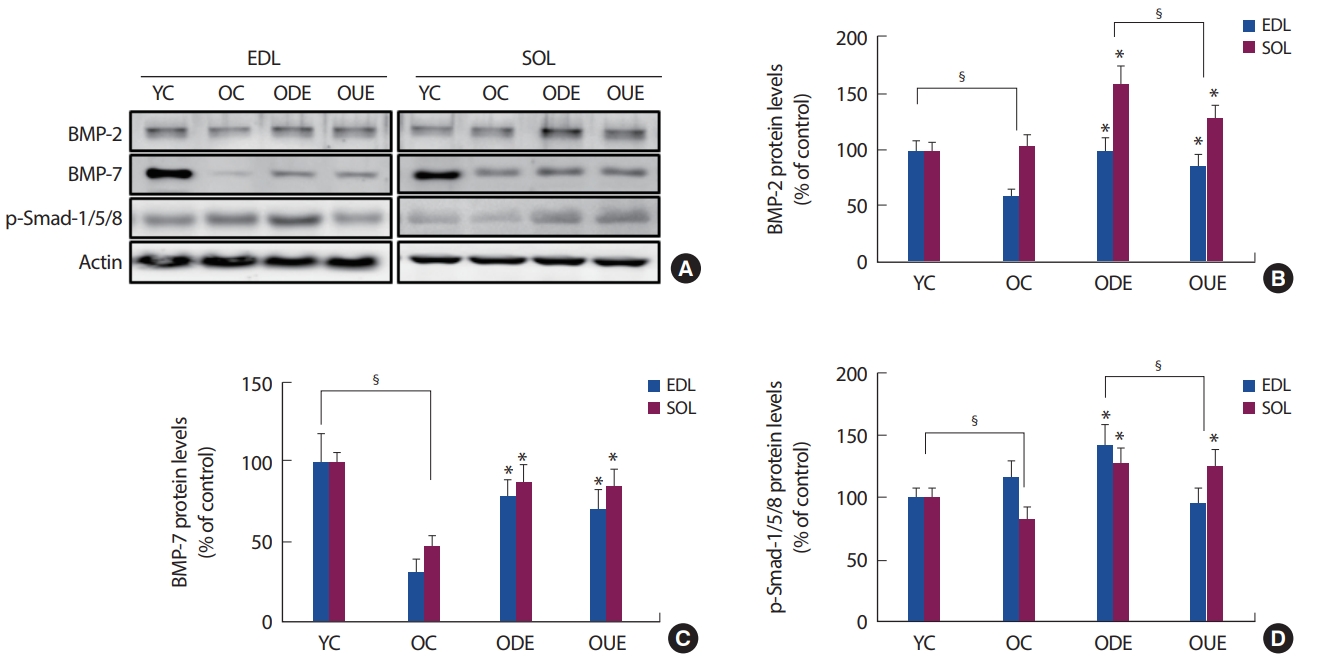
한편, 최근 연구에서 BMP signaling의 활성화가 근육 성장과 비대를 촉진한다고 보고하고 있다[20,31,32]. 이는 BMP-7과 Smad1/5/8 신호 전달 경로가 mTOR 의존성 단백질 합성에 영향을 주어 근육 성장을 촉진하고 근육 소모를 예방한다[20,32]. 또한, Smad1/5/8과 mTOR의 인산화는 BMPs의 유도에 따라 근비대를 촉진시키고 근위축 예방을 제시하고 있다[20,21]. 본 연구에서는 노화된 골격근의 BMP signaling인 BMP-2, -7 그리고 p-Smad-1/5/8이 내리막과 오르막에서 유의하게 증가한다는 것을 발견했다. 특히, EDL과 SOL 근육 내의 발현양상이 내리막 달리기 운동 형태가 오르막 달리기보다 증가된 것으로 나타났다(Fig. 4). 이러한 결과는 점진적인 내리막 달리기의 컨디셔닝 반응은 오르막 달리기와 같은 고강도 운동과 유사하게 노화로 인해 감소된 근력을 향상을 위해 BMP signaling 및 근육 성장 인자를 촉진함으로써 근육 조직학적 변화의 효과를 가져올 수 있음을 시사한다.
본 연구에서, 점진적인 강도의 증가를 통한 내리막 달리기와 오르막 달리기의 효과는 운동형태에 따라 다른 이점을 가지고 있다. non-canonical Wnt pathway 인자들의 발현은 노화된 골격근에서 오르막 달리기 훈련에 의해 증가되었으며, 또한, canonical Wnt pathway 관련 요인과 BMPs의 발현은 내리막 달리기의 운동 훈련 효과에 의해 증가된 양상을 나타냈다.
결 론
결론적으로, 본 연구는 내리막 및 오르막 달리기 훈련 모두가 노화로 인해 약화된 골격근에서 Wnt/BMP pathway 관련 proteins의 발현을 증가시켜 골격근 성장 인자의 발현을 유도하였다. 특히, 점진적인 내리막 달리기는 고강도 훈련에서 발생할 수 있는 무리한 신체적 손상(damage)을 줄이며 고강도의 오르막 달리기 훈련 효과와 유사한 위축된 골격근 보호 및 회복과 같은 긍정적인 생리학적 효과를 제시하고 있다. 그러므로 신체적 나이를 고려하여 점진적인 내리막과 오르막 달리기 운동 훈련을 병행한다면 노화로 인해 유도되는 골격근 약화의 예방과 개선에 더욱 효과적일 것으로 생각됩니다.