근감소 노년 여성의 신체 기능과 경도 인지 장애 위험 간의 비선형 관계에 관한 연구
Nonlinear Association between Physical Function and Risk of Mild Cognitive Impairment in Older Women with Low Muscle Mass
Article information
Trans Abstract
PURPOSE
This study aimed to determine the nonlinear relationship between physical function and body composition in older women with mild cognitive impairment (MCI) and low muscle mass (LMM). Early prediction of sarcopenic MCI is important; however, it remains unclear whether improvements in physical function and cell health promote low rates of sarcopenic MCI in community settings.
METHODS
A total of 120 older women were enrolled, and subsequently stratified into the LMM group (n=90) and MCI with LMM group (n=30). MCI was evaluated by a clinician based on global cognitive function and clinical findings.
RESULTS
The results of hand grip strength (HGS), short-physical performance battery (SPPB), and 6-minute walk test (6 MWT) were found to be linearly associated with the risk of MCI. This result indicates that endurance capacity in the LMM with MCI group had an adjusted odds ratio of 3.69 (95% CI: 1.11–12.18). The nonlinearity of physical function on the risk of MCI was analyzed using the generalized additive models (GAM).
CONCLUSIONS
Physical function and body composition is significantly associated with LMM and MCI risk in aging adults. It is expected that the evaluation and improvement of kinematic indicators, such as HGS, SPPB, endurance, and PhA, could contribute to the prediction and prevention of MCI.
서 론
근감소증과 인지기능 저하는 연령의 증가로 인해 급속히 이환되는 대표적 노인증후군으로 분류되어 있다[1]. 특히, 근감소증은 근기능과 근육량의 저하를 가져오며, 그로 인한 낙상에 대해 공포심이 증가하게 되고 신체활동을 기피하게 되는 악순환을 반복하게 된다. 근감소증은 30대를 기점으로 연령의 증가에 따라 유병률이 증가하고 있으며, 65세 이상의 고령자에서 빈번히 나타나는 질환 중 하나이다. 인지기능의 저하 또한 연령의 증가와 밀접한 영향이 있으며 그중 경도인지장애(Mild Cognitive Impairment, MCI)는 정상적인 노화와 치매 사이의 중간 단계로 주관적 혹은 객관적 인지 장애는 있으나, 일상생활에는 문제없는 상태로 정의되고 있다[2]. 지역사회에 거주하는 50세 이상 성인의 MCI 유병률의 범위는 19%로 집계되고 있으며[3], 60-76세 고령자를 대상으로 계산되어진 MCI의 유병률은 임상 치매 등급(Clinical Dementia Rating, CDR) 척도의 기준에서 6.5% (52/806), CDR 척도의 기준을 적용하지 않을 경우 54.5% (439/806)로 높은 편에 속한다[4].
근육감소를 동반한 인지 장애는 알츠하이머 및 치매로의 전환에 더욱 쉽게 노출되며, 경미한 근감소증보다 중증 근감소증이 치매로의 진행을 가속시킨다. 운동을 통한 골격근의 수축은 뇌의 시냅스를 조절하는 뇌 유래 신경영양인자(Brain-derived neuro factor, BDNF)의 주요 공급원이며[5,6] 특히, 골격근은 근육의 이화작용을 감소시키고 면역 및 산화 환원 효과를 통해 뇌기능에 영향을 미칠 수 있으며, 연령의 증가에 따른 골격근량의 저하 및 근육감소증은 인지기능을 저하시킬 수 있다[7]. 낮은 골격근량은 고령자의 인지 기능 및 치매와도 관련이 있으며[8], 골격근과 뇌 축 사이의 연결은 운동을 통해 유발되는 Myokines 의 방출에 의해 입증되었다[9]. 이처럼 근감소증 및 인지에 대한 공통 위험 요인 및 기전의 식별은 근육감소증 및 인지 저하를 늦추거나 예방할 수 있는 비 약물적 표적 중재의 접근을 가능하게 한다. 그러나 인지와 근감소성 위험요인과의 연관성은 완전히 밝혀지지 않았다. 인지기능의 저하와 관련성이 있는 운동학적 요인으로는 낮은 수준의 근력과[10] 보행속도[11–13], 심폐지구력[14] 등이 보고되고 있다. 근력은 고령자에게 중요한 건강지표로서 전반적인 신체기능과 비례하고 사망률과도 관련이 있으며[15], 근력의 대표적 평가방법인 악력(Handgrip strength, HGS)은 인지기능을 예측할 수 있는 지표 중 하나로[16], 지금까지의 많은 선행연구에서, 낮은 수준의 HGS과 인지기능이 독립적으로 연관된다고 보고되고 있다[17–19]. 또한, 보행속도의 저하는 노화로 인한 기능 퇴행 및 일상 신체 활동 저하와도 관련이 있으며, 일반적으로 노쇠한 고령자 및 근감소성 고령자 환자에서 많이 관찰될 뿐 아니라, MCI 환자에 있어서도 주요 위험지표로 인식되고 있다.
노인 인구집단에 있어, 긍정적인 유산소성 지구력은 피로하지 않고 지속적으로 활동을 수행 가능하게 하며, 심폐혈관계 및 뇌 건강에 보호인자로 작용한다고 보고하고 있다[20]. 높은 심폐지구력, 근육량 등의 신체조성의 개선은 뇌의 신경영양인자(Neurotrophin)의 활성을 조절하고 뇌 유래 신경영양인자 생성을 증가시켜 뉴런 생성 및 활성화를 보조하며[21], 인지기능의 향상에 기여한다[22]. 개선된 유산소성 능력은 전전두엽 및 측두 회백질 부피증가에 기여한다는 연구결과도 보고되고 있으며[23], 고령자의 운동 협응 및 보행조절에 관여하는 전두전엽, 두정엽 등의 뇌영역은 인지기능의 공통영역으로[24,25], 운동학적 지표의 개선은 뇌가소성 및 인지잔존능력의 개선과도 관련이 있다.
신체조성을 평가하는 방법으로는 근력 비교와 생체전기 임피던스 분석법(bioelectrical impedance analysis, BIA)를 사용하여 근육량을 비교하는 방법이 있다[26]. BIA는 고령자의 근육감소를 평가하기위해 사용되며 비 침습적이고, 간단히 신체구성을 추정할 수 있어 널리 사용된다. 인지기능 저하의 위험 요인으로 낮은 체질량지수(Body mass index, BMI)와 체중 감소 및 높은 지방량이 있으며[27], BMI와 체중의 감소는 흔히 알츠하이머 발병 전 나타나는 특징으로[28], 최근 높은 지방량과 함께 MCI 예후 지표로 제시되고 있다.
최근 연구에서는 BIA를 이용한 위상각(phase angle, PhA)이 근육의 질 및 세포의 건강도를 평가하는 지표로 주목받고 있다. PhA은 Reactance 및 Resistance으로부터 직접 계산되며, 세포막의 완전성과 세포기능을 반영하는 세포 건강의 지표로 알려져 있다[29]. 더욱이, 많은 연구에서 낮은 PhA은 근육 기능 감소, 낮은 근육량 또는 근력과 상관관계가 있다고 보고되고 있으나[30,31], 인지기능과 관련해서는 위상각과 관련된 연구는 거의 없는 실정이다.
이처럼 노화는 골격근 악화와 인지 저하 모두에 중요한 역할을 한다. 선행 연구에 의하면 치매 및 MCI의 유병률과 위험요인은 인구학적 특성인 연령과 성별에 따라 달라질 수 있으며[9,11], 근감소증의 유, 무 및 운동학적 지표에 따라서 달라질 수 있다. 이러한 특성을 분석하기 위해서는 근감소성 인구집단을 대상으로 한 연구가 필요하다. 하지만 대부분의 연구는 각각의 독립적 질환에 대한 탐색 및 선형적 관계를 규명하는 것에 머물고 있거나 운동학적 지표보다는 인지기능의 탐색에 대한 연구가 주를 이룬다. 따라서 본 연구는 근 감소성 MCI의 위험에 관련한 신체기능 지표들의 선형적, 비선형적 관련성을 규명하여 지역사회 여성의 근감소증을 동반한 MCI 조기 예측의 운동학적 근거를 제안하는 것을 목표로 한다.
연구 방법
1. 대상자 및 연구 설계
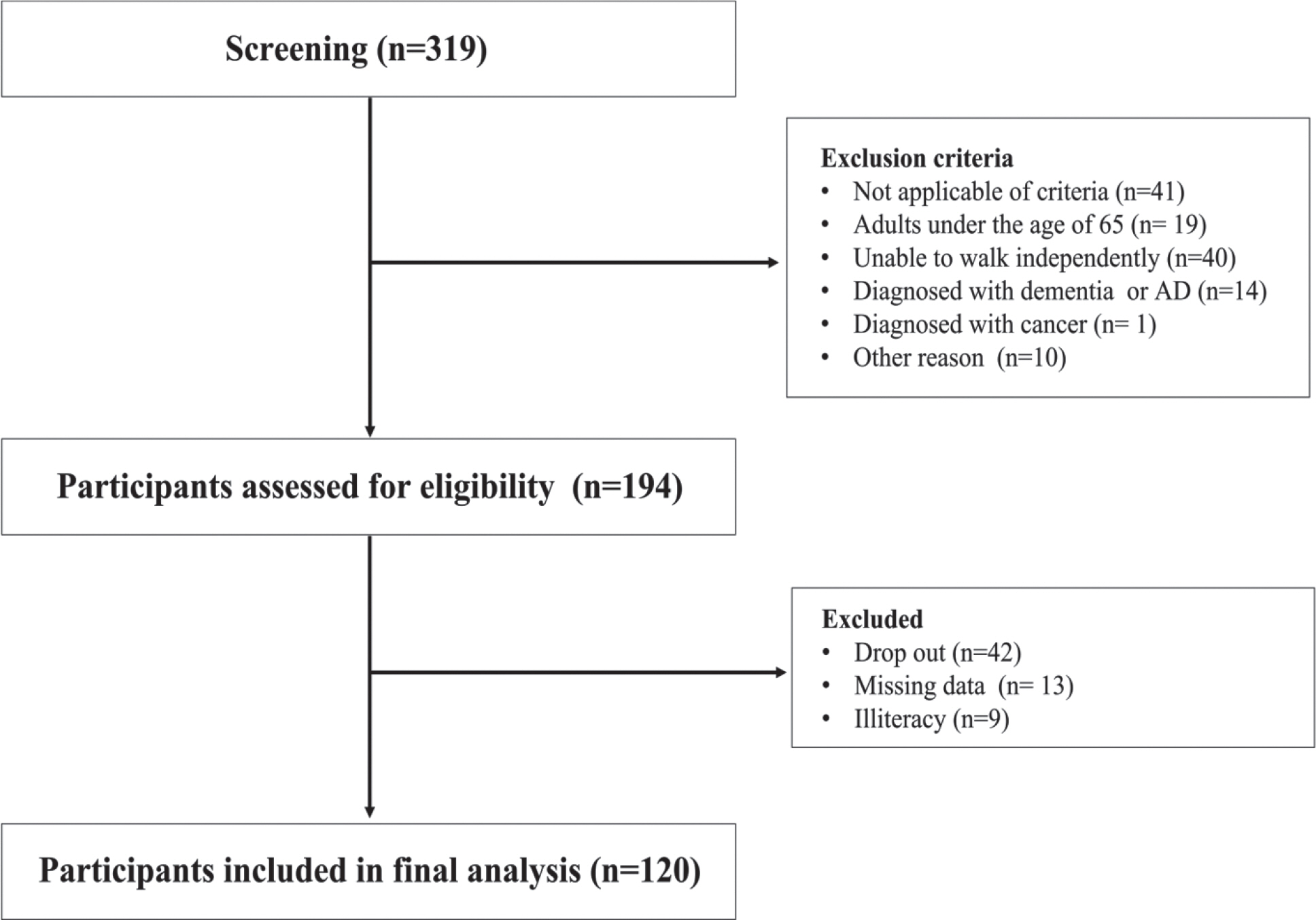
본 연구의 대상자는 지역사회에 거주하는 65세 이상의 고령자로, 지역 보건소로부터 모집되었다. 신체기능, 인지기능 등을 평가하는 검진에 자발적 참여의사를 밝힌 319명의 대상자 중 치매 또는 알츠하이머, 중추 신경계에 영향을 미치는 것으로 알려진 질병의 병력이 있거나, 암, 독립적인 보행이 불가능한 대상자를 제외한 총 120명의 참가자들을 대상으로 하였다(Fig. 1). 본 연구의 대상자는 여성고령자로[32] 선정하였고 평균나이는 76.9±3.9세이다. 대상자의 선정기준은 임상의로부터 치매진단을 받지 않았고, 독립적인 보행이 가능한 자로 의사소통이 가능하고 문맹이 아니며, 이비인후과적 진단을 통하여 어지러움증 또는 이석증의 병력이 없는 자, 측정이 불가능하다고 판단될 정도의 신체적 및 정신적인 장애가 없는 자로 선정된다. 대상자는 연구에 참여하는 동의서를 작성하였고 윤리적 보호를 위해 본 연구는 동아대학교 기관생명윤리위원회의 승인을 받았다(2-1040709-AB-N-01-202202-HR-020-04).
2. 낮은 근육량을 동반한 MCI 진단
낮은 골격근량과 근감소증 및 근감소증의 전 상태에 대한 기준은 Asian Working Group for Sarcopenia (AWGS)에서 정의되었다[26]. 생체저항 분석장치를 통해 측정된 사지 근육량(appendicular skeletal muscle mass, ASM)을 신장의 제곱으로 나누어 골격근량 지수(skeletal muscle index, SMI)를 산출하고, 계산되어진 SMI 수치가 <5.7 kg/m2일 경우 본 연구에서는 낮은 근육량 즉 근감소성 위험 상태로 정의한다[26].
또한, 본 연구에서 MCI의 평가는 전반적 인지기능 및 임상적 소견을 기반으로 임상의에 의해 판정하였다. 전반적 인지기능(global cognition)의 평가는 Korean version of Mini Mental State Examination (K-MMSE)를 사용하였다. K-MMSE는 Folstein et al. [33]이 만든 간이 정신 상태 검사(Mini Mental State Examination, MMSE)를 한국인에게 적용하기 위해 수정한 한국어판 간이 정신 상태 검사로[34], 시간 지남력 5점, 장소 지남력 5점, 기억력 3점, 기억회상 3점, 주의 집중과 계산 능력 5점 언어 능력 8점, 시각적 구성 1점(겹쳐져 있는 두 오각형 모양을 보고 따라 그리기) 항목으로 구성되어 총 30점 만점으로 계산된다. 합계 점수는 30점에 가까울수록 인지기능이 좋음을 의미한다[35,36].
본연구의 대상자는 낮은 골격근량을 동반하였으며, 임상의의 판정에 따라 근감소성 대상 및 근감소성 MCI의 두 그룹으로 분류하였다.
3. 신체조성 및 신체기능
혈압은 최소한 10분 이상 휴식을 취한 후 안정된 상태에서 의자에 앉아 팔을 심장 높이로 하고 자동전자혈압계(OMRON HEM-7120, Omron Corporation, Kyoto, Japan)를 사용하여 측정하였으며, 측정오차를 줄이기 위해 측정은 2회 실시하여 평균값을 사용하였다. 신체조성은 다주파의 생체전기 저항 분석법(Bioelectrical impedance analysis, BIA)을 활용한 인바디 생체저항 분석장치(Inbody S-10; Inbody, Seoul, Korea)를 이용하여 측정하였다. 대상자는 편안한 자세로 안정을 취한 후, 바로 누운 자세(supine position)로 측정을 수행하였으며, 가벼운 복장을 착용하도록 유도하였고, 측정 시 전류의 흐름을 방해할 수 있는 금속성 물질을 제거하였다. 또한 측정값의 오차를 줄이기 위하여 측정 2시간 전부터는 수분섭취를 제한하였다. 분석결과로부터 체중, 골격근량을 측정하고 사지 골격근량을 신장의 제곱으로 나누어 골격근육지수(Skeletal muscle mass index, SMI)를 산출하였다. 또한 내장 지방량, 체지방률, 체수분량과 세포 건강도 및 면역력을 추정하기 위하여 위상각(phase angle, PhA)을 확인하였다. 세포건강의 지표로 제안되는 PhA는[37] 생체저항 분석장치를 활용하여 측정 가능하며, 저항(Resistance, R)과 리액턴스(Reactance, Xc) 두 성분의 벡터의 합인 임피던스(Impedance)가 형성하는 각도로써[38], 다음 방적식으로 표현된다. 위상각(PhA)=리액턴스(Xc)/저항(R)×(180/π) [39]. 본 연구에서 PhA은 BIA의 임상 적용을 위한 권장 사항에 따라 50 kHz에서 측정되었으며[29], 값이 높을수록 높은 세포도와 세포막의 무결성, 세포기능이 좋음을 의미한다[38].
악력(Handgrip strength, HGS)측정은 디지털 악력 측정기(Digital dynamometer TKK-5401, Takei, Japan)를 사용하였으며, 측정값은 측정자의 일관성과 정확성에 영향을 받기 때문에 오차를 줄이기 위하여 숙련된 동일한 측정자가 모든 대상자들에게 악력 측정기를 잡는 방법과 절차에 대해 설명하고 진행하였다. 대상자는 수직으로 선 상태에서 팔꿈치를 완전히 펴고 어깨와 손목을 중립 위치에 둔 채로 주로 사용하는 손(dominant)을 총 2회 측정하여 평균값을 사용하였다.
신체기능을 평가하기 위하여 간편 신체 수행 평가(Short Physical Performance Battery, SPPB)점수를 산출하였다. SPPB는 기존에 알려진 신체기능평가 방법들 중 객관적인 기능평가 세 가지(균형능력, 보행능력, 의자에서 일어서기)의 항목을 묶어서 만든 평가 방법이다. 균형 능력은 일반 자세, 반 일렬 자세, 일렬 자세로 각 동작마다 10초 이상 유지할 수 있는지 평가한다. 대상자는 일반 자세부터 평가가 시작되며, 자세를 완전히 유지할 수 있으면 다음 동작을 수행하도록 지시된다. 보행속도는 총 7 m 구간에서 가속 구간 1.5 m와 감속 구간 1.5 m를 제외한 4 m를 측정하였다. 굴곡이 없는 복도에서 측정구간의 시작 위치와 끝 위치를 테이프로 표시하고 측정 시작 전 대상자들에게 평소 걷는 속도와 형태로 걸을 것을 숙지시키고 걷는 시간을 초단위로 기록하였다. 보행속도는 총 2회 측정하여 평균값을 사용하였다. 의자에서 일어서기 검사는 최대한 빠르게 의자에서 5회 앉았다 일어서는 데 걸리는 시간을 초 단위로 평가하며, 측정자는 대상자가 동작을 수행하는 동안 낙상하지 않도록 주의한다. 측정 항목별로 0점(수행을 완료할 수 없음)에서 4점(가능한 최고의 성과달성)까지의 점수가 할당되었으며, 총점 12점으로 점수가 높을수록 전반적인 신체 기능이 좋음을 의미한다[40].
Timed up and go (TUG) 테스트는 기능적 이동성을 평가하는 데 사용되었다. 대상자들은 최대한 빠르게 의자에서 일어나 3 m 떨어진 마커를 돌아와 다시 의자에 앉도록 지시하였다. 총 2회 측정 초단위로 기록하였으며, 빠른 시간을 사용하였다[41].
유산소성 능력을 평가하기 위하여 노인들의 지구성 검사에 주로 활용되는 6분 걷기검사(Six-minute walk test, 6 MWT)를 수행하였으며, 총 30 m 구간을 설정하여 6분 동안 걸을 수 있는 총거리를 측정하였다. 측정자는 검사하는 동안 대상자에게 남은 시간을 알려 대상자 스스로의 페이스를 조정할 수 있도록 유도하였다[42].
4. 통계분석
통계분석을 위하여 SPSS Statistics version 21 (IBM Corp, Armonk, NY, USA) 및 R studio (version 1.3.1093)프로그램을 이용하였으며, 대상자들의 각 변인들의 정규성 검증을 위해 Shapiro-Wilk test를 실시하였고, 각 그룹 간의 차이검증은 독립표본 t-검정(Independent t-test)을 실시하였고, 측정변수가 정규분포를 이루지 않을 경우, 읠콕슨 순위합 검정(Wilcoxon rank-sum test)을 실시하였다. 본 연구에서 사용된 운동학적 지표들이 MCI 위험에 미치는 영향을 파악하기 위하여 각 측정 변수를 균등하게 분위하여, 다항 로지스틱 회귀분석(Multinomial Logistic Regression)을 실시하였고, Odd's ratio와 95% 신뢰구간(confidence intervals, CI)를 산출하였다. 또한 로지스틱 회기 모델을 통해 도출한 선형결과에서 얻은 운동학적 지표가 MCI 위험에 미치는 비선형적 관계성을 검증하기 위하여 평활화 모형을 활용하여 시계열분석에 주로 이용되는 일반화가법모형(generalized additive models, GAM)으로 신체기능이 MCI 위험에 미치는 비선형성을 분석하였다. 모든 통계적 유의 수준은 0.05 이하로 실시하였다.
연구 결과
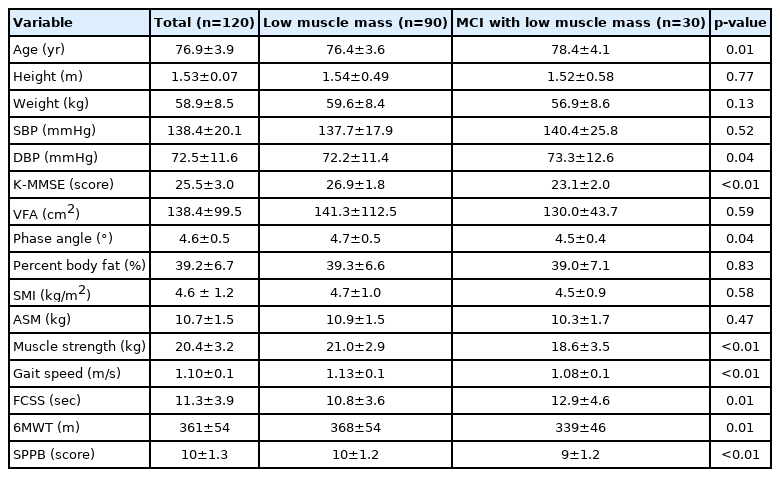
대상자의 기본 특성은 신체조성, 신체기능 및 인지기능과 함께 Table 1에 나타내었다. 모든 대상자는 근감소증의 위험수준에 해당하는 낮은 사지 골격근량을 가졌으며, MCI 군의 경우 MMSE 점수는 23.1±2.0 점으로 MCI를 동반하지 않은 군에 비하여 유의하게 전반적 인지기능 점수가 낮은 것으로 나타났다. MCI의 유무에 따라 낮은 근육군(low muscle mass, LMM)의 PhA는 4.7±0.5°이며, 낮은 근육군이면서 MCI 을 동반한 군에서는(MCI with low muscle mass, LMCI) 4.5±0.4°로 LMCI 군에서 유의한 낮은 PhA 값을 나타내었다 (p <.05). 또한, 신체기능에 있어서도, HGS (LMM: 21.0±2.9 kg, LMCI: 18.6±3.5 kg, p <.01)과 보행속도(LMM: 1.1±0.1 m/s, LMCI: 1.0±0.1 m/s, p <.001)가 나타났으며, 간편신체수행평가에 그 차이(LMM: 10.8±1.2, LMCI: 9.6±1.2, p <.001)는 높은 유의확률을 보였다.
다중 로지스틱 회귀 분석 결과는 Table 2와 같다. 선행연구에 의해 근감소증의 대표적 위험 요인 및 MCI와의 공통 위험요인으로 보고되고 있는 근력과 유산소성 지구력, 간편신체수행평가, PhA의 로지스틱 모델의 Odds ratio와 95% 신뢰구간을 산출한 결과 낮은 근력(<20.4 kg), 유산소성 지구력(<359 m), SPPB (<11), PhA (<4.7도) 을 가진 노인여성의 경우 높은 신체기능을 가진 대상에 비하여 각각 MCI에 노출될 위험이 3.04, 4.93, 5.44, 3.12배 높은 것으로 나타났다. 하지만, BMI, 연령, 수축기 혈압, 이완기 혈압 등의 보정변수를 보정하였을 때, 낮은 유산소성 지구력이 3.69배 MCI의 위험에 유의하게 기여하는 Odds ratio가 나타났다.
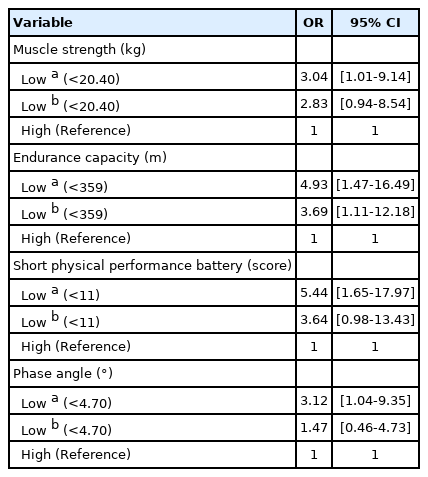
Comparisons of the odds ratios for physical function and phase angle of MCI with low muscle mass group
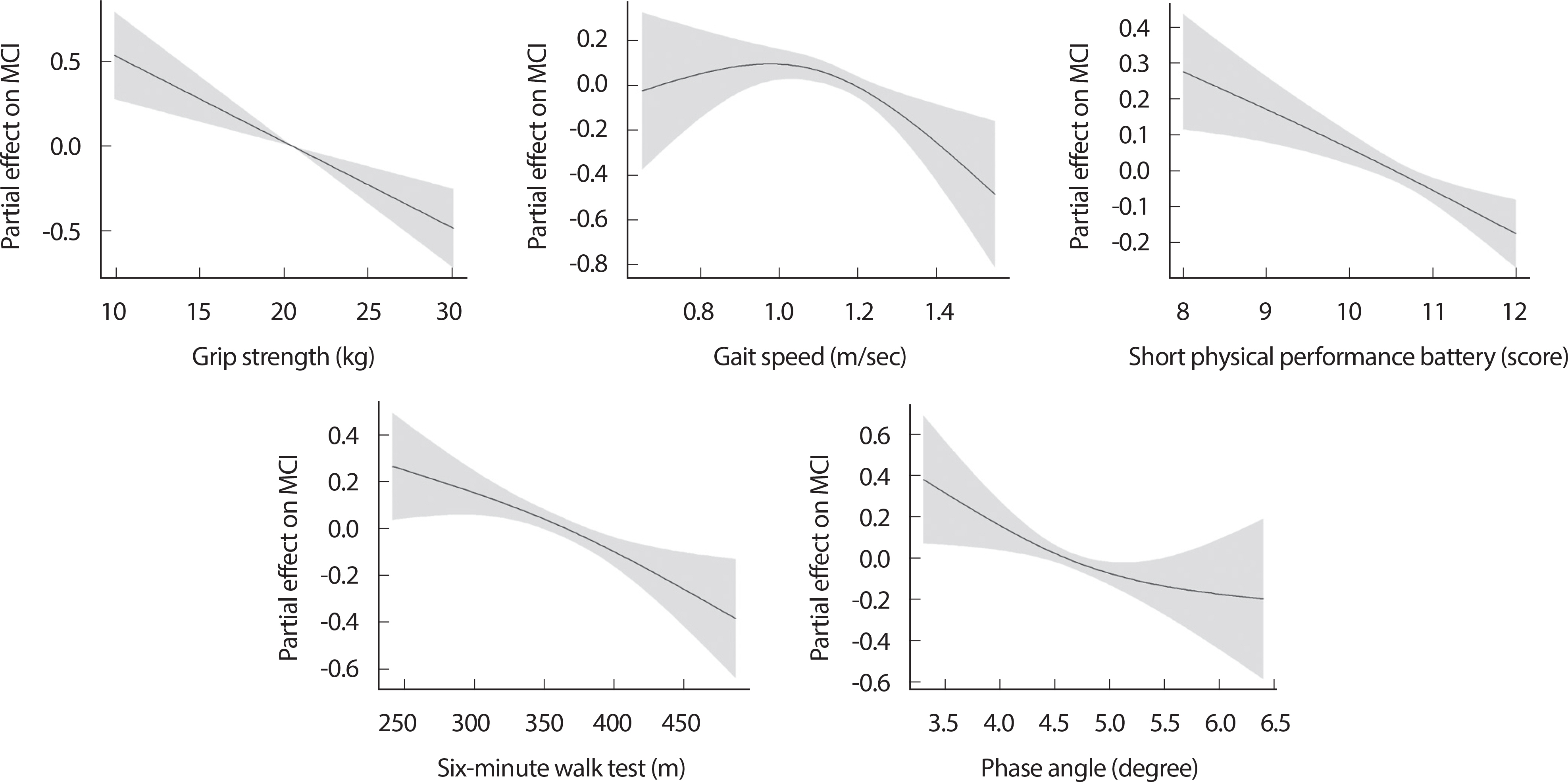
본 연구에서 수행한 운동학적 지표와 MCI의 위험성이 가지는 비선형적 관계를 분석하기 위하여, 표본설계에 따라 가중치를 고려한 일반화된 가법 모델(Generalized additive model, GAM)을 사용하여 분석하였다(Fig. 2). HGS와 SPPB 및 6MWT의 경우 MCI의 위험과 선형적으로 관련이 있음이 나타났다. 하지만 보행속도의 경우 1.07 m/s partial effect의 천정효과가 나타났으며, 그 이후 MCI에 대한 위험은 점진적으로 감소하는 경향이 있는 것으로 나타났다(F: 33.2, PE: 1.88, p <.05). 더불어 PhA의 경우에도 유사한 결과가 나타나 4.5°에서 천정효과가 있으며, 이보다 낮을 경우 MCI의 위험이 점진적으로 증가하는 관계가 나타났다(F: 40.1, PE: 1.90, p <.05).
논 의
본 연구는 낮은 근육량을 동반한 여성고령자를 대상으로 MCI의 위험에 기여하는 운동학적 지표와 신체조성 및 PhA와의 관련성을 분석하여 알아보고자 하였으며, 운동학적 지표인 유산소성 지구력, 근력, SPPB, 보행속도 및 세포의 건강도와 면역기능의 추정지표인 PhA이 여성 고령자의 근감소성 MCI 위험성과 독립적인 관련이 있음을 확인하였다. 특히 관련 보정 변수를 보정한 경우, 유산소성 지구성이 MCI와 관련이 있는 가장 유의한 지표인 것으로 사료되며, 더불어 보행속도와 PhA의 경우 MCI의 위험과 비 선형적 관계성을 가지는 것으로 나타났다. 연령의 증가에 따라 신체 및 인지기능의 저하가 발생하며, 이는 근감소증과 인지 장애와 같은 노인성 질환의 주요 원인으로 보고되고 있다[7,43]. 그럼에도 불구하고, 많은 연구에서는 인지기능 저하자의 인지기능 및 신체 및 근기능에 대한 각각의 연구는 활발하게 진행되고 있으나, 낮은 근육량을 동반한 근감소성 MCI와 같은 고위험군의 경우 운동학적 위험 지표에 관한 연구는 거의 없는 실정이다.
본 연구에서는 근감소성 MCI의 위험유무에 따라 근력, 보행속도 등의 신체기능에 따라 차이가 있음을 나타내며, 특히, 다요인 보정 모델에서는 유산소성 지구력이 정상인에 비해 낮을 확률이 3.69배 유의하게 높게 나타났다. 이러한 발견은 유산소성 체력과 인지 사이의 연관성을 조사한 기존의 여러 문헌과 일한다. 예를 들어, 여러 연구에서 자가보고의 지속적 신체활동 수행능력과 종단적 인지 감소[44] 사이에 상당한 연관성이 있다고 보고하였다. 우리의 연구는 이러한 발견을 두 가지 방식으로 확장한다. 첫째, 우리는 지역사회기반의 노인 심폐 건강의 대표적 지표인 6 MWT를 조사하여 기 역치 수준을 제안하였다. 또한 Wendell et al. [45]의 연구에서 시사하듯이, 저하된 VO2 max가 글로벌 인지 감소 및 주의력, 실행 기능 및 기억 측정에 대한 더 나쁜 후속 성과와 관련이 있음을 발견한 선행연구는 본 연구의 결과를 지지한다. 여러 메커니즘이 심폐 건강과 인지 기능 간의 연관성을 설명할 수 있는데, 생의학적, 행동적 심혈관 위험 요소는 심폐 건강과 상관관계가 있으며(예: 뇌 혈류개선), 이러한 위험 요소는 신경심리학적 기능과도 관련이 있다[46]. 또한, 위험 요소의 집합은 근감소증을 동반할 뿐 아니라 증상이 없는 심혈관 질환의 수준과도 관련이 있으며, 이는 차례로 건강한 성인의 인지 기능 및 쇠퇴와 관련이 있다[47]. 선행 연구에서는 유산소 운동이 뇌 구조와 기능에 직접적인 영향을 미친다고 나타냈으며, 신경 발생 및 신경 보존 증가와 관련이 있고, 뇌 유래 신경 영양 인자 및 신경 성장 인자의 상승 역할을 하는 것으로 생각할 수 있다[48]. 특히, 이러한 운동 효과는 해마에 의해 나타나는 것으로 보이는데[49], 1년간 고령자를 대상으로 유산소 운동 중재를 수행하였을 때, 유산소성 지구력의 증가는 해마의 크기와 기억 능력이 증가하는 것으로 나타나[50], 장기간의 유산소 운동 중재를 통한 유산소성 능력의 증가는 고령자의 인지기능 개선에 기인한다고 볼 수 있다.
이러한 기능개선은 유산소성 지구력뿐만 아니라 보행속도 및 근력과도 관련이 있는 것으로 알려져 있다. 본 연구에서는 보행속도가 일정수준 이상으로 증가하면 근육량이 낮은 MCI 군에서 위험이 감소하는 비선형 관계를 나타냈으며, <1.07 m/s일 때 위험도가 점진적으로 감소되는 것을 확인할 수 있었다(Fig. 2). 이러한 결과는 Asian Working Group for Sarcopenia [26]의 근감소증 진단기준(<1.0 m/s)보다 약간 높은 기준치를 나타낸다. 이미 선행연구를 통해 낮은 보행속도는 근육구조 및 기능의 양적, 질적 변화와 관련이 있다는 것이 보고되어 있으며[51], 1,478명의 고령자를 대상으로 진행된 횡단면 연구에서도 보행 속도는 기억력, 실행 기능 및 글로벌 인지능력과 관련이 있음을 나타내었다. 보행 기능은 중추신경계의 병리학적 변화를 포함하여 다양한 요인에 영향을 받을 수 있으며, 운동 및 인지기능을 포함한 여러 시스템의 상호작용이 필요한 복잡한 행동으로, 특히 인지기능과 보행능력은 뇌의 피질 영역을 공유한다[52,53]. 근력은 지역사회 및 임상 환경에서 쉽게 측정할 수 있는 HGS를 사용하였으며, 이는, 근감소증의 진단기준으로도 사용이 되며, 실행 기능, 주의력, 언어 등의 전반적인 인지기능과 높은 상관관계를 보인다[54]. HGS의 감소는 개인의 인지기능과 유의한 역상관관계를 보이고 있어 인지 저하 정도를 유추할 수 있는 기능적 마커이고[17,54], 근감소증의 근력 평가 항목에 주로 사용되는 주요 지표로[55], 고령자에게 있어 낮은 근육량을 동반한 인지 저하자의 중요한 운동학적 지표이다. 횡단면 연구에서도 MCI는 약한 HGS과 관련이 있었으며[18], 신경계 활동 및 백질 무결성의 변화로 근력이 약해지거나, 신경근 협응을 필요로 하는 전두엽의 기능저하 등의 이유로 인지기능과 낮은 근력과의 관련성을 설명할 수 있다[56].
연령이 증가할수록 신체기능 및 근기능이 감소하며 이는 인지기능의 저하와 관련이 있고 근감소증에 의해 매개되거나 관련될 수 있으나, 근육량과는 무관함으로 밝혀져 근육량보다 근력 및 근육기능 평가가 중요함을 시사한다[57,58]. 본 연구에서는 보행속도, 균형능력, 의자 앉았다 일어서기 등 신체적 기능을 평가하는 SPPB 검사에서도 MCI 위험과 연관성이 발견되었다. 70세 이상 11,466명을 대상으로 진행된 대규모 인구 기반 연구에서 MCI가 있는 대상자는 하지 근력, 균형능력 및 HGS가 감소하였고, 치매환자에서는 모든 신체기능에서 가장 낮은 점수를 보였다[52].
신체기능을 간편하게 평가할 수 있는 SPPB는 근육감소증의 또 다른 지표로써, 감소된 신체 능력은 고령자의 후기 인지 장애 위험과 독립적으로 연관되어 있다[59]. 본 연구에서 SPPB는 정상인 그룹(10±1.2)에 비해 낮은 근육량을 가진 MCI 그룹(9±1.2)에서 더 낮은 점수를 가졌으며(Table 1), SPPB가 1점 감소할 때 신체 및 인지 기능에 영향을 미칠 수 있음을 시사한다[60]. 이러한 결과는 신체기능의 평가지표인 SPPB가 근감소증 및 MCI의 위험을 평가할 때 유용할 수 있다. 또한, 주관적 인지 저하, MCI 및 치매에 이르기까지 스펙트럼 전반에 걸쳐 신체기능이 감소한다는 결과와 본 연구의 결과는 일치한다[52].
우리 연구에서는 또한 PhA가 근감소증 및 MCI 위험과 관계가 있음이 확인되었다. PhA는 근육의 질 평가, 세포 건강의 지표로 간주되며[61], 병리 및 사망률과 관련된 염증과 전염증성 사이토카인과도 연관되어 있어 스트레스 산화 마커와 관련된 신뢰할 수 있는 변수이다[62]. 이미 많은 선행연구에서 사이토카인은 MCI와 알츠하이머 병(AD)을 포함한 여러 신경 퇴행성 질환 및 신경 염증과 연관되며[63], 신경변성의 위험인자로 알려진 노화와 스트레스로 사이토카인의 증가에 대해 보고되었다[64]. 또한, 염증성 마커 interleukin-6 (IL-6) 및 tumor ne-crosis factor alpha (TNFα)는 보행 속도와 연관되어 있으며[65], 이러한 염증상태를 포함한 신체 활동 부족, 호르몬, 대사작용 등 여러 요인들은 매우 복잡한 근감소증의 병인으로[66,67], 근감소증의 발생과 관련된 염증 매개체 증가 사이의 연관성은 620명의 고령자를 대상으로 진행된 선행연구에서 밝혀졌다[68]. 염증 및 산화 스트레스를 포함한 다양한 기전을 통해, 최근 근감소증과 새로운 예측인자로 보고되고 있는 PhA는[69] MCI의 예측에도 유효한 지표로 사료된다. 560명의 지역사회 거주 고령자를 대상으로 진행된 연구에서 정상적인 인지기능을 가진 그룹보다 알츠하이머병 또는 치매가 있는 그룹에서 더 낮은 리액턴스와 체세포 질량을 보고하였으며[70], 분절 근육량, 하지의 저항 및 리액턴스가 MCI와 유의하게 연관되어 있음을 확인하였다[71]. 또한, MCI가 있는 남성에서 생체전기 임피던스 벡터 분석을 통해 RXc 그래프에서 일반적이지 않은 타원형을 확인하였고, 이것이 감소된 전도성 조직 질량, 즉 근육감소증과도 연관이 있음을 확인하였다[72]. 이는 노화과정에 있어 인지기능과 함께 연조직 질량이 독립적으로 감소할 수 있음을 시사한다[72].
따라서, 낮은 근육량을 동반한 여성고령자에게서 PhA는 MCI의 고위험군을 추정할 수 있는 매우 실용적이며 유효한 지표로 볼 수 있다[73,74]. 더불어 본 연구에서는 PhA가 천정수준 이상으로 증가하면 MCI의 위험이 완만하게 감소하는 비선형 관계를 나타나, PhA는 약 <4.5° 역치 수준은 근감소성 MCI의 위험 예측 및 개선을 위한 유효한 지표로 활용될 수 있을 것으로 사료된다.
정상에서 경도인지 장애를 거쳐 치매로 이르는 질병의 경과를 고려할 때 지역사회 기반의 치매예방을 위한 고위험 대상 집단인 MCI, 특히 근감소성 MCI 대상의 운동학적 특성을 파악하는 것은 효율적인 치매예방 및 노인성질환 예방 전략 수립에 필요한 기본적인 자료이다. 현재까지 지역사회 거주 근감소성 위험을 동반한 고령여성을 대상으로 운동학적 지표와 MCI의 선형 및 비선형 연관성에 대한 조사한 연구는 부족한 실정이며, 특히 후기고령자를 대상으로 근육감소증의 위험과 인지저하의 위험을 함께 보는 연구는 이루어지지 않고 있다. 따라서, 본 연구를 통하여 조사된 운동학적 위험지표의 활용은 지역사회 고위험 고령자의 조기 스크리닝 및 맞춤형 운동 중재 개발에 활용될 수 있을 것으로 사료된다.
결 론
본 연구는 낮은 근육량을 동반한 근감소성 MCI 여성고령자를 대상으로 운동학적 지표 및 PhA과의 관련성을 선형 및 비선형으로 비교 분석한 결과, 낮은 근력, 유산소성 지구력, SPPB, PhA와 같은 신체기능지표의 악화는 MCI의 위험을 1.4배에서 5.6배 높이는 것으로 나타났다. 더불어, 보행속도, PhA은 MCI의 위험과 비선형적 관계가 있음을 확인하여, 일정 역치 수준의 지표개선을 하기 위한 운동학적 접근은 관련질환 예방에 중요할 것으로 생각된다. 바꾸어 말하면, 지역사회 기반의 운동중재에 있어 비교적 간편하게 수행할 수 있는 HGS, SPPB, 지구력, PhA 등의 운동학적 지표를 평가하고 개선하는 것이 치매, 근감소증과 같은 노인성 증후군의 예측 및 예방에 기여할 수 있는 것으로 전망한다.
Notes
이 논문 작성에 있어서 어떠한 조직으로부터 재정을 포함한 일체의 지원을 받지 않았으며, 논문에 영향을 미칠 수 있는 어떠한 관계도 없음을 밝힌다.
AUTHOR CONTRIBUTION
Conceptualization: H Park; Data curation: JG Yang, GM Kim; Formal analysis: JG Yang, GM Kim, S Bae; Funding acquisition: H Park; Meth-odology: JG Yang, GM Kim, S Bae; Project administration: H Park; Vi-sualization: JG Yang, H Park Writing - original draft: JG Yang; Writing - review & editing: JG Yang, GM Kim, S Bae, H Park.