모체운동이 새끼 쥐의 텔로미어 길이와 텔로미어 조절 단백질 발현에 미치는 영향
Effect of Maternal Exercise on Telomere Length and Telomere-Regulating Protein of Offspring in Rat
Article information
Trans Abstract
PURPOSE
This study was performed to investigate the effect of maternal exercise on cardiac and skeletal muscle telomere length and telomere repeat binding factor 2 (TRF2) in rat offspring.
METHODS
Sprague-Dawley rats (10 wk, N=21) were randomly assigned into control (CON), exercise during pregnancy (ExD), and exercise before and during pregnancy (ExBD) groups. Maternal training was performed on a rodent treadmill for 1 hour at 60-75% VO2max for 3 weeks (5 d/w) before and during pregnancy respectively. The offspring were sacrificed at birth and telomere length and TRF2 expression were measured with cardiac and skeletal muscle samples.
RESULTS
CON group had significantly longer telomere length (p=.011, p=.049) and higher TRF2 expression (p=.011, p=.002) than other two groups in skeletal muscle of offspring. In the cardiac muscle, CON group showed longer telomere length compared with ExD group in offspring (p=.001).
CONCLUSIONS
Intense maternal exercise before or during pregnancy may negatively affect their new offspring’s cardiac and skeletal muscle telomere length and TRF2 expression.
서 론
진핵생물의 염색체 말단에는 TTAGGG의 특정 염기서열이 반복되는 DNA와 단백질의 복합체가 존재한다[1]. 이 부분을 텔로미어(telomere)라고 부르며, 조직의 종류에 따라 2-20 kb 정도의 다양한 길이를 지니고 있다[2]. 텔로미어 주변에는 6가지의 텔로미어 조절단백질(Telomere-regulating proteins : telomere-repeat binding fartors 1 [TRF1] and 2 [TRF2], TRF1-interacting protein 2 [TIN2], protection of telomeres 1 [POT-1], the POT-1 and TIN2-organizing protein repressor/activator protein 1 [RAP1], 그리고 tripeptidyl peptidas 1 [TPP1])들이 존재하며, 이 인자들은 텔로미어의 안정적인 DNA 구조 유지와 텔로미어 길이 변화에 직접적인 영향을 미친다[3]. 특히, 텔로미어 조절단백질 중 TRF2는 텔로미어 구조의 안정성 유지와 텔로미어 변화에 있어 상호작용하는 핵심적인 단백질이다[4].
텔로미어는 염색체 말단에 위치하여 DNA의 구조적 안정성 유지와 DNA 손상으로부터 세포를 보호하는 역할을 하고 있다[5]. 텔로미어 길이는 세포분열이 한 번 일어날 때마다 30-200 DNA nucleotide가 소실되어 짧아진다[6,7]. 그 이유 중 하나는 end replication problem으로 DNA 복제 시 DNA polymerase가 붙어있던 부분은 복제하지 못하는 DNA 복제기전의 문제점이 작용하기 때문이며, 이러한 복제의 문제점은 세포분열에 한계(Hayflick limit)가 있다는 것을 의미한다[8]. 반복되는 세포분열로 인해 텔로미어가 모두 소멸되었을 때에는 유전정보를 지니고 있는 DNA sequence에 손상을 가져오게 되며 이것은 결국 세포기능에 이상(dysfunction)을 가져오거나 세포사멸(apoptosis)을 초래하게 된다[9]. 텔로미어 길이가 짧아짐으로 인해 세포의 기능이상이나 세포사멸이 증가하게 될 경우, 심혈관계질환[10]과 인슐린 저항성, 고혈압[11] 등이 발병될 확률이 증가하며, 사망률 또한 증가하는 것으로 보고되었다[12]. 따라서 염색체가 지닌 텔로미어 길이는 세포분열의 역사를 예측해 볼 수 있고, 세포의 노화 정도를 확인할 수 있는 세포노화의 biomarker로 활용될 수 있다[13].
텔로미어가 발견된 후 많은 연구(in vivo)들은 세포분열 외에도 텔로미어 길이에 영향을 미치는 다양한 외부적인 요인이 있음을 밝혀냈다. Epel et al. [14]은 동일한 연령대의 만성질병에 걸린 자녀를 둔 어머니와 건강한 자녀를 두고 있는 어머니의 텔로미어 길이를 비교한 결과, 자녀의 건강문제로 정신적인 스트레스를 받고 있는 어머니 집단의 peripheral blood mononuclear cells (PBMC) 텔로미어 길이가 더 짧은 것을 확인하였다. Valdes et al. [15]은 여성을 대상으로 흡연은 텔로미어 길이에 부정적인 영향을 미친다고 보고하였으며, Cattan et al. [16]은 만성적인 산화 스트레스가 텔로미어 길이를 감소시킨다는 결론을 내었다. 이와 같이 텔로미어 길이에 부정적인 영향을 미치는 요인들로 인해 텔로미어 길이 감소가 가속화될 경우, 동일한 연령대에서 보다 질병에 걸릴 확률이 증가하며 수명 역시 짧아지게 된다.
텔로미어 길이가 세포분열의 내제적인 요인 외에 외부적인 영향을 받는 것이 밝혀지자 운동과 텔로미어 길이 간의 상관관계에 관한 연구들이 진행되었다. 규칙적으로 지구성 운동을 실시한 노인과 좌식생활의 노인 간 백혈구 텔로미어 길이를 분석한 결과 규칙적으로 지구성 운동을 실시한 노인집단의 텔로미어 길이가 운동하지 않은 노인집단보다 최고 900 bp까지 긴 상태를 유지하였고, 최대 유산소 능력(VO2max)과 평균 텔로미어의 길이는 정적인 상관관계를 나타냈다[17]. 설치류를 대상으로 수영운동을 실시한 Kim et al. [18]의 연구에서는 20주간의 장기간 운동을 실시한 쥐의 심근에서 운동을 실시하지 않은 집단과 단기간 운동을 실시한 집단(4주)보다 더 긴 텔로미어 길이와 많은 TRF2 발현량이 보고되었다. 이 외에도 3주간의 자발적인 휠(Wheel) 운동은 심근에서 TRF2 mRNA 및 단백질 수준을 증가시킨다는 것이 밝혀졌고[19], 지구성 운동선수들의 경우 일반인들보다 골격근에서 더 긴 텔로미어 길이를 유지하고 있음을 확인할 수 있었다[20]. 이처럼 운동은 텔로미어 길이 감소를 억제시키며 텔로미어 조절 단백질의 발현량을 증가시킬 수 있다는 연구결과들이 제시되고 있다. 따라서 운동을 통해 텔로미어 길이 감소를 예방하여 세포의 기능이상과 세포사멸을 완화시킴으로써 질병에 걸릴 확률을 감소시키는 것뿐만 아니라 수명의 연장을 기대해 볼 수 있다.
최근 여러 논문에서 모체의 운동영향이 자녀에게 유전된다는 모계유전의 결과들을 제시하고 있다. Park et al. [21]은 수태 중인 어미 쥐에게 유산소 운동을 시킨 후 미토콘드리아의 에너지대사관련 효소와 생합성(biogenesis) 요인 등 어미에게 나타나는 운동의 긍정적인 효과가 태어난 새끼 쥐에게도 동일하게 나타남을 보고하였다. 또한 같은 부모에게 태어나 다른 환경에서 자란 일란성 쌍생아와 다른 부모에게 태어나 같은 환경에서 자라온 사람들을 비교하니 텔로미어 길이는 환경적 요인보다 유전적인 요인에 의해 더 많은 영향을 받음이 밝혀졌다. 또한 임신시기의 아버지 나이가 많을수록 태어난 자녀의 텔로미어 길이가 길다는 연구결과들도 텔로미어가 유전의 영향을 받음을 제시하고 있다[22].
따라서 모체 운동이 태어난 자녀의 골격근과 심장근의 텔로미어 길이에 긍정적인 영향을 미친다면 운동한 모체에서 태어난 자녀는 텔로미어 길이 감소로 나타나는 세포의 기능이상과 세포사멸을 최소화할 수 있으며 태어나면서부터 골격근이나 심장 질환에 걸릴 확률을 낮출 수 있을 것이다. 따라서 이 연구는 모체운동이 태어날 새끼 쥐의 텔로미어 길이와 텔로미어 조절단백질(TRF2)에 미치는 영향을 분석하였다.
연구 방법
1. 연구 대상
실험에 사용된 쥐들은 Sprague-Dawley 종으로 가능한 유사한 형질을 나타내도록 사전에 동일한 부모의 암컷과 수컷을 동종 교배시켜 준비하였다. 실험 시 10주령 암컷(Samtako, Korea) 21마리를 각각 7마리씩 3개의 그룹으로 무선배정하였다. 실험동물은 그룹별로 나누어 한개의 Cage당 2-3마리씩 적절한 온도(22 ±2℃), 습도(50-60%), 조명(12/12시간; light-dark cycle)을 유지한 채 사육하였으며, 실험동물을 위한 식이 조성 성분은 탄수화물 67.5%, 지방 11.7%, 단백질 20.8% (Samtako, Korea)이고 사육 중 이상 증상을 보이는 동물은 실험 자료 분석에 포함하지 않았다.
2. 실험설계 및 분석방법
1) 실험설계
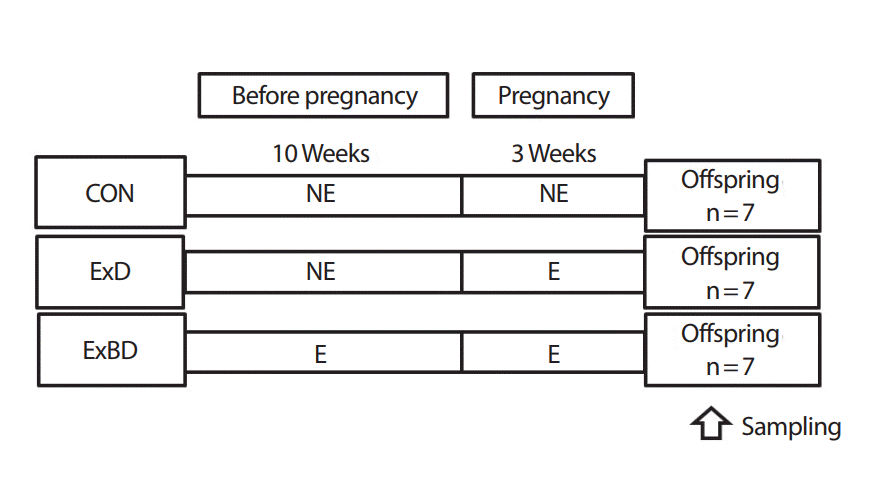
어미 쥐의 수태 중 또는 수태 전 · 중의 운동훈련이 새끼 쥐에 미치는 영향을 알아보기 위해 대조집단(Control, CON), 수태 중 운동 집단(Exercise during pregnancy, ExD) 그리고 수태 전 · 중 운동 집단(Exercise before and during pregnancy, ExBD)으로 나누었다. 분만 직후 새끼쥐를 희생시켜 필요한 조직들을 샘플링하였다. 위의 실험 설계는 Fig. 1과 같다.
2) 유산소 훈련 방법
운동집단은 동물용 트레드밀(Rodent Treadmill, Daemyung Scientific Co., Ltd, Korea)을 이용하여 유산소 운동훈련을 수행하였다. Ludlow et al. [23]은 중강도의 운동이 저강도나 고강도 운동 집단보다 텔로미어 길이의 감소가 적었음을 보고하였다. 따라서 Bedford et al. [24]의 방법을 참조하여 약 1주간 적응 훈련 후 10주 동안의 중강도 운동 프로그램을 실시하였다. 수태 전 유산소 운동훈련은 10주간 주 5일, 1시간 동안 실시하였으며 3주씩 3단계로 나누어 운동 강도를 높였고(1-3주: VO2max 60-65% [15 m/min] / 4-6주: VO2max 65-70% [18 m/min] / 7-10주: VO2max 70-75% [21 m/min]), 수태 중 훈련은 3주간 주 5일, 중강도 운동(60% of VO2max [15 m/min])을 매일 1시간씩 실시하였다.
3) 실험동물 희생과 조직 적출
어미 쥐는 분만을 마친 후 3주간 안정기를 갖은 후 희생시켜 심장근과 가자미근을 적출하여 분석이 이루어질 때까지 -80℃에서 보관하였다. 분만된 새끼 쥐는 각 3마리씩 분만 직후 신속히 어미 쥐와 분리시켜 액화질소로 동결시킨 후 분석이 이루어질 때까지 -80℃에서 보관하였다. 새끼 쥐의 심장근은 실험 직전 해부를 통하여 적출한 후 혈액이 변인에 영향을 미치지 않도록 PBS 용액을 이용하여 깨끗이 세척을 실시하였다. 새끼 쥐의 골격근의 경우 출산 직후의 새끼 쥐들은 근육끼리의 부위별 구분이 분명하지 않기 때문에 하지 전체를 절단하여 하지의 피부와 뼈를 제거한 후 근육의 어떠한 부위와는 상관없이 모든 근육조직을 샘플링하였다.
4) Western blot analysis
적출된 근육은 lysis buffer를 첨가하여 4℃에서 30분간 반응시킨 후 14,000 rpm으로 30분간 원심 분리하여 상층액을 취하였다. 상층액의 단백질 농도는 Bio-Rad 단백질 정량 시약(Bio-Rad, USA)과 그 사용방법에 따라 정량하였으며, 정량된 sample은 2X SDS loading buffer (60 mM tris Ph 6.8, 25% glycerol, 2% SDS, 14.4 mM 2-mercaptoethanol, 0.1% Bromophennol Blue)를 혼합한 후 원심분리(15,000 rpm, 20분간, 4℃)를 하였다. 10% seperating gel (30% acrylamide, 1.5 M tris Ph 8.8, 10% Ammonium persulfate, TEMED)과 5% stacking gel (30% acrylamide, 1 M tris Ph 6.8, 10% Ammonium persulfate, TEMED)을 조성하여 사용하여 스탠다드 마커(SDS-PAGE Molecular Weight Standard, BioRad)와 함께 각 샘플을 Mini-proteinⅡdual-slab apparat us (Bio-Rad, CA, USA)에 준비된 stacking gel의 well에 총 단백질량이 100 μg이 되도록 분주하여 80 volt에서 샘플이 바닥에 닿을 때까지 2시간 정도 전기영동을 수행하였다.
Methanol에 적신 PVDF membrane (Bio-rad, USA)과 Transfer buffer(190 mM glycine, 50 mM Tris-base, 0.05% SDS, 20% methanol)로 적신 3 M paper (Whatman)를 차례로 겹쳐 Mini trans-blot cell (Bio-Rad, CA, USA)에 장치한 후 60 volt로 2시간 동안 전사하여 Membrane으로의 이동이 끝나면 membrane을 rocker platform 위에서 30분 동안 3% Skim milk 용액(10 mM Tris-base, HCl-Ph 7.6, 0.5 M NaCl, 0.05% Tween20)으로 Blocking 시켰다. 1차 항체인 TRF2 (Sc-9143, Santa Cruz, CAL, USA)를 1:200 농도의 bolcking (1% Skim milk) 용액으로 12시간 동안 배양시켰다. TBS-T 용액으로 10분씩 5차례 세척한 후 2차 항체(ZuMax Rabbit anti-Goat lgG [H+L] HRP Conjugate)를 Blocking 용액으로 1:5,000 농도로 희석시켜 90분 동안 처리한 후 TBS-T 용액으로 10분씩 5차례 헹구고 마지막 단계로 WBLR solution (Luminata Crescendo Western HRP Substrate, Millipole, USA)에 membrane을 넣고 1분간 발색하여 얻어진 band를 이미지 분석 시스템(Molecular Imager ChemiDoc XRS System, Bio-Rad, USA)으로 스캔한 후 각 표본의 단백질량을 산출하였다(Quantity One 1-D Analysis Software, Bio-Rad, USA).
5) Quantitative Real‐Time PCR
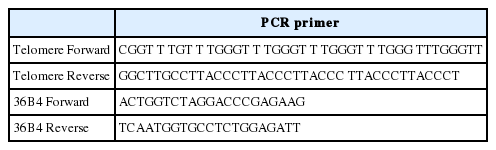
-80℃에서 보관해 놓았던 적출된 골격근과 심장근은 필요한 샘플양 만큼 상온에서 해동시켜 DNeasy Blood & Tissue Kit (QIAGEN)를 이용하여 DNA를 분리하였다. 분리된 DNA는 텔로미어 길이를 분석하기 위해 O’Callaghan et al. [25]의 논문을 참고하여 quantitative realtime polymerase chain reaction (RT-PCR)의 방법으로 실시하였으며, Primer와 샘플 및 PCR buffer에 사용되는 모든 희석용액은 RNase-free water를 사용하여 실험의 정확성을 높였다. 사용된 PCR primer는 Table 1과 같다.
샘플에 들어있는 DNA의 전체 개수를 확인하기 위하여 36B4 (Single copy gene)의 forward, reverse primer를 사용하였으며, 샘플의 텔로미어 길이는 forward, reverse의 텔로미어 primer를 사용하였다. 384-Well Clear Optical Reaction Plate (Applied Biosystems, foster city, CA)를 사용하여 한 well안에는 Table 2와 같이 분주하였다.
분주 된 384-Well은 7900HT Sequence Detection System (Applied Biosystems, foster city, CA)을 이용하여 결과를 얻었으며, 텔로미어와 36B4를 분석하기 위한 프로토콜로는 95℃에서 10분간 전처리 과정 후 95℃에서 15초, 60℃에서 1분을 40 cycle 실시하였다. 이때 나오는 텔로미어와 36B4의 ct (cycle threshold)값을 이용하여 텔로미어 길이와 Single copy gene의 비율(T/S 비율, [2Ct (텔로미어)/2ct (36B4)]-1=2-△ct)로 각 샘플의 텔로미어 길이를 나타낸 후 상대적인 텔로미어 길이(2-(△ct1-△ct2) =2-△△ct)를 산출하였다.
3. 자료처리방법
실험을 통해서 얻어진 결과는 SPSS/PC+Version 18.0 통계 프로그램을 이용하여 평균과 표준편차(Mean±SD)를 산출하였다. 집단 간 차이를 검증하기 위해 일원변량분석(one-way ANOVA)을 실시하였으며, 사후 검정은 Tukey HSD 검정방법을 사용하였다. 모든 검증의 통계적 유의수준은 α=.05로 설정하였다.
연구결과
1. 집단 간 어미 쥐의 텔로미어 길이
1) 골격근의 텔로미어 길어
어미 쥐의 골격근에서 각 집단의 텔로미어 길이를 분석한 결과 CON 집단에 비해 ExD 집단(p =.012, 185%)과 ExBD 집단(p =.049, 210%)의 텔로미어 길이가 짧았다(Fig. 2).
Maternal telomere length (T/S ratio) of skeletal muscle of each group. CON, control; ExD, exercise during pregnancy; ExBD, exercise before and during pregnancy; T/S, telomere length/Single copy gene. *p<.01, significantly difference from control group, † p<.05; significantly difference from control group.
2) 심장근의 텔로미어 길이
어미 쥐의 심장근에서 각 집단의 텔로미어 길이를 분석한 결과 CON 집단에 비해 ExD 집단(p =.024, 171%)의 텔로미어 길이가 짧았다(Fig. 3).
2. 집단 간 새끼 쥐의 텔로미어 길이
1) 골격근의 텔로미어 길이
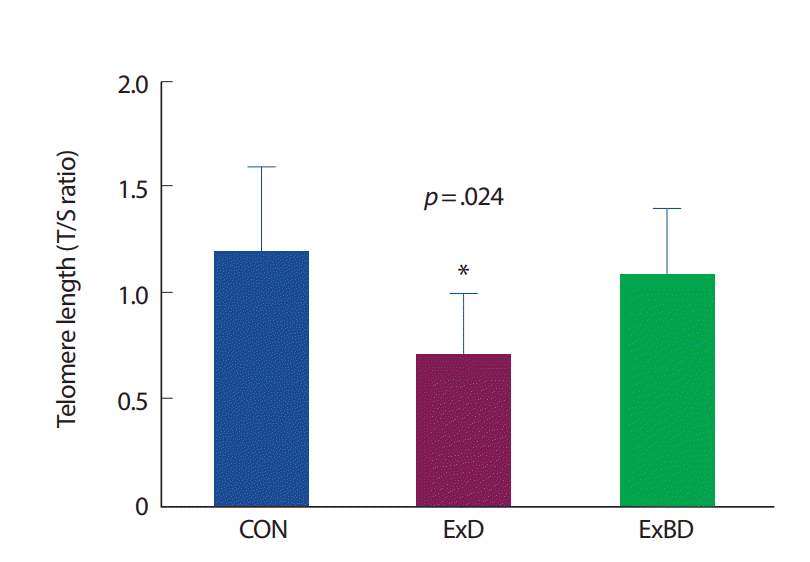
새끼 쥐의 골격근에서 각 집단의 텔로미어 길이를 분석한 결과 CON 집단에 비해 ExD 집단(p =.011, 160%)과 ExBD 집단(p =.049, 117%)의 텔로미어 길이가 짧았다(Fig. 4).
2) 심장근의 텔로미어 길이
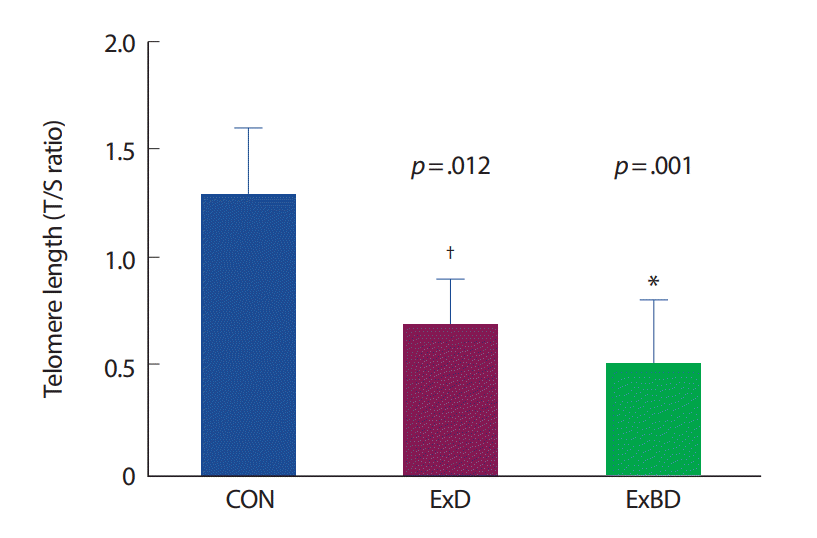
새끼 쥐의 심장근에서 각 집단의 텔로미어 길이를 분석한 결과 CON 집단에 비해 ExD 집단(p =.001, 150%)의 텔로미어 길이가 짧았다(Fig. 5).
3. 집단 간 새끼 쥐의 TRF2 발현
1) 골격근의 TRF2 발현
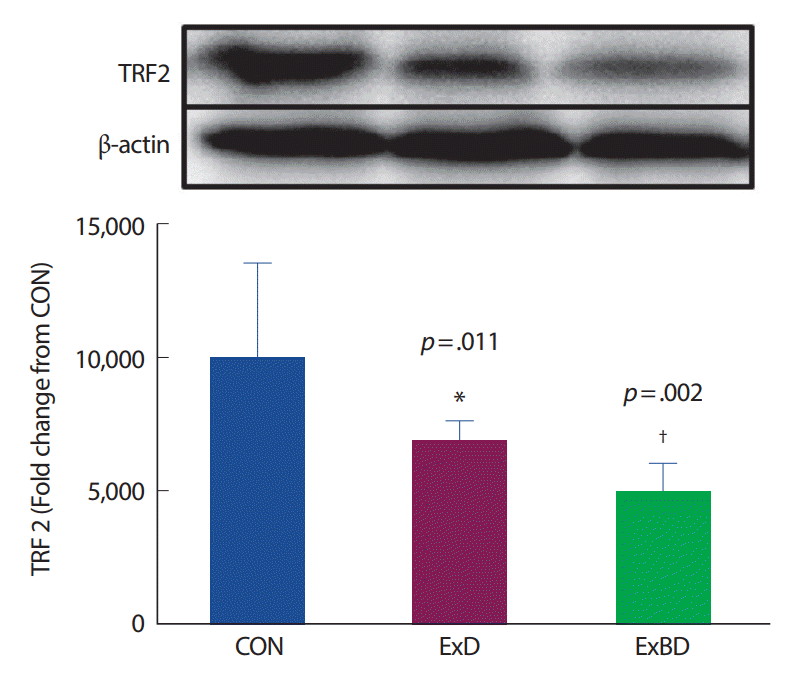
새끼 쥐의 골격근에서 각 집단의 텔로미어 조절 단백질(TRF2) 발현을 분석한 결과 CON 집단에 비해 ExD 집단(p =.011, 160%)과 ExBD 집단(p =.002, 190%)의 TRF2 발현이 적었다(Fig. 6).
논 의
이 연구의 주요 결과는 어미 쥐와 새끼 쥐의 골격근 텔로미어 길이가 대조그룹에 비해 운동을 실시한 두 집단이 유의하게 짧았으며, 새끼 쥐의 골격근 TRF2 발현량 역시 대조 집단에 비해 수태 전, 수태 전·중 유산소 운동을 수행한 집단이 낮았다. 심장근의 텔로미어 길이는 어미와 새끼 쥐 모두 수태 중 운동 집단이 유의하게 짧았지만 TRF2의 발현량에는 차이가 없었다. 이 결과들은 모체운동이 자식에게 텔로미어에 긍정적인 효과가 있을 것이라는 가설을 부정하는 것으로 모체운동이 태어날 자녀의 텔로미어 길이에 부정적인 영향이 있음을 확인하였다.
텔로미어가 노화를 예측할 수 있는 중요한 유전자 지표 중 하나로 밝혀지면서 텔로미어에 영향을 미칠 수 있는 외적인 요인에 관한 연구들이 보고되어 왔다. 선행연구들은 정신적인 스트레스[14,26], 흡연[15,27], 만성적인 산화스트레스[16,28], 음주[29] 등이 텔로미어에 부정적인 영향을 줄 수 있음을 증명하였다. 반면, 레저 스포츠, 수영, 자발적인 휠 운동 등 운동과 관련된 선행연구들만이 텔로미어 길이의 감소율을 줄일 수 있다는 긍정적인 가능성을 제시해왔다[18,19,30].
그러나 Rae et al. [31]의 연구는 지구성 운동선수 집단과 일반인 집단 간의 골격근 텔로미어 길이를 비교한 결과 두 집단 간 텔로미어 길이에는 차이가 없었으나 총 훈련시간이 긴 지구성 운동선수일수록 텔로미어의 길이가 더 짧은 것을 보고하였다. Kadi et al. [32]은 역도선수들의 골격근 텔로미어의 길이와 repeated maximum 스쿼트 무게가 부적인 상관관계가 있음을 밝혔다. 운동으로 인한 에너지 소비율과 백혈구의 텔로미어 길이 간의 관계를 연구한 Ludlow et al. [23]의 연구에서도 평상시 에너지 소비량이 많은 집단의 텔로미어 길이가 중간 정도의 에너지 소비 집단보다 짧았다고 하였다. 이러한 선행연구 결과들은 운동 강도가 높을수록 텔로미어 길이에 부정적인 영향을 미칠 수 있음을 시사한다. 따라서 본 연구의 운동집단이 수행한 주 5회, 1시간의 60%VO2max 유산소 운동 훈련이 일반적인 10주령 쥐의 경우 중강도로 간주되지만 수태 중인 어미 쥐에게 고강도의 운동으로 작용되어 골격근의 텔로미어 길이에 부정적인 영향을 미친 것으로 생각된다.
이 연구에서 운동집단의 텔로미어 조절단백질이 텔로미어 길이와 동일한 경향으로 나타난 이유는 과다한 운동량으로 인한 피로누적과 장시간 운동으로 생성된 많은 양의 활성산소가 새끼 쥐에게 부정적인 영향을 미친 것으로 추측된다. 선행 연구에 의하면 레저 스포츠나 자발적인 운동과 같이 운동 수행자가 즐길 수 있는 강도의 신체활동 시 텔로미어에 긍정적인 영향이 나타났지만 과도한 훈련과 부족한 휴식등으로 발병하는 만성적인 근육통 증후군(FAMS)에 시달리는 운동선수일수록 건강한 운동선수에 비해 골격근의 텔로미어 길이가 짧았다[33]. 적절한 운동 처치는 항산화 효소를 활성시켜 활성산소로 인한 손상으로부터 인체를 보호하며[34,35], 텔로미어 길이의 감소율도 낮추게 되지만, 격렬한 운동은 조직의 산소필요량이 증가하게 되고 그 부산물로 많은 활성산소를 생성하게 되어 텔로미어의 길이를 감소시킨다[31]. 뿐만 아니라 단기간·고강도 운동에 의한 산화적인 스트레스는 세포의 항산화 방어체계를 초과하게 됨으로써 텔로미어 길이 감소에 영향을 미칠 수 있다[18,36]. 이 연구에서 ExBD 집단은 ExD 집단에 비해 유의한 차이는 아니었지만 텔로미어 감소율이 적었다. 항산화 효소를 직접 분석하지 못한 것은 이 연구결과의 제한점이지만, 수태 전 지속적으로 수행된 운동은 Mena et al. [37]의 연구결과와 같이 수태 중 운동 자극에도 superoxidative dismutase 등의 항산화 효소 발현을 증가시켜 산화적인 손상으로부터 텔로미어 길이 감소를 줄일 수 있었던 것으로 추측된다. 따라서 이 연구에서 수태 쥐를 대상으로 수행된 과다한 운동량과 운동강도는 활성산소의 생성을 증가시켜 CON 집단에 비해 ExD, ExBD 집단의 텔로미어 길이가 짧았으나 ExBD 집단은 수태 전 지속적인 운동훈련의 효과로 체내의 항산화 방어기전이 향상되어 ExD 집단에 비해 텔로미어 감소율이 적었던 것으로 사료된다.
결 론
이상의 결과들은 수태 중 모체운동이 태어난 새끼 쥐의 골격근 및 심장근의 텔로미어 길이와 텔로미어 조절 단백질(TRF2) 발현에 부정적인 영향이 있음을 시사하고 있다. 텔로미어의 길이는 운동이나 스트레스에 의해 민감하게 반응하는 지표로 수태 쥐에게 강제성이 부여된 트레드밀 운동이 아닌 스스로 자발적인 휠 운동에 의한 영향을 확인하는 추가적인 연구가 필요할 것으로 사료된다.