단기간의 지구성 운동 또는 리튬 처치가 고지방식 유도 비만쥐의 대사증후군에 미치는 영향
Effects of Lithium Chloride and/or Endurance Exercise Treatment on the Metabolic Syndrome of High Fat Induced Obese Rats During 4 Weeks
Article information
Trans Abstract
PURPOSE
Investigate the effects of lithium chloride and/or endurance exercise on metabolic syndrome in high fat-induced obese rats.
METHODS
10-week-old male Sprague Dawley rats (n=45) were subjected to a high-fat diet for 8 weeks followed by lithium (2 mg/kg Lithium chloride) and/or endurance exercise (40% VO2max, 12 m/min, slop 0%, 3 d/week) for 4 weeks.
RESULTS
Lithium and endurance exercise improved blood glucose and insulin response in the oral glucose tolerance test compared to the FC group, but there was no additional effect according to the combined treatment. Serum levels of AST and ALT and urinary components were similar to those of CC group.
CONCLUSIONS
The short-term lithium or exercise treatment significantly improved metabolic syndrome in high fat diet induced obese rats and did not show any blood or urinary toxicity, but there was no additive effect on metabolic syndrome of combined treatments.
서 론
당뇨병(Diabetes mellitus, DM)은 대사질환으로 장기간 높은 혈당 수치를 보이는 것이 특징이며, 방치하면 케톤 산증 또는 비케톤성 혼수와 같은 급성 합병증은 물론이고 심혈관 질환, 뇌졸중, 만성 신부전, 족부 궤양 및 눈의 손상과 같은 심각한 만성 합병증을 발생시킨다[1,2]. 이러한 당뇨 합병증을 예방할 수 있는 최선의 방법은 혈당 수준을 안정적으로 유지하는 것이다. 그러나 우리나라 당뇨병환자 중 혈당을 목표 혈당(HbA1c<6.5%)수준으로 잘 조절하고 있는 환자는 30% 미만으로 환자들의 혈당조절 상태는 매우 불량하며, 이는 당뇨환자 4명 중 3명(75%)이 과체중이거나 비만함에도 불구하고 식이요법과 운동요법과 같은 근본적인 조절방법에 소홀하기 때문이다[3]. 인체는 인슐린 또는 근수축/운동 자극을 통해 골격근내로 포도당을 이동시키는데, 이들 두 신호는 서로 다른 경로를 이용한다[4,5]. 아직 근수축 자극에 의한 포도당 이동 기전에 대해 완전히 이해되고 있지는 않으나, 세포내 에너지 상태의 변화(AMP:ATP 비율의 증가)나 세포내 Ca2+수준의 증가, protein kinase C (PKC)의 활성도 증가 등과 같은 다변적 요소를 통해 세포내 신호전달기전을 활성화시켜 GLUT4를 세포막으로 전위시 킴으로 세포내로의 포도당 이동을 증가시키는 것으로 보고되고 있다[6,7]. 비만의 경우 인슐린 신호전달체계에는 결함이 발생하나 근수축 자극 신호전달체계에 의한 포도당 이동기전은 정상적으로 작용하므로 당뇨병 환자들에 있어 규칙적인 신체활동이 강조된다[8,9]. 이에 다양한 매체와 교육을 통해 운동 요법을 권장하고 있으나 한국 성인의 운동 참여율이 높지 않고, 비만인의 경우 그 참여율이 더욱 낮다는 점을 고려한다면 당뇨병 치료와 합병증 예방을 위한 현실적이고 효과적인 방법이 반드시 모색되어야 한다.
리튬(Lithium, Li)은 19세기 중반 리튬염의 형태로 편두통 예방과 정신질환, 통풍, 호중구감소증(neutropenia)의 치료제로 처음 소개되어 연구 개발되었으며, 현재는 조병(mania), 우울증, 양극성장애 치료제로 사용되고 있다[10-12]. 이외에도 리튬은 인슐린과 유사한 효과를 나타내는 것으로 보고된 바 있는데[13-16], 쥐의 간세포에서 글리코겐 합성을 자극하고[14,16] 적출된 쥐의 횡격막[13]과 지방세포[11,12], 근육[17]에서 포도당 섭취와 글리코겐 축적을 증가시키는 것으로 보고되었다. 이는 리튬이 GSK-3β (glycogen synthase kinase)의 인산화와 p38MAPK(mitogen-activated protein kinase)의 활성을 증가시킴으로 글리코겐 합성과 골격근의 포도당 섭취를 증가시키기 때문인 것으로 알려져 있다[17,18]. 그러나 이와는 상이한 결과를 보고한 연구도 다수 있어[19-23] 아직 기전적 규명은 이루어지지 않고 있다. 이에 본 연구자는 리튬의 포도당 이동자극 기전을 규명하기 위해 골격근을 적출하여 리튬 및 인슐린, 근수축 자극에 의한 glucose analog (2-deoxy-D-glucose; 2DG)의 조직내 이동률을 측정하고, photolableing 방식을 이용하여 자극에 따른 근초막내 GLUT4 농도를 비교 분석하였다. 연구결과 리튬 유도 골격근의 포도당 섭취 증가는 GLUT4의 세포내 회귀 감소에 의한 세포막내 GLUT4 수준 증가 때문으로 나타났다. 그러나 리튬은 그 자체로 GLUT4의 활성(activation)을 증가시키지는 못하므로, GLUT4를 활성(activation)시키는 인슐린 또는 근수축에 비해 세포막내 GLUT4의 수준이 폭발적으로 증가하여도 조직내 포도당 이동률이 낮았다. 이에 리튬을 1시간 동안 전처리한 후 단시간의 저농도 인슐린 또는 강축을 병행하여 처리한 결과 포도당 이동률이 리튬 단독처치에 비해 약 4배, 장시간의 인슐린 또는 강축 자극에 비해서는 약 2배 증가한 것으로 나타났다[24]. 요약하면 리튬과 근수축 또는 인슐린 병행처치가 조직내 포도당 이동률에 미치는 영향에 대해서는 in vitro상에서 다수 검증되었으나 in vivo 연구 결과의 부족으로 임상적 적용에는 한계가 있다.
이에 본 연구자는 선행연구의 결과를 바탕으로 in vivo상에서 리튬과 지구성 운동 처치가 인슐린 저항성을 가진 개체의 신체 조성 및 혈당에 미치는 영향을 규명함으로 임상 적용의 가능성을 높여 운동이 불가능하거나 의지가 없는 성인성 당뇨병 환자들의 인슐린 저항성의 개선에 대안을 제시하고자 한다.
연구 방법
1. 연구 대상
10주령의 수컷 Sprague-Dawley rat 45마리를 구입하여 1주간의 환경적응 기간을 가진 후 8주간 일반식(n =5, Chow-control group, CC) 또는 고지방식(n = 40)을 실시하였다. 고지방식은 총 열량에 대해 carbohydrate 42.7%, fat 42%, protein 15.2%가 되도록 하고(#TD.88137, Harlan Telkad, Madison, WI, USA), 일반식은 carbohydrate 67%, fat 13%, protein 20%가 되도록 하여 제공하였다(#2014, Harlan Telkad, Madison, WI, USA). 8주간의 비만 유도기 이후 고지방식 집단은 다시 4집단(FatControl group, FC; Lithium group, Li; Exercise group, Ex; Lithium+ Exercise group, LEx; 각 10마리)으로 무선 배정하여 총 4주간 고지방식을 유지하면서 리튬 또는 운동 처치를 실시하였다. 사료와 물은 자유롭게 섭취하도록 하고, 체중과 사료 섭취량은 격일로 동일 시간대에 측정하였다. 쥐는 한 케이지(20.7×35×17 cm)에 2마리씩 넣어 사육하였고, 사육실 온도는 21°C, 명기와 암기를 각각 12시간으로 조절하였다.
2. 연구절차
1) 리튬 처치
리튬 처치 집단은 1 mL saline에 2 mg/kg LiCl (Lithium chloride, L4408, Sigma-Aldrich)를 용해시켜 1일 1회 오전 9-10시에 경구투여하였다. 복합처치 집단은 운동 실시전 경구투여하였고, 투여량은 Harvey et al. [25]의 연구결과와 선행연구의 결과를 바탕으로 일부 수정하여 설정하였다[26,27]. 나머지 집단은 경구투여에 대한 스트레스를 동일하게 주기 위해 동일한 양의 saline을 경구투여하였다.
2) 운동처치
지구성 운동은 전동식 실험동물용 트레드밀(Quinton Instrument, Seattle, WA)을 이용하여 실시하였다. 운동자극을 최소화하기 위하여 운동 강도 설정은 Koltai et al. [28]과 Tang et al. [29]의 연구결과를 바탕으로 혈중 젖산이 축적되지 않는 저강도(40% VO2max, 12 m/min, slop 0%)로 주당 3일, 1일 20분 걷기를 실시하였다. 운동 적응은 초기 1주일간 점증적으로 실시되었다. 1일차는 7 m/min (slop 0%) 속도로 5분간 트레드밀 걷기를 실시하였고, 2일차는 10 m/min (slop 0%) 속도로 10분간, 마지막 3일차는 목표 운동 강도(12 m/min, slop 0%)에서 20분간 실시하였다.
3) 경구당부하검사(oral glucose tolerance test, OGTT)
총 4주간의 처치 후 전신의 인슐린 감수성을 측정하기 위해 경구당부하검사를 실시하였다. 12시간 동안 금식하고 꼬리를 통해 안정 시 혈액을 채취한 후 체중당 1 g의 50% 포도당 용액을 경구투여하였다. 이후 30, 60, 120분에 꼬리로부터 400 μL의 혈액을 채취하고, 항응고 처리(4 μL 헤파린)하여 원심분리 후(1,500 g, 15분) 혈장만을 추출하여 분석 전까지 -80°C에서 보관하였다. 혈액 채취가 끝난 쥐들은 소실된 혈장을 보충시키기 위해 0.9% saline 용액(2.5 mL)을 피하에 주입하였다. 이후 3일간의 회복기를 가진 다음 마취하여 조직을 적출하였다[30].
4) 조직, 혈액 및 요 채취
4주간의 처치 종료 후 48시간 동안 휴식을 취한 후 12시간 동안 금식을 실시하고 ketamine (80 mg/kg)과 xylazine (12 mg/kg)으로 마취하여 조직 및 혈액, 요를 채취하였다. 적출된 조직은 clamp frozen하여 분석 전까지 -80°C에서 보관하였다. 조직적출 후 복강을 열어 방광에서 직접 요를 채취하여 요검사용 Multistix 10SG 시험지(Bayer Corp., Elkhart, IN, USA)를 이용하여 요당(glucose), 빌리루빈(bilirubin), 케톤체(ketone body), pH, 단백질(protein), 유로빌리노겐(urobilinogen) 및 백혈구(leukocyte)에 관하여 검사하였다. 복부동맥에서 혈액 5 mL를 채취하고 응고 방지를 위해 50 μL의 헤파린으로 항응고처리한 후 분석 전까지 -80°C에서 보관하였다. 혈액 채취 후 visceral fat pads (epididymal, mesenteric, retroperitoneal fat pad)를 적출하여 무게를 측정하였다[31].
5) 분석
혈당은 자동 혈당분석기(YSI 2300, Springfield, USA)를 이용하였고, 혈장 인슐린은 rat insulin ELISA kit (Mercodia, Uppsala, Sweden)를, 혈장 aspartate aminotransferase (AST)와 alanine aminotransferase (ALT) 농도는 ELISA kit (Cayman tech., USA)를 이용하여 측정하였다.
3. 자료처리방법
각 측정항목에 대한 결과는 평균과 표준오차(Mean±SE)로 산출하고, 통계적 분석은 SigmaPlot 12.0 통계패키지를 이용하였다. 집단 간 차이를 검증하기 위해 일원분산분석(one-way ANOVA)을 실시하고, 경구당부하검사의 결과는 집단 및 시기 간 상호작용을 분석하기 위하여 이원반복분산분석(two-way repeated measures ANOVA)을 실시하였으며, 사후검정은 Tukey법을 이용하였다. 통계적 유의수준은 α=.05로 하였다.
연구 결과
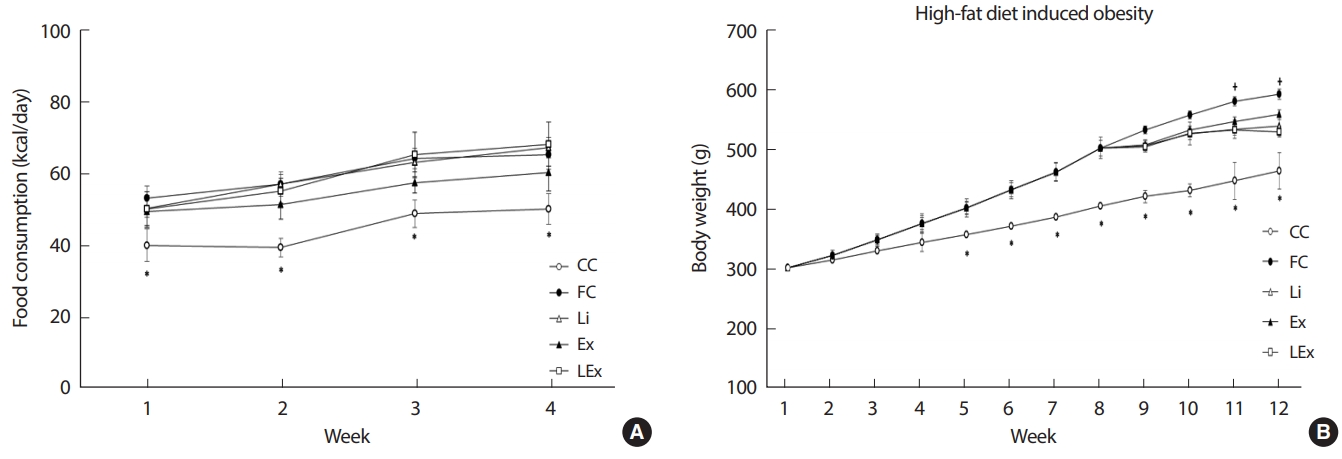
1. 식이섭취량과 체중
4주간의 리튬 또는 지구성 운동 처치 동안 실험 동물들의 1일 섭취 열량은 점진적으로 증가하는 경향을 보였고, 일반식이 집단을 제외한 고지방식 집단 내에서는 유의한 차이가 나타나지 않았다(Fig. 1A). 실험 동물들의 체중은 8주간의 비만유도기 동안 일반 식이집단에 비해 4집단의 체중이 점진적으로 증가하여 4주차 이후부터는 일반식이 집단에 비해 유의하게 증가된 체중을 보였다(p< .05). 이를 통해 본 연구에 사용된 고지방식을 이용한 비만유도 방식이 적절하였음을 알 수 있다. 8주간의 비만 유도기 이후 4주간의 처치 동안 FC집단에 비해 나머지 3집단의 체중증가 폭이 낮았으나(p< .05), 3집단 간의 유의한 차이는 나타나지 않았다(Fig. 1B).
2. 복강내 지방량
복강내 총지방량은 CC집단에 비해 고지방식을 섭취한 집단에서 유의하게 증가하였고, 고지방식 처치 집단 중 Li, Ex, LEx집단의 복강내 지방량이 FC집단에 비해 유의하게 감소하였다(p< .05, Fig. 2).
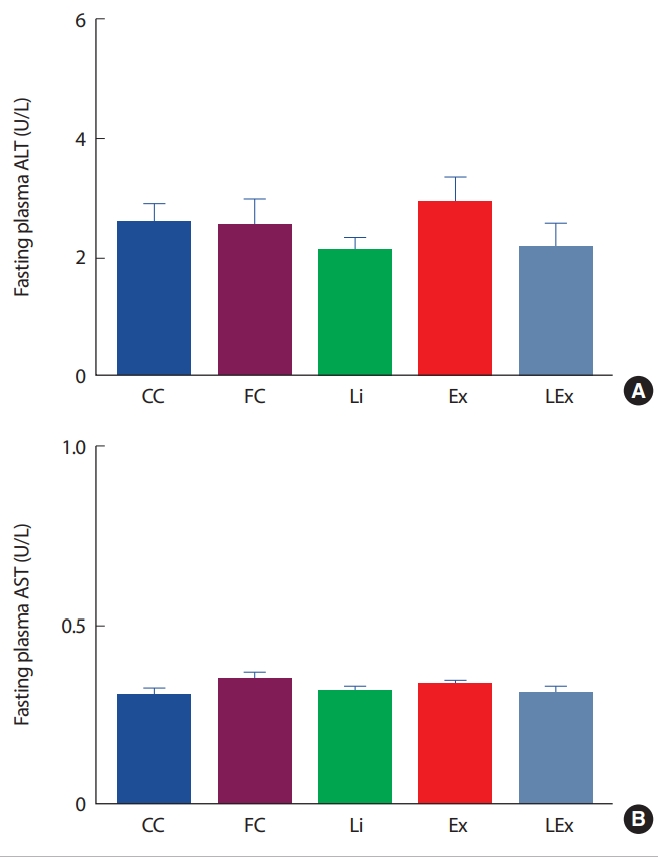
3. 독성 검사
1) 소변
리튬 사용에 따른 독성 유무를 판단하기 위해 소변진단 스틱을 이용하여 소변 내 인자들의 변화를 측정하였다. 진단기준은 2010년 한국 실험동물학회에서 제시한 기준(Urobilinogen 0.1 EU/dL, Billirubin negaqtive, Ketone body negative-5 mg/dL, Protein <100 mg/dL, Leucocyte small-moderate)을 사용하였다[32]. 측정결과 요 내 Urobilinogen, Biliruin, Leukocyte 수준은 모두 정상범위였고 집단 간 차이도 나타나지 않았다. 그러나 Ketone body와 Protein수준은 FC집단이 다른 4집단에 비해 통계적으로 유의하게 높게 나타났다(p< .05)(Table 1).
4. OGTT
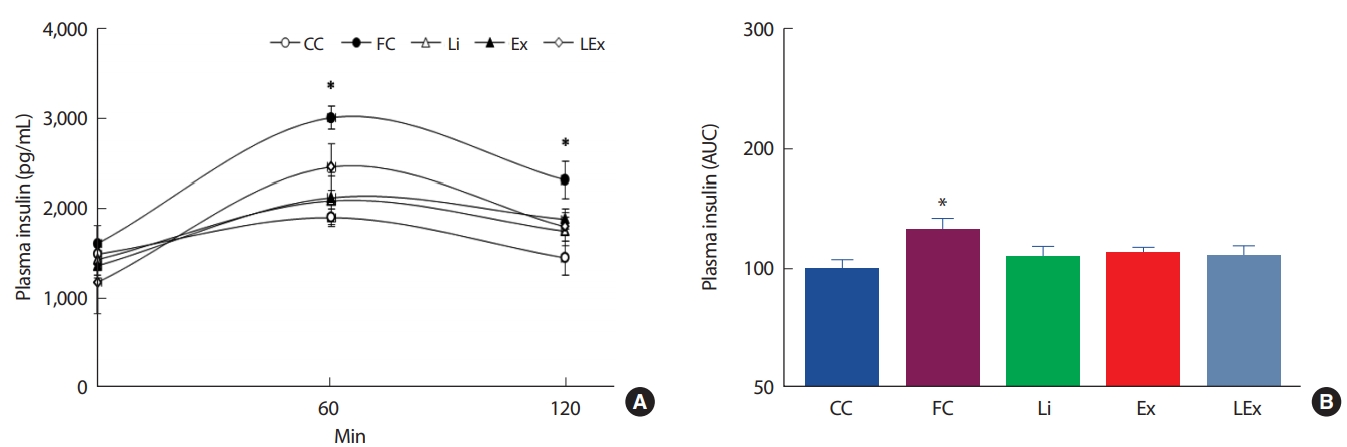
4주간의 리튬 또는 지구성 운동처치에 따른 인슐린 저항성의 변화를 평가하기 위해 경구당부하검사를 실시하였다. 측정결과 120분간 FC집단에 비해 Li, Ex, LEx집단의 포도당 제거력이 유의하게 높았고, 초기 30분의 Ex, LEx집단의 포도당 제거력은 CC집단과 유사하였다(Fig. 4A). 처치에 따른 120분간의 포도당 제거력을 그래프 면적을 계산하여 알아본 결과 FC집단을 제외한 3집단의 면적이 CC집단 수준으로 감소된 것으로 나타났다(Fig. 4B). 한편 OGTT 시 혈당 조절을 위해 사용된 인슐린 수준을 평가하기 위해 혈장을 이용하여 인슐린 농도를 측정하였다. 측정 결과 초기 60분에서 Ex, Li집단의 인슐린 농도가 FC, LEx집단에 비해 유의하게 낮았고(Fig. 5A), 120분간의 총 인슐린 면적은 FC집단에 비해 3집단이 유의하게 낮았으며, 이는 CC집단과 유사한 수준이었다(Fig. 5B).
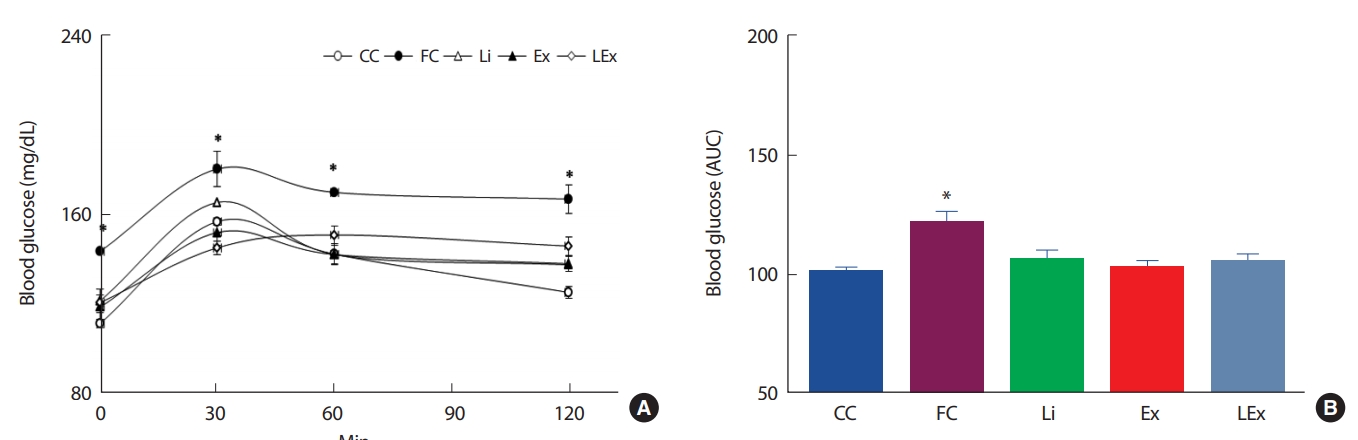
The change of blood glucose level (A) and area under the curve (B) during OGTT. *; Significanlty different from other 4 groups (p<.05)
논 의
본 연구는 리튬의 인슐린 저항성을 가진 개체를 대상으로 단기간의 리튬 또는 지구성 운동 병행처치가 혈당 조절에 미치는 영향을 관찰하였다. 이를 위해 8주간의 고지방식으로 비만을 유도하였는데, 비만에 의한 성인성 당뇨병 환자들의 인슐린 저항성은 인슐린 신호전달 체계의 결함을 통한 GLUT4의 전위 감소에 의해 발생하기 때문에[33,34], 리튬 처치를 통해 세포막내 GLUT4 수준이 증가된다면 적은 양의 인슐린 또는 가벼운 신체활동으로도 혈당의 조절에 부가적 효과가 발생할 것으로 예측하였다. 연구결과 4주간의 리튬 처치는 경구혈당검사시 120분간 FC집단에 비해 Li, Ex, LEx집단의 포도당 제거력이 유의하게 높았고, 초기 30분의 Ex, LEx집단의 포도당 제거력은 CC집단과 유사하였다. 또한 인슐린 농도에 있어서도 초기 60분에서 Ex, Li집단이 FC, LEx집단에 비해 유의하게 낮았고, 120분간 분비된 인슐린은 FC집단에 비해 3집단이 유의하게 낮았으며, 이는 CC집단과 유사한 수준이었다. 요약하면 4주간의 리튬 처치는 경구혈당검사 시 혈당과 인슐린 수준을 일반식이 대조군과 유사한 수준으로 감소시켰고, 시간대별 포도당 제거력도 리튬을 처치하지 않은 고지방식 대조군보다 유의하게 높았다. 그러나 리튬과 지구성 운동 복합처치에 따른 상승작용은 나타나지 않았다. 이러한 결과는 in vitro 상에서 이루어진 선행연구의 결과와는 상이한 것으로 본 연구에서 도출된 결과만으로는 원인을 규명할 수는 없으나, 우선 추론해 볼 수 있는 점은 신체조성의 변화와 실험 동물의 연령대이다. 본 연구에서는 8주간 고지방식(40% kcal from fat) 사료를 사용하여 8주간 비만을 유도하였고, CC에 비해 체중과 체지방, 혈당이 유의하게 증가한 것을 확인하였다. 그러나 FC집단에 비해 Li 또는 Ex, LEx집단의 체중 증가폭이 유의하게 낮았고, Li, Ex, LEx집단 간의 유의미한 체중 차이는 없었다. 복강내 지방량도 3집단 간 통계적 유의차가 나타나지 않았다. 2형 당뇨병의 경우 복강내 지방량과 혈당 제거력은 높은 상관성을 가지고 있어[35-38] 3집단의 OGTT결과에 유의차가 나타나지 않은 것을 설명할 수 있는 부분으로 생각된다. 리튬 처치에 따른 체지방 또는 체중 감소에 대해서는 아직 일관된 결과가 도출되지 않고 있는데, Voss & Schober [39]는 6주간 리튬(0.55 g lithium carbonate/kg dry food)을 쥐를 대상으로 섭취시킨 결과 체지방량이 유의하게 감소한 것으로 보고하였고, Colt et al. [40]도 양극성 장애를 가진 환자들을 대상으로 리튬 처치 전과 17일간의 처치 중, 후의 신체조성을 평가한 결과 처치 중 체중이 유의하게 감소하였으나 처치 이 후 다시 체중이 증가한 것으로 보고하였다. 그러나 이와는 상이하게 Grandjean & Aubry [41]는 리튬 복용환자 중 약 30%가 체중이 증가한 것으로 보고하였다. 또한 발생 원인에 있어서도 리튬이 랩틴 수준에 영향을 미쳤을 것으로 보고한 연구 이외에는 알려진 원인 인자들이 드물다[42]. 이와 같이 리튬 섭취에 따른 체중 또는 체지방의 변화에 대해 원인이 규명되지 않고 있어 본 연구의 결과 또한 리튬 단독처치 집단의 체지방 감소의 원인을 단정 내릴 수는 없다. 또 한 가지 본 연구에서 복합처치에 따른 부가적인 효과가 나타나지 않은 이유로 고려해 볼 수 있는 것은 사용된 쥐의 연령대가 10주령으로 낮았다는 점이다. Dela et al. [43]에 의하면 노화함에 따라 전신의 인슐린 기능이 감소하며, 다리근육을 이용하여 insulin infusion 시 젊은 집단에서는 운동트레이닝 유무에 상관없이 leg blood flow에 변화가 없었으나, 노인집단에서는 운동트레이닝을 실시한 집단의 leg blood flow가 유의하게 증가한 것으로 보고하였다. Stephens & Tsintzas [44]도 1회성 운동 후 연령에 따른 인슐린 감수성의 변화를 관찰한 결과 노화함에 따라 지질 산화 감소, 지방 생성 증가 및 염증의 증가 현상이 나타나며, 특히 연령이 증가함에 따라 운동에 의한 지방분해 반응이 떨어짐으로 subsarcolemmal region내 지방축적이 증가하는 양상은 노화에 따른 인슐린 저 항성의 증가와 밀접한 관련이 있는 것으로 보고하였다. 본 연구에서 운동 또는 리튬 처치 집단의 혈당 조절력이 일반식이 집단 수준으로 낮아졌는데, 이는 정상수준으로 회복되었음을 뜻한다. 따라서 복합처치에 따른 부가적인 효과를 보기에는 어려움이 있었을 것으로 생각되며, 만약 노화된 쥐를 대상으로 연구가 실시되었다면 복합처치에 따른 부가적인 효과를 도출해 낼 수 있지 않았을까 추정해 본다. 그러나 이를 검증하기 위해서 추가적인 연구가 반드시 필요하다.
본 연구자는 리튬의 안정성을 평가하기 위해 식이 섭취량과 체중을 측정하여 비교하였으며, 간독성 표지인자 혈중 ALT, AST 수준과 요검사를 실시하였다. 연구결과 리튬처치에 따른 식이섭취량과 체중의 유의한 변화는 나타나지 않았으며, 혈중 ALT, AST 수준과 요 검사결과 정상수준으로 나타났다. 몇몇 선행연구에서는 리튬 사용 시 요의 농축기능 저하와 같은 신장의 기능 이상이 유발될 수 있는 것으로 보고되었다[45-47]. 그러나 이들과 상이하게 리튬이 사구체의 손상과 관련이 없음을 보고한 연구도 다수 있는데[48,49], Khandelwal et al. [50]은 리튬 복용에 따른 신장기능의 평가를 위해 좀 더 광범위하게 세뇨 관과 사구체의 기능을 모두 평가하였고, 연구결과 리튬 복용집단에서 신장의 요 농축기능과 함께 사구체 배출률에 유의한 변화가 나타나지 않은 것으로 보고하였다. 또한 성별에 따른 리튬의 혈중 creatinine 수준과 사구체의 기능에 미치는 영향을 관찰한 연구에서도 리튬 복용에 따른 유의한 변화가 나타나지 않은 것으로 보고하였다[51,52]. Aprahamian et al. [53]은 4년간 61명의 노인들을 대상으로 무작위로 리튬 또는 위약을 섭취시킨 후, 신장 기능을 평가한 결과 두 집단 간 신장기능의 차이가 나타나지 않았으며, 이외 다수의 연구에서도 동일한 결과를 보고한 바 있다[54,55].
본 연구의 결과를 요약하면 단기간의 리튬처치는 고지방식 유도 비만쥐의 혈당 제거력을 유의하게 개선시켰고, 혈액과 요내 독성도 나타나지 않았다. 그러나 연구의 가설과는 달리 리튬과 지구성 운동 복합 처치에 따른 부가적인 효과는 나타나지 않았다.
결 론
본 연구는 리튬과 지구성 운동의 혼합처치가 고지방식 비만쥐의 혈당 및 신체구성에 미치는 영향을 규명하고자 하였다. 연구결과 리튬 또는 지구성 운동은 비만쥐의 혈당 및 복강내 지방을 감소시켰으나, 혼합처치에 따른 부가적인 효과는 나타나지 않았다. 이러한 결과가 도출된 것에는 다양한 각도에서 원인을 찾아볼 수 있으나, 우선 본 연구에서 복강내 지방 감소의 정도가 단독처치집단과 복합처치집단이 유사하였다는 점이 혈당 수준에 영향을 미치지 않았나 추론해 볼 수 있으며, 4주라는 단기간의 연구에 따른 문제점도 고려해 볼 수 있다. 그나 본 연구의 결과만으로는 명확한 원인 규명이 어려우므로 추후 이러한 문제를 고려한 연구 설계를 도입하여 추가적인 실험이 필요하다고 생각한다.
Notes
논문 작성에 있어서 어떠한 조직으로부터 재정을 포함한 일체의 지원을 받지 않았으며, 논문에 영향을 미칠 수 있는 어떠한 관계도 없음을 밝힌다.