중강도 운동이 고지방식을 유도한 알츠하이머 치매 마우스의 시냅스 소포체 및 항산화 효소 발현에 미치는 영향
Effect of Moderate Intensity Exercise on Synaptic Vesicle Transporter and Antioxidant Enzyme Expression in High Fat Diet Fed 3xTg Mice
Article information
Trans Abstract
PURPOSE
The purpose of this study was to analyze the effects of aerobic exercise on the expression of synaptic vesicle transporter and antioxidant enzymes in obesity and to investigate the feasibility of exercise training to reduce AD pathogenesis in the 3xTg-AD mice fed a high fat diet.
METHODS
Male 3 month old 3xTg-AD mice were divided into standard chow(SC, n=10), standard chow+exercise (SC-EXE, n=10), high fat diet (HFD, n=10), and high fat diet+exercise (HFD-EXE, n=10) groups. EXE mice were subjected to treadmill running at a moderate intensity with duration of 30 minutes per day and frequency of 5 days per week for 12 weeks. HFD mice were fed a 60% fat HFD during the same period. Mice were sacrificed and immunohistology and western blot analysis were performed.
RESULTS
Compared with the SC mice, the HFD mice had significantly higher levels of Aβ (p<.01), p-tau/t-tau (p<.01) and defects of Vglut1 (p<.05), VGAT (p<.05), postsynaptic density 95 (p<.01) and GPX (p<.05) in the hippocampus. On the other hand, we found that treadmill running attenuated HFD-induced exacerbations of Aβ (p<.01), p-tau/t-tau (p<.05) and defects of Vglut1 (p<.01), Synaptophysin (p<.05), SOD1 (p<.05) in the hippocampus.
CONCLUSIONS
High fat diet-induced obesity resulted in increased AD neuropathology and decreased synaptic vesicle transporter and antioxidant enzyme in the hippocampus of 3xTg-AD mice. However, aerobic exercise delayed AD-like disease progression, alleviated impaired synaptic function and the decreased expression of antioxidant enzymes in the hippocampus.
서 론
알츠하이머 질환(Alzheimer’s disease, AD)은 노년기 발병하는 치매의 가장 흔한 형태이며 점진적인 인지기능 저하와 행동장애를 임상적 특징으로 하는 퇴행성 뇌질환이다. 인간의 기대 수명이 늘어나면서 노인인구에서 AD의 발병률이 증가하고 있는데 대규모 국내 역학조사에 따르면 65세 이상 치매 환자는 약 70만명으로 전체 노인인구의 10%로 추정되며 지속적으로 증가해 2050년에는 약 300만명을 넘어설 것으로 예상된다[1]. 노년층에서 나타나는 가장 흔한 질병임에도 AD는 유전적 인자와 환경적 인자가 결합되어 발병하는 다인자성 질환(Multifactorial Disorder)으로 정확한 원인을 알아내기 쉽진 않지만 그럼에도 불구하고 많은 연구를 통해 밝혀진 사실은 식습관의 서구화에 따른 비만과 이와 관련된 만성질환이 AD의 새로운 위험인자로 제시되고 있다[2,3].
비만은 고열량 혹은 지방함량이 높은 음식섭취가 주요한 원인으로 인슐린저항성과 대사장애를 유발시키며, 이는 뇌혈관 질환 발생과 무관하게 AD를 일으키는 주된 위험인자임이 보고되고 있다[4,5]. 이러한 근거를 뒷받침하는 메타 분석에서는 비만과 그로 인한 대사장애는 AD의 위험을 독립적으로 증가시켰으며[6], 신체질량지수(Body mass index, BMI)가 높을수록 AD 조기 발병의 위험이 높고 뇌 용적의 감소 및 AD 병리학적 진행이 가중된다는 사실을 확인하였다[7]. 이러한 결과는 마우스 모델을 이용한 실험연구에 의해 더욱 뒷받침되는데, Ho et al. [8]은 고지방식 섭취로 유발된 인슐린 저항성은 Aβ1-40과 Aβ1-42의 생성을 증가시켰으며, 이와 유시하게 Type I 당뇨 유도 후 Tau 과인산화 및 Aβ plaque 침착이 가중된다는 사실을 확인하였다[9]. 이는 뇌 세포의 인슐린 신호 전달경로(IRS1/2-PI3K-PKB/Akt)에 영향을 미치며, 결과적으로 GSK-3β의 활성을 증가시켜 Aβ 축적 및 Tau의 과인산화를 유도하는 것으로 나타나고 있다[10,11].
이처럼 인지기능을 담당하는 해마의 Aβ와 Tau 단백질의 과도한 축적은 신경세포 사이의 신호 전달이 일어나는 시냅스의 손상을 유발하는데 이는 시냅스 기능 실조, 시냅스 소포체 결함 및 신경전달 물질 기능 저하를 유발하는 것으로 관찰되었다[12-14]. 실제로 시냅스 및 수상돌기 가시(dendritic spine) 손실은 응집된 Aβ plaque에 근접하여 악화되는 것으로 나타났으며[15], 심각할 경우 학습과 기억을 비롯한 인지기능 장애에 영향을 미치는 것으로 보고되고 있다. 그 중 gamma-aminobutyric acid (GABA)와 glutamate는 중추신경계의 대표적인 신경전달물질로서 시냅스에서의 신경전달[16], 세포의 생존과 성장[17,18] 및 시냅스 장기강화(Long term potentiation) [19, 20] 등 뇌 기능에 중요한 역할을 하는 것으로 밝혀졌지만 선행연구에 따르면 고지방식으로 인한 비만 및 인슐린저항성은 신경전달물질이나 시냅스 소포체의 조절 장애를 유도하며[21,22] 이는 산화 스트레스를 유발하고 뇌 세포를 손상시켜 AD 발병에 주요 요인으로 보고되고 있다[23-25].
한편, 다양한 형태의 신체활동은 대사질환은 물론 학습과 기억 및 정보 통합에 중요한 역할을 담당하는 해마는 기억과 관련된 일련의 반응들을 조절하며, AD의 위험감소 및 병리학적 진행을 억제시키기 위한 접근 방법으로 많은 연구에서 제안되었다. 즉, 규칙적인 운동은 신경영양인자(Brain derived neurotrophic factor) [26]와 혈관내피성장인자(Vascular endothelial growth factor) [27] 및 인슐린 성장인자(Insulin like growth factor-1) [28)와 같은 시냅스 기능을 조절하는 여러 분자 매개체의 증가와 관련이 있으며[29], 또한 수상돌기 가시(dendritic spines)의 형성[30]과 해마의 신경세포 재생(neurogenesis) [31]을 포함한 뇌 구조 변화를 조절하는 것으로 나타났다. 이러한 변화는 항산화 효소의 활성을 유도하여 산화 스트레스로 인한 뇌 손상을 보호하고 시냅스 가소성과 장기강화 증가 및 학습과 기억형성에 중요한 기전으로 작용한다고 알려지고 있다.
따라서 본 연구에서는 AD의 주요한 발병원인 물질로 알려진 APPswe, PS1M146V, TauP301L의 3가지 유전자 변이를 포함한 triple transgenic (3xTg)-AD mouse를 이용하여 12주간 고지방식 처치가 AD의 병리학적 진행을 악화시키는지에 대해 시냅스 소포체 및 항산화 효소 발현 측면에서 검증하는 한편 이러한 병리학적 변화에 대한 운동이 미치는 효과를 검증하고자 한다.
연구 방법
1. 연구 대상
본 연구에서는 사용된 실험동물은 AD에 가장 적합한 동물 모델로서 알려지고 있는 3개월된 수컷 3xTg-AD 마우스 40마리를 사용하였다. 동물 사육실 온도는 21±1°C로 유지하였고, 명기와 암기는 각각 12시간으로 조절하였다. 본 연구는 AAALAC International (Association for Assessment and Accreditation of Laboratory Animal Care International) 인증기관인 S대학교 동물관리사용위원회(IACUC)의 검토와 승인을 거쳤으며, 실험동물의 관리와 사용에 관한 지침을 준수하며 시행하였다.
2. 연구절차
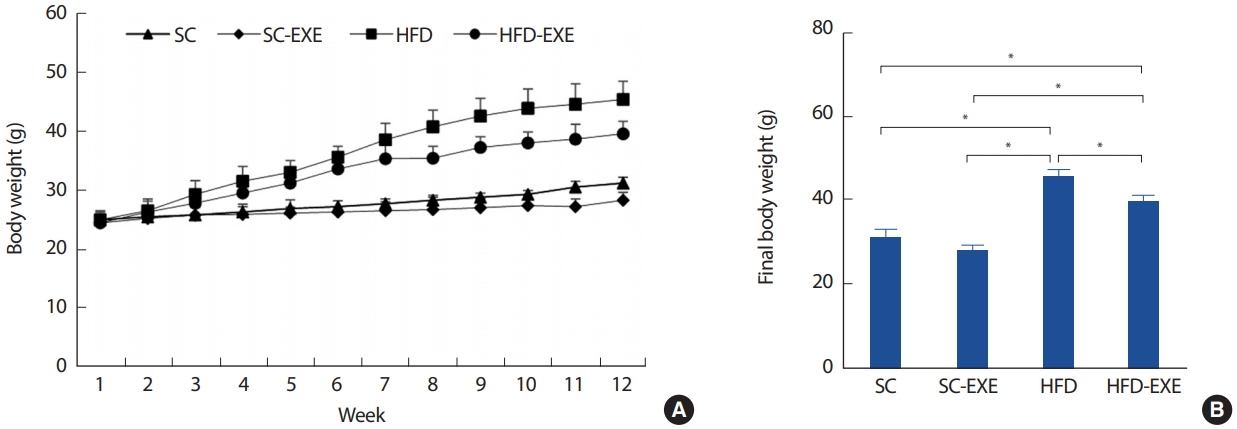
무작위로 총 40마리를 추출하여 정상식이를 섭취하는 집단(Standard chow, SC =10), 정상식이와 운동을 병행하는 집단(Standard chow plus exercise training, SC-EXE =10), 60% 지방이 함유된 고지방식이(High-fat diet, HFD;D12492, research Diet)를 섭취하는 집단(High-fat diet, HFD)과 고지방식이 섭취와 운동을 병행하는 집단(High-fat diet plus exercise training, HFD-EXE =10)으로 구분하였다. 식이와 운동은 동일하게 12주간 처치하도록 하였다(Fig. 1).
1) 운동처치
운동 처치는 이전의 Cho et al. [32]의 방법을 수정 보안하여 이용하였다. 마우스 트레드밀(Columbus Instruments, Inc., Columbus, OH)을 이용하여 총 12주간 주당 5회 총 30분간 중강도 운동 트레이닝을 실시하였으며(VO2max 40-55%), 사전 1주일 동안 적응을 위해 10 m/min 속도로 15분간 훈련을 실시하였다. 본 운동 시작 전과 후에는 각각 5 m/min 속도로 5분간 준비운동과 정리운동을 실시하였으며 본 운동은 13 m/min 속도로 20분간 실시하였다.
2) 뇌 적출 및 조직처리
실험동물들은 Zoletil 50Ⓡ(10 mg/kg)을 복강 내 주사를 통하여 마취시킨 후 흉강을 열고 좌심실을 통하여 50 mM 인산염 완충식염수(phosphate buffer saline, PBS)를 주입하였다. Immunohistochemisty를 위한 샘플은 100 mM 인산 완충액에 녹인 4% paraformaldehyde (PFA) 고정액을 관류하였다. 관류 고정 후 두개골을 제거한 뒤 뇌를 적출 한 다음 고정액에 담아서 4°C에서 12시간 후 고정을 실시하였다. 고정된 뇌 조직은 30% sucrose 용액 에서 3일간 침적시킨 후 Cryostat (Leica, Nussloch,Germany)를 이용하여 40 μm 두께로 절편 제작하였다. 또한, western blot을 수행하기 위한 샘플은 완충 식염수를 주입하여 혈액을 제거한 후 적출한 뇌를 분석 시까지 -80°C의 초저온 냉동기에 냉동 보관하였다.
3) Immunohistochemistry
실험방법은 이전의 Ziebell et al. [33]이 기술한 바와 같이 수행하였다. 먼저 절편 된 뇌 조직을 3% normal goat serum (Gibco, Grand Island, NY)으로 blocking 시킨 후에 1차 항체 mouse anti-Aβ (1:500, BioLegend)을 상온에서 2시간 동안 반응시켰다. 그 다음 2차 항체 anti-mouse에 상온에서 1시간 반응시킨 후 PBS에 3회 세척한 다음 Vector Elite ABC kit (Vector Laboratories, USA)을 이용하여 1시간 동안 실온에서 반응시켰다. 마지막으로 3,3′-diaminobenzidine tetrahydrochloride (DAB)을 사용하여 조직을 발색시킨 후 유리 슬라이드에 옮긴 후 커버를 덮은 뒤 광학현미경(Nikon, Tokyo,Japan)을 이용하여 분석하였다.
4) Western blot
실험방법은 이전의 Shin et al. [34]이 기술한 바와 같이 수행하였다. 먼저 뇌 조직에서 추출한 단백질 총량 10-15 μg을 이용하여 SDS-polyacrylamide gel에서 70 volt로 전기영동을 한 후 nitrocellulose membrane으로 120 volt로 90분간 전이시켰다. 전이가 끝난 Membrane을 5% skim milk용액으로 1시간 blocking시킨 후에 1차 항체인 rabbit anti-PhosphoTau (T231) (1:1,000; Abcam), mouse anti-Tau (Total Tau)(1:1,000; Cell Signaling), rabbit anti-Vglut1 (1:200; synaptic systems), rabbit anti-Vglut2 (1:200; synaptic systems), rabbit anti-VGAT (1:200; synaptic systems), rabbit anti- postsynaptic density 95 (1:200, cell signaling), mouse anti-synaptophysin (1:200, Millipore,), rabbit anti-SOD1 (1:1,000, Santa Cruz Biotechnology), rabbit anti-Glutathione Peroxidase (GPX)(1:1,000, Abcam), rabbit anti-Catalase (1:1,000, Abcam), rabbit anti-β-actin (1:1,000, Bethy)을 5% skim milk 용액에 각각 희석시켜 24시간 반응시켰다. 그 다음 TBS-T 용액으로 10분씩 3번 washing 후 2차 항체 horseradish peroxidase conjugated secondary antibodies를 이용하여 실온에서 90분간 반응시킨 후에 다시 Membrane을 TBST 용액에 넣고 10분씩 3번 washing 후 ECL로 1분간 발색시킨 뒤 얻어진 membrane을 이미지 분석 시스템 Image J (National Institutes of Health, Bethesda, MD)을 이용하여 단백질량을 분석하였다.
3. 자료처리방법
통계적 자료 분석을 위해서 SPSS version 18을 사용하였다. 네 집단 간의 차이는 일원분산분석법(One-way ANOVA)을 이용하였으며, 사후 검정은 LSD법을 이용하였으며 통계적 유의수준은 α=.05로 설정하였다.
연구 결과
1. 12주간 실험처치가 체중 변화에 미치는 영향
총 12주간의 실험처치에 따른 체중 변화를 관찰하기 위해 분석을 실시한 결과이다(Fig. 2). 그 결과, 모든 그룹에서 12주간 체중 증가가 나타났으며(Fig. 2A), 특히 SC그룹에 비해 HFD 그룹(p< .05)과 HFD-EXE 그룹에서(p< .05) 체중 증가가 유의하게 증가하는 것으로 나타난 반면 12 주간 트레드밀 운동을 실시한 HFD-EXE 그룹은 HFD 그룹에 비해 체중 증가가 유의하게 감소하는 것으로 나타났다(p< .05)(Fig. 2B).
2. 12주간 실험처치가 AD pathology 변화에 미치는 영향
총 12주간의 실험처치에 따른 해마의 Aβ 발현을 관찰하기 위해 Imuunohistochemistry 분석을 실시한 결과이다(Fig. 3A). 그 결과, SC그룹에 비해 12주간 트레드밀 운동을 실시한 SC-EXE 그룹은 유의한 차이는 나타나지 않았지만 Aβ의 발현이 감소하는 경향을 나타냈다. HFD 그룹은 SC그룹(p< .01)과 SC-EXE 그룹(p< .01)에 비해 Aβ의 발현 유의하게 증가하는 것으로 나타난 반면 12주간 트레드밀 운동을 실시한 HFD-EXE 그룹은 HFD 그룹에 비해 Aβ의 발현을 유의하게 감소시키는 것으로 나타났다(p< .01)(Fig. 3B). 또한, T-Tau와 P-Tau의 발현을 관찰하기 위해 western blot 분석을 실시한 결과(Fig. 3C), SC 그룹에 비해 12주간 트레드밀 운동을 실시한 SC-EXE 그룹은 P-Tau (p< .01)와 PTau/T-Tau (p< .01)의 발현이 유의하게 감소하는 것으로 나타났다. HFD 그룹은 SC 그룹에서 P-Tau/T-Tau (p< .01) 및 SC-EXE 그룹에서 P-Tau (p< .01), P-Tau/T-Tau (p< .01)의 발현이 유의하게 증가하는 것으로 나타난 반면 12주간 트레드밀 운동을 실시한 HFD-EXE 그룹은 T-Tau (p< .05), P-Tau/T-Tau (p< .05)의 발현이 유의하게 감소하는 것으로 나타났다(Fig. 3D-F).
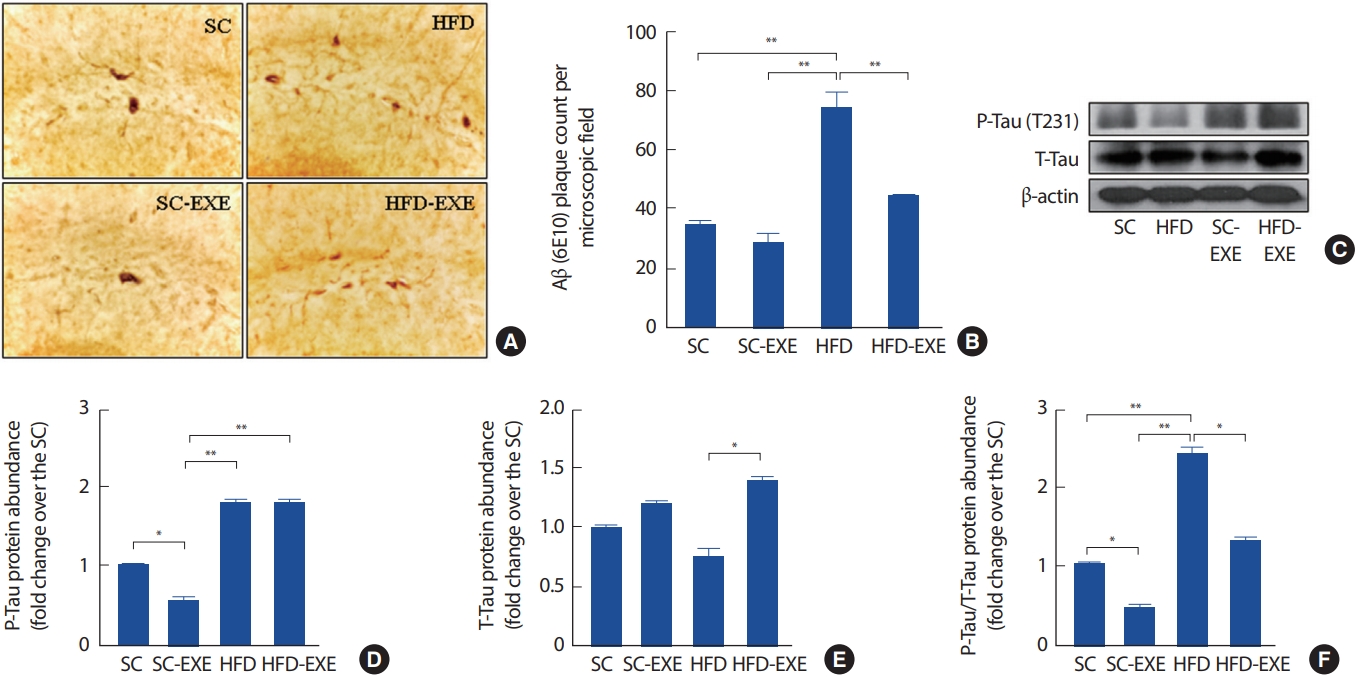
Effects of treadmill running on amyloid pathology in the hippocampus of HFD-induced 3xTg-AD mice (A). Representative microscopy of hippocampus for analysis of the presence of Aβ plaque. Quantification of Aβ plaque (B) stained cells (C). Representative western blots of p-Tau/T-tau and β-actin of hippocampus (D-F). Densitometric analysis of the western blot bands normalized to β-actin. Values are presented as mean±SD.
*p<.05 and **p<.01.
3. 12주간 실험처치가 Vglut1, Vglut2 및 VGAT 발현에 미치는 영향
총 12주간의 실험처치에 따른 해마의 Vglut1, Vglut2 및 VGAT 변화를 관찰하기 위해 western blot 분석을 실시한 결과이다(Fig. 4A). 그 결과, SC 그룹에 비해 12주간 트레드밀 운동을 실시한 SC-EXE 그룹은 Vglut2 (p< .01) 및 VGAT (p< .01)의 발현이 유의하게 증가하는 것으로 나타났다. HFD 그룹은 SC그룹에서 Vglut1 (p< .05), VGAT (p< .05) 및 SC-EXE 그룹에서 Vglut1 (p< .05), VGAT (p< .05)의 발현이 유의하게 감소하는 것으로 나타난 반면 12주간 트레드밀 운동을 실시한 HFD-EXE 그룹은 HFD 그룹에 비해 Vglut1의 발현이 유의하게 증가하는 것으로 나타났다 (p< .01)(Fig. 4B-D).

Effects of treadmill running on synaptic vesicle transporter in the hippocampus of HFD-induced 3xTg-AD mice (A). Representative western blots of Vglut1, Vglut2, VGAT, and β-actin of hippocampus (B-D). Densitometric analysis of the western blot bands normalized to β-actin. Values are presented as mean±SD.
*p<.05 and **p<.01.
4. 12주간 실험처치가 postsynaptic density 95와 Synaptophysin 발현에 미치는 영향
총 12주간의 실험처치에 따른 해마의 postsynaptic density 95 및 Synaptophysin의 변화를 관찰하기 위해 western blot 분석을 실시한 결과이다(Fig. 5A). 그 결과, HFD 그룹은 SC그룹(p< .01) 및 SC-EXE (p< .05) 그룹에서 postsynaptic density 95의 발현이 유의하게 감소하는 것으로 나타난 반면 12주간 트레드밀 운동을 실시한 HFD-EXE 그룹은 HFD 그룹에 비해 postsynaptic density 95의 발현이 증가하는 경향으로 나타났다(Fig. 5B). 또한, Synaptophysin의 발현을 분석한 결과 SC 그룹에 비해 12주간 트레드밀 운동을 실시한 SC-EXE 그룹에서 Synaptophysin의 발현이 증가하는 것으로 나타났으며(p< .05), HFD-EXE 그룹은 SC 그룹(p< .05) 및 HFD 그룹(p< .05)에 비해 Synaptophysin의 발현이 유의하게 증가하는 것으로 나타났다(Fig. 5C).
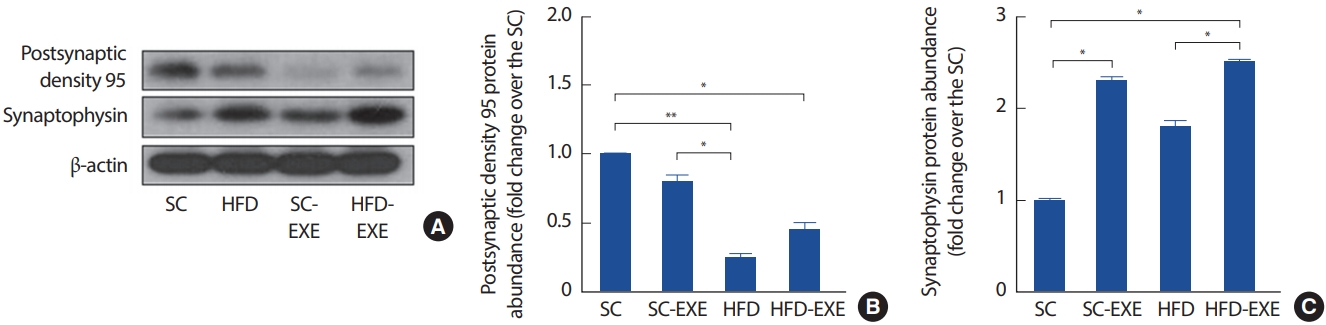
Effects of treadmill running on synaptic stability in the hippocampus of HFD-induced 3xTg-AD mice (A). Representative western blots of PSD95, Synaptophysin, and β-actin of hippocampus (B-C). Densitometric analysis of the western blot bands normalized to β-actin. Values are presented as mean±SD.
*p<.05 and **p<.01.
5. 12주간 실험처치가 SOD1, GPX 및 CAT 발현에 미치는 영향
총 12주간의 실험처치에 따른 해마의 SOD1, GPX 및 CAT의 변화를 관찰하기 위해 western blot 분석을 실시한 결과이다(Fig. 6A). 그 결과, SC그룹에 비해 12주간 트레드밀 운동을 실시한 SC-EXE 그룹은 CAT의 발현을 유의하게 증가시키는 것으로 나타났다(p< .01). HFD 그룹은 SC 그룹 GPX (p< .05) 및 SC-EXE 그룹에서 SOD1 (p< .05), CAT (p< .01) 및 GPX (p< .01)의 발현이 유의하게 감소하는 것으로 나타난 반면 12주간 트레드밀 운동을 실시한 HFD-EXE 그룹은 HFD 그룹에 비해 SOD1의 발현이 유의하게 증가하는 것으로 나타났다(p< .05)(Fig. 6B-D).
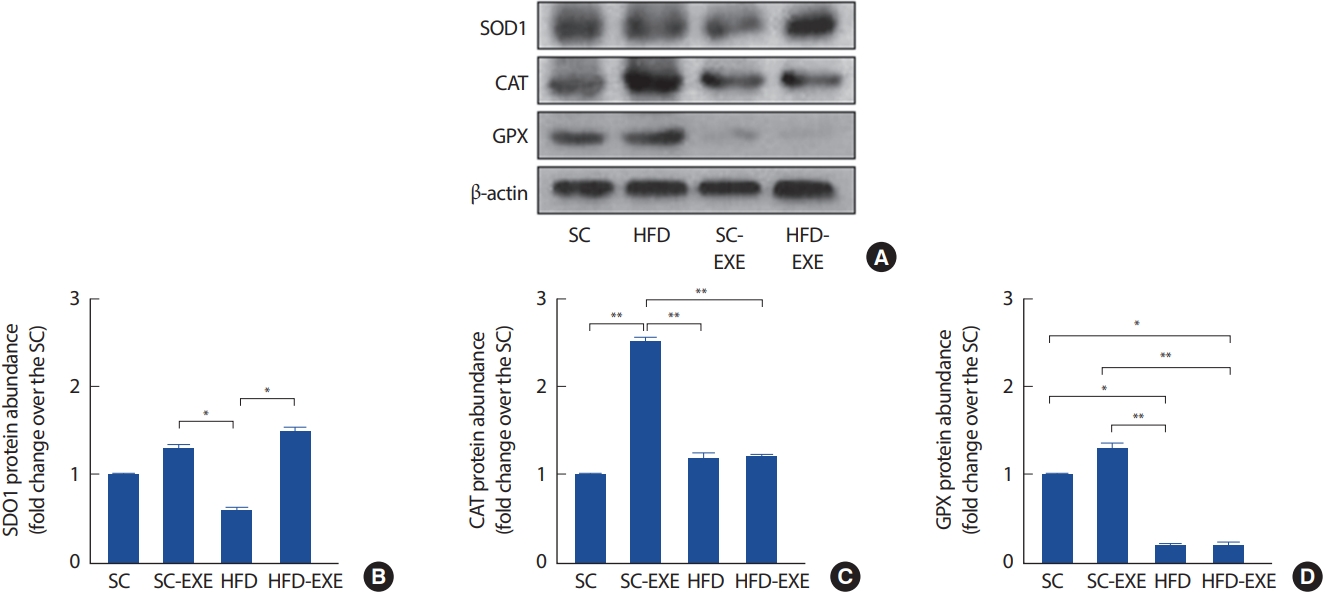
Effects of treadmill running on antioxidant enzymes in the hippocampus of HFD-induced 3xTg-AD mice (A). Representative western blots of SOD1, CAT, GPX and β-actin of hippocampus (B-D). Densitometric analysis of the western blot bands normalized to β-actin. Values are presented as mean±SD.
*p<.05 and **p<.01.
논 의
본 연구에서는 AD는 어느 특정 단일 원인에 의한 질환이라기보다는 신경계 노화 현상에 유전적 위험 요소와 환경적 위험인자가 더해진 복합 발병기전에 의한 증후군이라는 다양한 선행연구들이 보고되고 있다. 이를 비추어 볼 때 비만 및 다양한 대사질환의 위험인자이며 AD 발병에 직·간접적으로 관여하는 고지방식 섭취를 통해 AD의 병리학적 진행은 물론 그로 인해 수반되는 시냅스 소포체 및 항산화 효소 발현에 대한 규칙적인 운동의 효과를 규명하고자 한다.
선행연구에서 고지방식 섭취는 AD병리학적 진행을 악화시키는 것으로 보고되었는데, Lin et al. [35]은 5xFAD 마우스 모델을 이용하여 10주간의 고지방식 섭취는 해마 미세혈관 및 대뇌피질 동맥 내에 Aβ 침착을 유의하게 증가시킨다는 연구와 Nakandakari et al. [36]은 단기간 고지방 섭취에도 불구하고 해마의 CA1 부위에 Aβ 침착과 과인산화된 Tau의 발현을 증가시킬 뿐만 아니라 뇌의 세포사멸 신호전달경로(apoptotic pathway)의 활성을 유도하여 인지기능 장애를 일으키는 것으로 나타났으며, 이는 Baek et al. [37]과 Shin et al. [38]의 연구에서 수행한 Morris water maze을 수행한 결과 공간 학습 및 기억능력이 유의하게 감소하는 것을 관찰할 수 있었다. 이와 유사하게 본 연구에서도 12주간의 고지방식이 섭취는 3xTg-AD 마우스의 해마의 Aβ 침착과 P-Tau/T-Tau의 발현을 증가시키는 것으로 나타났다. 이처럼 고지방식 섭취로 인한 비만은 저밀도 지단백질(Low density lipoprotein cholesterol, LDL)을 증가시켜 전신염증 및 혈관 손상을 일으키는 산화리포단백질(ox-LDL)의 생성을 증가시키며[39-41], 인슐린 신호전달 체계의 활성을 감소시켜 Aβ의 주요 분해 효소인 인슐린 분해효소(Insulin degrading enzyme, IDE)의 분비를 억제시켜 결과적으로 시냅스의 기능이상 및 신경퇴화와 같은 AD의 병리적 진행을 촉진시키는 것으로 나타났다. 반면, 다양한 형태의 신체활동은 AD의 병리적 진행을 완화시킬 뿐만 아니라 중요한 위험인자인 비만 및 대사 질환을 예방 혹은 개선시키는 것으로 여러 연구를 통해 밝혀졌다. Kar et al. [42]은 초기 고지방식이 섭취를 통해 비만 및 인슐린 저항성 유도한 마우스에서 20주간 트레드밀 운동을 중재한 결과 인슐린 기능 개선 및 비만의 표현형(phynotype)을 완화시키는 것으로 보고하였으며, Kim et al. [43]은 3xTg-AD 마우스를 이용하여 20주간 트레드밀 운동을 중재한 결과 고지방식으로 인한 비만 및 뇌의 인슐린 신호전달체계를 개선시켜 Aβ 침착 및 과인산화된 타우의 발현을 감소시키데 기여하는 것으로 나타났다. 또한, Maesako et al. [44]의 연구에 의하면 APPSwe/Ind 마우스를 이용하여 10주간의 고지방 섭취 후 AD 병리적 진행의 개선 효과를 살펴본 결과 식단조절보다 규칙적인 운동 수행이 Aβ 침착과 기억력 감소에 보다 더 효과적이라는 흥미로운 사실을 발견하였다. 본 연구 결과에서 12주간 트레드밀 운동은 고지방식 섭취로 가중된 Aβ 침착과 P-Tau의 발현을 억제시켰지만 선행연구와 다르게 T-Tau의 발현 또한 증가시키는 결과를 나타냈다. 일반적으로 Tau 단백질은 신경세포의 성장 및 미세소관(microtubule)의 안정성을 유지하여 물질의 이동을 조절하지만[45,46] Tau 단백질의 과인산화로 형성된 신경섬유덩어리(neurofibrillary tangle)는 뇌 세포 손상을 일으켜 AD 발병에 영향을 미친다는 선행연구들을 비추어 볼 때, 본 연구에서 나타난 HFD-EXE 그룹에서 T-Tau 단백질 발현의 증가는 안정성 유지 및 Tau 단백질의 과인산화로의 전환을 억제시키기 위한 측면에서 증가됐을 것이라 사료된다.
최근 연구는 AD의 발병 기전에 중요한 역할을 하는 대뇌의 과도한 Aβ 침착은 신경세포 사이의 신호전달이 일어나는 시냅스 기능 장애의 근본적인 원인으로 제안되며, 이는 신경전달 물질(neurotransmitter)의 감소 및 시냅스 소실(synaptic loss)을 유발하고 장기 기억강화를 억제하며 결과적으로 AD의 임상적 특징인 인지장애를 유발하는 것으로 나타났다. Zolezzi et al. [47]연구는 amyloid oligomer의 해마의 과도한 축척은 시냅스 기능 장애를 유발하는데 특히, CA1에서 Vglut의 발현을 감소시킨다는 연구와 이와 유사하게 ApoE 대립 유전자가 표적화된 마우스를 대상으로 비교한 결과 Aβ 침착이 더 많이 일어난 ApoE4 마우스에서 비례적으로 Vglut1 발현이 보다 더 감소하는 경향을 나타낸 연구[48], 게다가, AD 환자를 대상으로 한 임상연구에서는 대뇌피질 영역에 Vglu1 발현이 감소하는 경향을 관찰하였다[49]. 본 연구결과 또한 12주간 고지방식이는 Vglut1, Vglut2 및 VGAT 발현을 감소시키는 것으로 나타났다. 다양한 형태의 신체활동은 시냅스 기능을 개선시키는 것으로 나타났는데, 자발적인 휠 운동은 3xTg-AD 마우스 모델에서 GABA의 기능 장애를 회복시킬 수 있다는 연구[50], 해마 치상회(Dentate gyrus)의 VGAT 발현 및 새로운 신경세포 재생에도 도움을 준다는 연구와 같이[51], 본 연구 결과에서도 선행 연구와 유사하게 12주간 트레드밀 운동은 Vglut1, Vglut2 및 VGAT 발현을 향상시키는 것으로 나타났다. 또한, 신경연접형성 및 신경세포의 말단 부위에서 소포체의 결합이나 합성 과정에 관여하며 AD 병리학적 진행 및 인지기능 장애에 중요한 역할을 하는 신경연접 단백질의 발현을 살펴본 결과, 고지방식이 섭취는 postsynaptic density 95 의 발현을 감소시키는 반면 12주간 운동 트레이닝은 고지방식으로 감소된 Synaptophysin의 발현을 증가시키는 것으로 나타났다. 많은 연구자들은 규칙적인 운동을 통해 해마 시냅스 가소성을 개선[52,53] 및 새로운 시냅스 생성[54]에 영향을 줄 수 있음을 보고하였다. 다만 본 연구결과 정상식이 그룹에서 postsynaptic density 95의 발현에 대한 운동의 효과는 나타나지 않았지만 선행연구를 비추어 볼 때 신경성장인자 및 다른 시냅스 단백질 발현에 긍정적인 영향일 미쳤을 것이라 추측된다.
이와 더불어 활성산소로 인한 산화스트레스는 신경염증 및 신경세포사멸을 일으켜 AD의 병리기전에 중요한 역할을 하는 것으로 나타나고 있는데 이는, BACE1의 활성증가를 유도하여 AD의 주요원인 물질인 Aβ 생성을 촉진시켜 AD 병리학적 진행을 더욱 악화시키는 것으로 나타나고 있다. 비만과 AD를 대상으로 실시한 동물 및 임상실험 결과에서 항산화 효소의 발현이 감소하는 것으로 본 연구 결과와 유사하게 12주간의 고지방식이 섭취는 AD 마우스의 해마에서의 항산화 효소 발현을 감소시키는 것으로 나타났다. 이전의 규칙적인 운동과 항산화 효소 발현과 관련된 연구는 8주간의 유산소 운동은 SOD와 CAT의 발현을 유의하게 증가시킨다는 de Souza et al. [55]의 연구와 파킨슨 동물 모델을 대상으로 8주간 트레드밀 운동을 실시한 결과 BNDF, SERCA II, SOD 및 CAT의 수준을 증가시키고 지질 및 단백질의 산화적 손상을 감소시킨 Tuon et al. [56]의 연구 및 Lee et al. [57]은 8주간 저항성 운동 중재는 항산화 효소 활성을 향상시킴으로써 산화 스트레스를 감소시키며 이는 해마에서의 caspase-3, bax 및 Bcl-2 발현과 같은 세포사멸관련 단백질 발현을 완화시키는 것으로 나타났다. 또한, AD 동물 모델을 대상으로 규칙적인 운동은 항산화 방어를 유도하며 시냅스 및 산화-환원 항상성(redox homeostasis)를 향상시켜 인지기능 저하를 개선 시키는 것으로 보고하였다[58]. 본 연구결과 12주간 트레드밀 운동은 고지방식 섭취로 감소된 SOD1 발현을 증가시켰지만 CAT 및 GPX 발현에는 차이가 없는 것으로 나타났다. 이는 규칙적인 운동이 초과산화물 라디칼(superoxide radical)을 과산화수소(H2O2)로 전환시켜 활성산소의 생성을 억제시키고 세포 손상을 예방하는데 주요한 역할을 하는 SOD1 발현에 보다 더 효과적으로 영향을 미치는 것으로 사료된다.
본 연구팀의 연구결과를 종합해 보면, 12주간의 운동 트레이닝은 고지방식 섭취로 인해 악화된 AD의 병리학적 진행을 억제시켜 인지기능 감소에 대한 예방 및 개선효과가 있을 것으로 사료된다. 이러한 사실을 기반으로 본 연구는 운동 트레이닝이 고지방식으로 유도된 비만 및 이로 인해 동반되는 대사장애 의해 가속화되는 AD의 병리학적 진행을 완화시키는 효과가 있을 것으로 사료된다. 단, 본 연구에서는 비만지표와 인슐린 신호전달체계 및 인지 행동 관련연구가 부족한 실정이며, 추후 연구에서는 본 연구를 바탕으로 다양한 측면에서 연구가 추가되어야 할 것으로 사료된다.
결 론
본 연구에서 12주간 고지방식 섭취는 3xTg-AD 마우스의 병리학적 특징 중 Aβ 침착과 P-Tau/T-Tau 발현을 증가시키는 반면 시냅스 소포체 및 항산화 효소의 발현을 감소시켜 AD의 병리학적 진행을 악화시키는 것으로 나타났다. 반면, 운동 트레이닝은 고지방식으로 증가된 Aβ 침착과 P-Tau/T-Tau 발현과 시냅스 기능 및 항산화 효소 발현에 이점을 제공해주는 것으로 나타났다. 따라서 규칙적인 운동은 AD의 유전적 요인 및 환경적 요인에서 악화되는 병리학적 진행을 완화시킬 수 있을 것으로 사료된다.
Notes
이 논문 작성에 있어서 어떠한 조직으로부터 재정을 포함한 일체의 지원을 받지 않았으며, 논문에 영향을 미칠 수 있는 어떠한 관계도 없음을 밝힌다.
AUTHOR CONTRIBUTION
Conceptualization: IJ Kim, Funding acquisition: DH Kim, Methodology: DH Kim, Project administration: DH Kim, Writing - original draft: DH Kim, Writing - review & editing: DH Kim, IJ Kim.