당뇨 전 단계 고령자의 규칙적인 저항성 운동이 뇌신경가소성 인자에 미치는 영향
Effects of Regulatory Resistance Exercise on Brain Neuroplasticity Factors in Prediabetic Elderly
Article information
Trans Abstract
Purpose
The purpose of this study was to determine whether regulatory resistance exercise is as effective as aerobic training at improving the blood levels of brain-derived neurotrophic factor (BDNF), and nerve growth factors (NGF) as well as Cathepsin B, which are major factors contributing to the regulation of glucose metabolism and neuroplasticity, in prediabetic elderly.
Methods
Among the elderly aged 65 years or older who attended the B welfare center in C city, 16 patients who had no disease and had HbA1c of 5.7-6.4% were randomly assigned into either control group (CO, n=8, age 69.12±2.07 years) and resistance exercise group (RE, n=8, 71.25±1.69 years). Both groups were exercised three times a week for 12 weeks with the exercise intensity of 200-250 kcal consumed Body composition and basic physical fitness tests were measured at baseline and at week 12. Blood levels of BDNF, NGF and Cathepsin B were also analyzed by using glucose metabolism factor and enzyme immunoassay.
Results
As a result, there were no significant differences in all body composition in both CO and RE. In addition, there were no statistically significant differences in all variables of the glycolysis factor. The blood levels of BDNF and NGF were significantly increased after the 12 weeks exercise program in the RE compared with the CO (p<.05).
Conclusions
Based on these results, regular resistance exercise seems to be effective in increasing the brain neuroplasticity factors BDNF and NGF in prediabetic elderly. Depending on the prediabetes stage or the period of stay in the diabetic stage, further study is needed after considering the exercise period and intensity.
서론
대한당뇨병학회에서 발간하는 당뇨병 백서에 따르면, 우리나라 30세 이상 성인에서 제2형 당뇨병 (Type 2 diabetes mellitus, T2DM) 유병률은 2016년을 기준으로 성인 7명 중 1명이 당뇨병환자 (13.7%)이고, 성 인 10명 중 2.5명이 당뇨 전 단계로 알려져 있어, 성인 10명 중 3명이 당뇨병 환자이자 잠재적 당뇨병 임을 알 수 있다. 특히 고령자에 있어 당뇨 전 단계는 심혈관질환의 발생과[1] 사망률을 증가시키는 원인으로 보고되고 있다. 우리 나라 전체인구 중 고령 인구는 14.9% (2019년 통계청 자료)를 차지하여 고령자의 당뇨 전 단계 위험성을 관리해야 할 필 요성이 제기되고 있다[2]. 특히 당뇨병 환자는 뇌 기능 장애 및 정신 장애의 위험이 높으며, 그 중 신경영양인자의 변화는 신경계의 가소성을 평가할 수 있는 것으로 나타났다[3]. 즉, 신경영양인자는 신경연접의 증가와 신경계의 발생, 기억, 손상 후 재생 과정에서 중요한 역할을 하며, 뇌신경의 생성과 발달을 평가할 수 있는 대표적 인자로 뇌신경영양인자 (brain-derived neurotrophic factor, BDNF), 신경성장인자 (nerve growth factors, NGF)가 있으며, 최근 Cathepsin B가 뇌신경가소성에 영향을 주는 것으로 나타났다[4].
BDNF는 뇌의 여러 영역 중 신경세포의 성장, 발달, 보호 및 생존을 향상시키는 중요한 물질이며[5], 신경 분화 및 시냅스 가소성과도 관련이 있다[6]. 특히 나이가 들어감에 따라 BDNF의 농도는 감소하고 노인의 신경 손실은 말초 BDNF 수준과 관련이 높은 것으로 알려져 있다[7]. 또한 T2DM 환자에서 혈청 BDNF 수준이 감소하였으며, BDNF가 제대로 발현되지 않으면 T2DM 환자의 인지 결핍에 기여하는 것으로 나타났다[8]. 한편, NGF는 신경영양인자에 속하는 것으로 BDNF와 생리적 효과가 유사하며, 말초신경계와 중추신경계에 존재하는 신경영양물질이다. 선행연구에 따르면 수컷 흰쥐를 대상으로 12주간 수영운동이 대조군에 비해 해마의 NGF 및 BDNF 발현 증가에 효과적인 것으로 보고되었으며[9], 실험동물에서 자발적인 wheel running을 실시한 결과 해마에서 NGF와 BDNF의 발현이 증가되는 것으로 확인되어[10] 동물실험에서 운동으로 인한 NGF의 효과를 보고하고 있다.
최근 연구에 따르면 골격근은 운동 중 근육의 수축과 이완을 통해 myokine 인자들을 생산하고 방출함으로써 다른 장기들에 대한 면역체계를 강화시킨다[11]. 그리고 운동에 의해 분비되는 myokine 인자들은 골격근으로부터 생성 및 방출되는 다른 분자와 함께 말초신경계 및 중추신경계를 통해 뇌로 직접 전달하여 뇌신경가소성에 영향을 준다[11]. 이러한 측면에서 볼 때, Cathepsin B는 해마에서 BDNF 발현을 촉진하고 신경 발생을 자극하여 전신 수치 상승을 유도하는 것을 시작으로 Cathepsin B가 해마의 신경 발생, 기억 및 학습에서 운동 유발성 개선을 중재하는데 인과 관계가 있음을 보여주었다[4]. 또한 동물연구에서 Cathepsin B는 뇌 혈관 장벽을 통과하여 해마의 신경 발생, 신경 가소성, 기억 및 학습을 향상시키는 것으로 보고하고 있다[4]. 인간을 대상으로 실시한 연구의 혈장에서 Cathepsin B 활성은 대조군과 비교하여 T2DM 환자에서 38% 더 높게 나타났으며, T2DM 환자에서 Cathepsin B 활동이 유의하게 증가함을 발견하였다[12]. 그러나 Cathepsin B가 규칙적인 운동에 의해 유도되는 인지 기능이 인간에게 어느 정도 영향을 끼치는 요인 인지는 아직까지 불분명하다.
선행 연구에 따르면 당뇨병성 말초신경병증의 병인은 NGF의 감소와 관련성이 매우 높은 것으로 보고되고 있으며[8], 혈장에서 Cathepsin B의 활성은 T2DM 환자에서 더 높게 나타남을 알 수 있다[13]. 하지만 노화가 진행됨에 따라 BDNF의 농도는 감소하는 경향이 있으며[7], T2DM 환자에서 역시 혈청 BDNF 수준이 감소하여[8], 당뇨병 환자들에 있어 뇌신경가소성이 직-간접적으로 영향을 끼칠 수 있다. 따라서 당뇨병으로 진행될 확률이 정상인에 비해 5배 이상 높은 당뇨 전 단계 고령자와 뇌신경가소성 관련 인자에 대한 연구가 요구되며, 그들에게 있어 규칙적인 저항성 운동이 뇌신경가소성 인자에 어떠한 영향을 주는지에 대한 연구가 필요하다. 본 연구는 당뇨 전 단계를 가진 고령자를 대상으로 규칙적인 저항성 훈련을 통해 당대사 조절과 뇌신경가소성 향상에 기여하는 주요 인자인 BDNF, NGF, 그리고 Cathepsin B에 미치는 영향을 살펴봄으로써 당뇨 전 단계 고령자의 당뇨 예방을 위한 기초자료로 사용하고자 한다.
연구방법
1 연구 대상
본 연구는 K대학 생명윤리위원회 (Institutional review board, IRB) 승인을 얻어 개인의 안전보장은 물론 권리 등에 대한 지침을 적용하여 실시하였다. 대상자들은 C시 B복지관에 다니고 있는 65세 이상 고령자들을 대상으로 본 연구의 목적에 대한 설명을 이해하고, 스스로 참여를 동의한 분들을 대상으로 실시하였다. 참여 기준은 당화혈색소 (HbA1c)가 5.7-6.4% 사이로 1년 이상 운동 경험이 없는 65세 이상 고령 여성 (n=16)을 대상으로 대조군 (n=8, age=69.12±2.07, height=155.88±2.3)과 운동군 (n=8, age=71.25±1.69, height=150.81±2.22)으로 분류하여 실시하였다. 참여 제외 기준은 이미 당뇨병 진단을 받았거나, 의학적 질병이 있는 환자는 제외하였으며, 의학적 진단에 따라 신체활동이 어려운 대상자들은 제외하였다.
2 신체조성 및 채혈검사
모든 대상자들은 10시간 이상 공복 상태를 유지한 후 실험실에 방문하여 약 30분간 앉아 휴식을 취하게 하였으며, 주정맥을 통해 약 10 cc 채혈하였다. 이후 최대한 간편한 복장으로 다주파수 생체전기 임피던스 분석원리를 적용한 체성분분석기 (Inbody 720, Bio space, Korea)를 사용하여 신장, 체중, 체지방률, 허리둘레, BMI를 측정하였다.
3 국민체력 100 노인체력검사
1) 상대악력
직립 자세에서 양발을 어깨너비 만큼 벌리고 악력계 (GRIP-D 5101, TAKEI, Co., Japan)의 손잡이를 손락락 둘째 마디로 잡는다. 이때 팔은 아래로 곧게 펴고 몸통과 15° 간격을 유지한다. ‘시작’ 구호와 함께 5초간 최대 힘으로 악력계를 쥐도록 하였으며, 좌우교대로 2회씩 실시하여 최대값을 0.1 kg 단위로 기록하였다. 상대악력 (%)은 (악력 (kg)/체중 (kg))×100 공식을 이용하여 산출하였다.
2) 의자에 앉았다 일어서기
높이가 40 cm 정도 되는 의자의 중앙에 앉게 한 후 양팔은 가슴 앞에 교차시킨다. ‘시작’ 구호와 함께 30초 동안 의자에 앉았다 일어서기를 반복하도록 하였으며, 30초 동안 완벽하게 선 자세의 총 횟수를 기록하였다.
3) 의자에 앉아 3 m 표적 돌아오기
높이가 40 cm 정도 되는 의자의 중앙에 앉게 한 후 양손은 허벅지 위에 올린다. ‘시작’ 구호와 함께 의자에서 3 m 지점에 있는 고깔을 최대한 빠른 걸음으로 돌아와 의자에 앉는 시간을 0.01초 단위로 기록하였다.
4) 앉아윗몸앞으로굽히기
바닥에 무릎을 펴고 앉아 발바닥을 측정기구에 밀착시킨 다음 양손을 앞으로 나란히 뻗는다. ‘시작’ 구호와 함께 상체를 숙여 손끝으로 측정판을 최대한 밀어내도록 하였다. 2회 측정하여 최대값을 0.1 cm 단위로 기록하였다.
5) 8자 보행
바닥에 가로 3.6 m×세로 1.6 m인 직사각형의 선을 긋고, 양쪽 모서리에 고깔을 고정시킨 다음 고깔에서 2.4 m 되는 지점에 의자를 놓았다. 대상자는 사각형 양쪽 모서리 중앙에 있는 의자에 앉아서 대기하다가 ‘시작’ 구호와 함께 오른쪽 후방에 있는 고깔을 돌아와 의자에 앉았다가 쉬지 않고 다시 왼쪽 후방의 고깔을 돌아와 의자에 앉는다. 이 동작을 두 번 반복하여 소요된 시간을 0.01초 단위로 기록하였다.
6) 2분 제자리걷기
대상자의 슬개골 중앙에서부터 장공늘까지의 길이를 측정한 다음 중간지점에 테이프로 표시하였다. 대퇴에 표시한 지점과 같은 높이에 고무줄을 지지대 양 기둥에 달아 높이를 조절한 후 ‘시작’ 구호와 함께 무릎이 고무줄에 닿도록 들어 올린다. 양쪽 무릎 모두 완전하게 닿았을 때를 1회로 계수하였으며, 2분 동안 반복한 총 횟수를 기록하였다.
4 운동프로그램
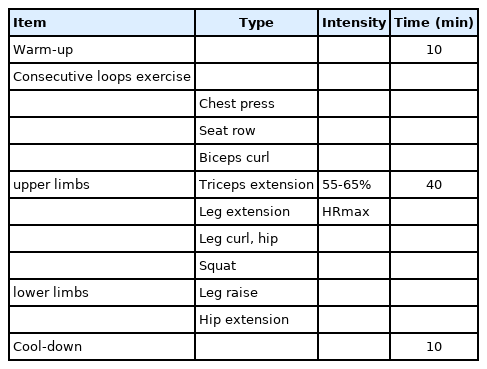
운동프로그램은 근력강화 저항성운동으로 구성하였으며, 준비운동 10분, 본운동 40분, 정리운동 10분으로 구성하였다 (Table 1). 본 운동은 밴드운동으로 상지와 하지로 구분하여 실시하였다. 1-4 (55-65% HRmax, 200-250 kcal)주까지는 맨몸운동과 필라테스 링을 사용하였으며, 5-8주 (55-65% HRmax, 200-250 kcal)는 빨간색 밴드를 이용하였으며, 9-12주 (55-65% HRmax, 200-250 kcal)는 초록색 밴드를 사용하여 각 동작을 한 세트당 10-12회 실시하였다. 운동강도는 무선심박측정기폴라 (Polar M400)를 이용하여 설정하였다.
5 혈액분석
혈액 채취는 채취 전 10시간 이상의 공복상태를 유지하도록 통제하여 익일 오전 8:00에 실시하였다. 채혈은 앉은 자세에서 약 5 mL (2개)를 주정맥에서 채혈하였으며, 이때 항응고제와 LFT tube로 처리된 진공 채혈관 튜브를 사용하였다. 채혈된 정맥혈은 상온에서 원심분리기 (3,000 rpm)로 혈청을 분리하여 분석시까지 −80– 냉동고에 보관하였으며, 혈중지질 분석은 G의료재단에 의뢰를 통하여 총 콜레스테롤 (Total Cholesterol, TC), 고밀도콜레스테롤 (High density lipoprotein cholesterol, HDL-c), 저밀도콜레스테롤 (Low density lipoprotein cholesterol, LDL-c), 당화혈색소 (HbA1c), 공복혈당 (fasting blood glucose, FBG), 중성지방 (Triglyceride, TG), C-peptide를 분석하였다.
뇌신경가소성 인자는 효소면역법 (ELISA)을 이용하여 직접 분석하였다. BDNF는 Human BDNF DuoSet ELISA(DY248, R & D Systems, Minneapolis, MN, USA), NGF는 Human beta-NGF DuoSet ELISA (DY256-05, R & D Systems, Minneapolis, MN, USA), Cathepsin B는 Human Total Cathepsin B DuoSet ELISA(DY2176, R & D System, Minneapolis, MN, USA) kit를 이용하여 측정하였다. BDNF, NGF, Cathepsin B는 혈장을 통해 효소를 이용한 항체-항원 반응 원리를 이용한 방법으로 분석하였다. 즉 96 well microplate에 일차 항체를 코팅 (capture antibody)하고 standard와 혈장 샘플들을 처리하여 특이적인 이차 항체를 처리한 후 효소 (HRP)가 결합된 물질을 처리하여 효소와 기질 용액의 반응으로 optical density를 microplate 분광광도계 (spectramax M2e Microplate reader, Molecular Devices LLC, San Jose, CA, USA)로 측정하여 계산하였다.
6 자료처리
본 연구의 자료처리는 SPSS 24.0 통계프로그램을 이용하여 규칙적 인 저항성 운동 전후 모든 변이에 있어 평균 (M)과 표준편차 (SD)를 산출하였다. 집단 간 (운동군 vs. 대조군), 시기 간 (사전 vs. 사후) 저항성 운동에 따른 당 대사와 뇌신경 가소성의 차이를 검증하기 위해 이원분산 분석 (Two-way ANOVA)을 실시하였다. 사후검증으로 집단 간 차이가 있을 시 독립 t-test를 시기간 차이가 있을 시 대응 t-test를 실시하였다. 모든 동계적 유의 수준은 α=.05로 설정하였다
연구결과
1 신체 구성의 변화
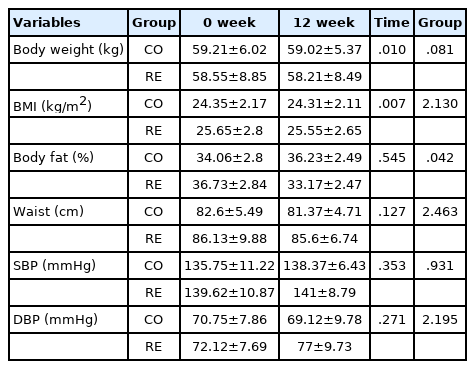
12주간 규칙적인 저항성 운동프로그램의 적용 후 신체구성의 결과는 Table 2와 같다. 체지방률에서 두 그룹 모두 0주에 비해 12주 후 감소하는 경향이 나타났으나, 통계적으로 유의한 차이를 보이지는 않았 다. 또한 다른 모든 변인에서 통계적 유의수준은 나타나지 않았다.
2 노인 기초 체력 검사의 변화
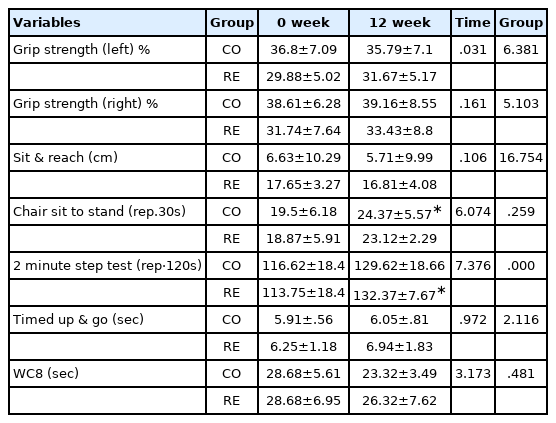
연구 대상자들의 기초체력 변화에 대한 결과는 Table 3과 같다. 의자에 앉았다 일어서기에서 0주에 비해 12주 후 대조군에서 유의하게 증가하였으나 (p <.05), 2분 제자리걷기에서는 저항성운동군에서 유의한 증가가 나타났다 (p <.05). 하지만 다른 모든 변인에서 통계적인 유의수준이 나타나지 않았다.
3 혈당 및 혈중지질의 변화
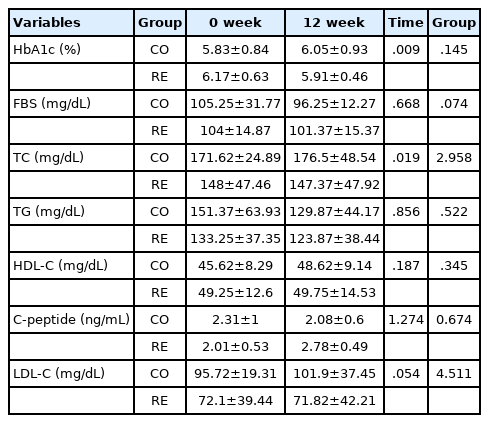
연구 대상자들의 혈당 및 혈중지질 변화에 대한 결과는 Table 4와 같다. 당화혈색소와 공복혈당에서 저항성운동군은 0주에 비해 12주 후 감소하는 경향을 보였으나, 통계적으로 유의한 차이를 보이지 않았 다. 또한 다른 모든 변인에서 통계적 유의수준이 나타나지 않았다.
4 뇌신경가소성 인자의 변화
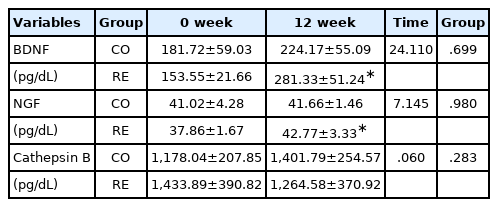
연구 대상자들의 뇌신경가소성 인자의 변화에 대한 결과는 Table 5와 같다. BDNF와 NGF는 저항성운동군에서 0주에 비해 12주 후 유의하게 증가하였다 (p <.05). 한편 cathepsin B는 대조군에서 0주에 비해 12주 후 증가하는 경향을 보였으나 통계적으로 유의한 차이를 보이지 않았다. 반대로 저항성운동군은 0주에 비해 12주 후 감소하는 경향을 보였으나 통계적으로 유의한 차이를 보이지 않았다.
논의
노화에 따른 인지능력 저하는 자연스러운 현상이지만, 규칙적인 신체 활동은 신진대사를 높이고 혈관 위험 인자를 감소시켜 노화와 인지능력 저하를 예방하는 것으로 알려져 있다. 하지만 어떠한 기전을 통해 규칙적인 운동이 노화를 늦추는지 또는 뇌 기능을 향상시키는지 여부는 명확하지 않다[11]. 그리고 노화된 근육이 어느 정도까지 뇌에서 충분한 생리학적 반응을 유도할 수 있는지에 대해서도 불분명하다[11]. 규칙적인 운동은 신경 퇴행성 질환을 않고 있는 환자 및 모든 연령층의 건강한 사람에게 인지 능력 감소 속도를 낮추어 스트레스, 불안 및 우울증에 긍정적인 영향을 주며, 뇌 건강의 개선 및 뇌신경가소성 향상에 효과적인 것으로 보고되고 있다[14]. 실험동물 연구에서 규칙적인 운동은 노화와 관련이 있는 근육 감소증을 예방할 수 있으며, 성인 및 고령 쥐 해마 신경 발생에 긍정적인 영향을 주는 것으로 보고하고 있다[11]. 그리고 당뇨병은 신경계 및 합병증의 위험을 증가시키는 것으로 알려져 있으며[15], 치매의 3분의 1은 고혈압, 비만, 당뇨 등의 원인으로 발생한다. 이는 규칙적인 운동으로 예방이 가능한 것으로 알려 져 있으나, 대부분의 고령자들은 신체 활동이 부족하기 때문에 치매 또는 인지기능 예방에 어려움이 있다[14]. 그럼에도 불구하고 규칙적인 신체 활동은 혈관신생, 신경생성 및 시냅스 발생을 촉진하여 학습, 기억 및 뇌신경가소성을 향상시키는 세포 및 분자 과정을 통해 인지 기능과 밀접한 관련이 있다고 보고되고 있다[16]. 본 연구 결과 당뇨 전 단계 고령자들의 운동프로그램 시행 전·후 신체조성 중 체중, BMI 그리고 체지방률에서 감소하는 경향이 나타났으나, 통계적으로 유의한 차이는 나타나지 않았다. 이러한 결과는 제2형 당뇨병 여성 노인에게 8주동안의 유산소성 운동이 체중, BMI 그리고 체지방률의 변화가 나타나지 않은 연구[17]와 정상적인 노인을 대상으로 장기간 (12개월) 운동프로그램 시행 후 그들의 체중과 체지방률의 변화가 나타나지 않은 선행연구와 유사한 결과가 나타났다[18]. 따라서 고령자들의 경우 연령이 증가할수록 체지방률 증가가 높아지기 때문에 장기간 운동 후에도 체지방률 변화에 유의한 차이가 나타나지 않는 것으로 판단되며[19], 연령이 높을수록 장기간 신체 구성에 대한 부정적인 영향의 장기간 지속되어 12주간의 저항성 운동은 신체조성 변화에 부족한 것으로 사료된다. 그럼으로 고령자들의 신체조성 변화를 위한 운동의 목적은 부정적 인 인자들의 감소 지연을 목표로 하는 것이 타당할 것이다.
본 연구에서 혈당, 당화혈색소 그리고 콜레스테롤은 감소하는 경향이 나타났으나, 통계적으로 유의한 차이는 나타나지 않았다. 선행연구를 살펴보면, 제2형 당뇨병 여성 노인 20명을 대상으로 24주간 운동프로그램 시행 후 혈당, 총 콜레스테롤 그리고 저밀도 지단백 콜레스테롤은 운동 전 후에 집단간에 유의한 차이가 나타나지 않았으며[20], Kim et al. [21]은 당뇨병 노인 49명에게 1년간 생활습관 중재 프로그램 (식사요법, 운동요법)에 참여하게 한 결과 중재 전후의 체중, BMI, 공복혈당, 당화혈색소, 혈압 그리고 콜레스테롤에서 변화가 나타나지 않았다. 즉, 질병의 위험성인 당뇨 전 단계와 질병 단계인 당뇨병환자의 노출 기간에 의해 운동효과가 미비한 것으로 사료된다. 본 연구에서 당뇨 전 단계에 머물렀던 기간은 파악하지 못하였으나 고령자임을 감안하여 당뇨 전 단계에 오래 머물러 있었다고 가정할 때 위험단계에 들어선 기간만큼 정상범위로 돌아오기 위해 더 많은 운동 기간이 요구되는 것으로 사료된다.
일반적으로 고혈압, 비만 그리고 당뇨병 같은 만성질환의 경우 예방에 대한 중요성이 더 크다고 할 수 있는데, 특히 혈당의 경우 정확한 메커니즘은 아직 밝혀지지 않았지만 뇌신경 가소성과 관련하여 혈당 조절이 긍정적인 영향을 줄 수 있는 요인이다[15]. 뇌신경 가소성 인자 중 BDNF는 신경 재생을 자극할 수 있으며, 신경계의 발달 및 뇌신경 가소성에 영향을 미친다[15]. BDNF의 혈장 수치는 나이가 들어감에 따라 감소하는 것으로 보고 되고 있으며, BDNF 수치는 30대에 최고치에 달하며, 이후 약간 감소하는 경향을 나타내고 있다[22]. 선행연구에서 제2형 당뇨병 환자의 경우 대조군 보다 높은 수준의 BDNF를 함유하고 있음을 증명하였으며[23], 또한 제2형 당뇨병으로 진단된 일본 여성과 정상적인 포도당 내성을 가진 여성으로 구성된 연구에서 대조군에서 BDNF 농도는 건강한 대조군 보다 제2형당뇨병 환자에서 더 높았다고 보고하였다[24]. 본 연구에서는 당뇨병 전 단계 고령자에게서 낮은 BDNF 수준을 보여 선행연구와 상이하게 나타났다. 하지만 제2형 당뇨병 환자에서 혈청 BDNF 수준이 급격히 감소하고 균형 BDNF가 포도당 대사에 기여한다[24]는 선행연구와 제2형 당뇨병 환자의 BDNF의 농도가 대조군보다 낮게 나타난 연구에서 특히 제2형 당뇨병을 가진 여성의 경우 당뇨병 지속기간이 길수록 BDNF 농도가 더 낮음을 관찰한[15] 최근 연구와는 유사한 결과를 보여주었다. 또한 운동 직후에 말초 BDNF 수준이 증가하더라도, 장기 운동 훈련의 결과로 뉴로트로핀의 혈청 수준은 성인 및 중년 그룹에서 유의하게 감소된다[22]. 제2형 당뇨병 환자의 혈청 BDNF 수준에 대한 상이한 결과는 결국 질병의 지속 기간 및 비만과 관련이 있다[15].
NGF와 BDNF는 신경 성장 뿐만 아니라 시냅스의 성숙, 축삭, 시냅스 가소성에 필수적인 뇌 신호 전달 분자의 종류인 뉴로트로핀 계열의 일원이다[7]. BDNF와 대조적으로 혈청 NGF 수준은 연령과 성별에 따 른 상관관계를 보이지 않았지만[7], 증가된 포도당은 생체 내에서 NGF 분비를 증가시켰으며[25], NGF 수준의 증가가 당뇨병성 말초신경병증으로부터 보호할 수 있음을 보여주었다[9]. 또한 운동선수의 NGF 농도가 건강한 대조군보다 거의 두 배인 것으로 보고하고 있으며[26], 남자 청소년 22명을 대상으로 규칙적인 운동프로그램을 수행하지 않은 대조군과 주당 18시간을 정기적으로 운동을 실시한 훈련군을 비교해 볼 때, 훈련된 그룹의 NGF 농도는 대조군보다 약간 높았지만 통계적 유의수준은 나타나지 않았다[27]. 그리고 비만 중년 여성 연구에서 대조군과 운동군 그리고 운동프로그램+뇌 전기 요법자극군을 비교하여 운동군과 운동 +뇌 전기 요법군에서 NGF 농도가 크게 증가하는 것으로 보고하였다[28]. 선행연구와 같이 본 연구 역시 NGF가 운동을 통해 증가하는 것으로 나타나 규칙적인 운동프로그램이 뇌신경가소성 인자에 영향을 미쳤다는 것을 입증하였다.
Cathepsin B는 골격근으로부터 분비되고 운동 후 BDNF를 상향 조절하는 것으로 보고되었으며[11], BDNF의 유도를 통해 인지와 관련된 과정을 중재하기 위해 혈액 뇌 장벽을 가로 지르는 myokine으로 보고되고 있다[11]. 이러한 myokine 인자는 자가분비, 주변분비 또는 내분비 작용에 의해 신체의 신진 대사를 조절하며, 뇌 기능을 향상시킬 수 있는 운동 요인으로 보고되며, 항암 효과가 있는 것으로 확인되었다[11]. 쥐, 원숭이 그리고 인간에서 Cathepsin B 혈장 수준은 4개월 러닝 머신 운동 후 유의하게 증가하여[4], 본 연구에서 당뇨 전 단계 고령자에게 규칙적인 저항성 운동 후에 감소하는 경향을 보여 본 연구 결과와 상이한 결과가 나타났다. 그리고 16주 동안 고지방식이를 먹인 실험 쥐의 비만 심장에서 Cathepsin B의 활성이 감소하는 결과가 나타났다[29]. 이러한 결과는 당뇨병 환자의 Cathepsin B 농도가 정상인 보다 약 38% 더 높다고 보고[13]하여 질병으로 높아진 농도를 정상범위로 변화시킨 결과로 판단된다. 따라서 Cathepsin B의 과발현은 지방 세포에서 지방 분해의 기능 장애를 유발하며[30], 운동에 의해 유도되는 인지 기능을 인간에게 어느 정도 결정 짓는 요인인지는 명확하지 않지만, 당뇨병 및 비만과 같은 질병을 관리하는 바이오마커 인자임은 분명하다.
결론
본 연구는 규칙적인 저항성 운동이 당뇨 전 단계를 가진 고령자들의 뇌신경 가소성 인자에 미치는 영향을 규명하고자 고령자 16명을 대상으로 12주간 주 3회 저항성 운동을 적용한 결과 다음과 같은 결론을 얻었다. 12주간 운동프로그램 시행 후 저항성 운동군의 신체조성과 혈당에서 감소하는 경향을 보였으나 통계적으로 유의한 변화를 나타내지 못했다. 그러나 뇌신경 가소성 인자인 BDNF와 NGF의 유의한 변화가 나타났다. 이러한 결과로 볼 때, 규칙적인 저항성 운동이 당뇨 전 단계 고령자에게 뇌신경 가소성 인자들에 효과적인 것으로 나타나 고 령자들에게 규칙적인 저항성 운동이 추천되며, 추후 고령자임을 감안하여 질병발생기간에 따른 운동기간과 운동강도를 고려한 연구가 요구된다.
Notes
The authors declare that they do not have conflict of interest.
AUTHOR CONTRIBUTION
Conceptualization: D Kim; Data curation; Formal analysis; Funding acquisition; Methodology: D Kim; Project administration; Visualization; Writing-original draft; Writing-review & editing.