과거의 근력훈련 경험이 장기간 훈련중단 후 재훈련시 흰쥐 가자미근의 횡단면적과 단백질 함량에 미치는 영향
Abstracts
Purpose
This study tested the hypothesis that previous strength training episodes favorably contribute to muscular hypertrophic adaptations in rat soleus muscle after long-term detraining and retraining in rats.
Methods
Female Sprague-Dawley rats (n=24) aged 8 weeks were randomly assigned to four groups: control (CON), detraining (DT), strength training (ST), and retraining (RT). The strength training was a regular bout of ladder climbing exercise that consisted of three sets of five repetitions and three days per week for eight weeks. A cylinder containing weights was loaded to the bottom of each rat's tail. The weights carried during each training session were initially 50% of body weight and progressively increased by 10% per session. Rats in the DT underwent twenty weeks of detraining periods immediately after eight weeks of strength training. Rats in the ST were aged matched to the RT group and underwent eight weeks of strength training at the same duration with the RT group. Rats in the RT were conducted to the resistance training for eight weeks following the detraining period. Soleus muscles were collected at the end of the training episodes to examine alterations in cross-sectional area and protein contents.
Results
ST showed a significant increase in cross-sectional area of the rat soleus muscle, compared with CON. It was interestingly demonstrated that RT markedly elicited hypertrophy of soleus muscle, compared with all other groups. It was supported that RT-induced hypertrophy was related to increased myofibrillar protein contents of the soleus muscle.
Conclusions
These results suggest that although prolonged training cessation occurs previous strength training episodes have a positive impact on restoring muscular contractile properties and hypertrophy after retraining.
Keywords: Strength training, Detraining, Retraining, Cross-sectional Area, Protein contents
색인어: 근력훈련, 훈련중단, 재훈련, 횡단면적, 단백질 함량
서 론
많은 현대인들은 운동 및 신체활동 부족으로 인하여 여러 가지 건강상의 부작용을 경험하고 있으며, 그 중 근육량 감소로 인한 근력 및 근육 기능 저하는 질 높은 삶을 영위하는데 반드시 해결해야 할 문제이다[ 18]. 따라서 최근에는 심폐체력 향상을 위한 유산소 운동뿐만 아니라 골격근 발달을 위한 근력훈련(strength training)의 중요성이 남녀노소 모두에게 강조되고 있다[ 18]. 골격근은 인체에서 가소성(plasticity)이 가장 높은 조직 중 하나이며, 다양한 종류의 과부하(overloading) 자극 및 무부하(unloading) 자극에 대하여 구조적 또는 생리 · 화학적으로 쉽게 변화됨을 보여준다. 그 예로 근육량 증가를 의미하는 근비대(hypertrophy)는 저항성 운동과 같은 다양한 외부 자극에 대한 중요한 적응 현상이며, 근육량 감소를 의미하는 근감소(atrophy)는 신체활동 부족, 노화, 부상 및 근육 관련 질병(muscular dystrophy) 등에 의한 외부 자극의 감소에 의하여 발생한다. 특히, 근감소는 낙상 및 만성질환 등을 초래하므로 적당한 근육량 및 근력 유지는 노인뿐만 아니라 골격근의 손상 및 근육 관련 질환자, 장기간 침상생활을 하는 환자, 더 나아가 무중력 상태에 장시간 노출되는 우주인들에게 중요한 이슈 중 하나이다.
골격근을 구성하는 근육 섬유는 마이오신 중쇄(myosin heavy chain)의 아형(isoform)에 따라 다르게 구분되며[ 6], 근육 섬유의 종류에 따라 분명한 기능적, 대사적 차이를 갖는다. 가자미근(soleus muscle)은 대표적인 지근 섬유(slow-twitch fiber, Type I형)로 구분되며[ 25], 속근 섬유(fast-twitch fiber, type II형)에 비해 근력훈련에 대한 근비대 효과는 작지만, 근육 단백질 함량(protein contents)을 증가시켜 근육 크기의 증가를 가져올 수 있다[ 29]. 근비대에 가장 효과적인 방법을 찾기 위한 노력은 현재까지도 계속되고 있으며, 이를 위한 여러 가지 방법 중 전기적(electrical), 약리적(pharmacological), 생리적(physiological)인 자극과 함께 점진적인 근력훈련은 근육량과 근력을 증가시킬 수 있는 가장 효과적인 방법 중 하나로 손꼽히고 있다. 동물모델을 이용한 선행연구를 살펴보면, 근력훈련이 근육량과 근력뿐만 아니라 다양한 근수축 기능(contractile prop-erty)의 향상을 가져왔다고 보고하고 있으며[ 13, 25, 26], 이러한 근육량의 증가는 근육의 단백질 합성 증가에 의한 단백질 함량의 증가에 의한 것으로 밝혀졌다[ 29]. 그러나 이러한 선행연구들은 모두 전기적 자극을 사용하여 근육의 수축을 불수의적으로 유발하는 근력훈련 방법을 이용하거나, 식이요법 및 약물을 근력훈련과 병행하여 실시함으로써, 자발적인 근력훈련만의 효과라고 결론짓는 데에는 한계가 있다. 또한 근력훈련과 관련된 몇몇의 다른 선행연구에서는 근육량과 체중의 비율을 근비대의 척도로 사용하였는데[ 9, 20, 25], 이러한 연구들에 의하면 통제집단에 비하여 근력훈련 집단의 평균 체중이 운동에 의하여 감소한 것을 알 수 있다. 따라서 이와 같은 결과가 실제로 근육량의 증가에 의한 결과인지, 체중의 감소로 인한 상대적인 근육량의 증가인지를 명확하게 밝히는 것은 어렵다. 근력훈련 후 훈련중단(detraining)에 의한 근생리적 변화는 다양한 선행연구를 통해 확인해 볼 수 있다. 대표적인 결과로 근육 크기 감소[ 1, 10, 19], 근육을 지배(innervation)하는 운동신경의 감소[ 6, 7, 19], 최대 근력(maximal muscle strength) 감소[ 5, 7, 11, 19], 최대 근파워(muscular peak power) 감소[ 14, 18] 등의 변화를 들 수 있으며, 이는 훈련중단은 골 격근의 형태학적 변화(morphological alteration)와 생리적 기능(physiological function) 감소를 초래함을 의미한다[ 2]. 근육량 및 근기능 감소는 만성질환(예: 당뇨병) 및 정형외과적 질환(예: 낙상) 등으로 이어져 건강과 생명을 위협하므로 근력훈련의 중요성이 강조되고 있음에도 불구하고 운동지속성(exercise adherence)이 매우 낮으며, 일반 현장에서 근력훈련 중단 및 재훈련이 반복적으로 나타나므로 이와 같은 형태의 훈련 방법에 대한 근생리학적 연구의 필요성이 제기되고 있는 실정이다. 이에 선행연구에 따르면, 과거의 근력훈련 유경험은 그렇지 않은 경우에 비해 훈련중단(detraining) 후 재훈련(retraining) 시 근기능 회복(restoration) 및 적응(adaptation) 현상에 있어 매우 효과적임이 보고되고 있는며[ 23, 24], 이와 같은 현상을 일반적으로 “근육 기억(muscle memory)”이라고 일컫는다. 이러한 근육세포에서의 생리적 기능 유지에 관한 정확한 기전은 아직까지 명확히 밝혀진 바가 없으나, 과거의 훈련경험이 오랫동안 유지되는 이유는 중추신경계의 학습에 의한 것이라고 밝힌 연구 보고가 있다[ 23]. 또한 장기간의 훈련중단(prolonged detraining)에도 근비대(hypertrophy)가 유지되었다는 많은 연구결과가 발표되었으며[ 8, 11, 12, 17, 22, 23], 또 다른 선행연구에서는 근력훈련을 받은 노인들이 2년의 훈련중단에도 불구하고 일반인(근력훈련에 참여하지 않은 동일 연령대의 노인)에 비해 여전히 9–14%의 높은 근력을 보였음을 보고하였고[ 22], 약 30주간의 훈련중단(detraining)으로 과거 20주간의 트레이닝으로 얻었던 근력이 모두 소실되었지만, 6주간의 단기간의 재훈련(retraining)만으로도 훈련중단 전의 근력을 회복하는데 기여하였다고 보고하였다[ 23]. 이와 같은 연구 결과들은 “근육 기억(muscle memory) 기전”이 존재한다는 것을 보여주고 있다. 최근 연구에 의하면 근비대(hypertrophy) 과정을 통하여, 위성세포(satellite cell)로부터 만들어진 근핵(myonuclei)들은 장기간의 훈련중단에도 그 수가 줄어들지 않고 유지된다는 것이다[ 4]. 따라서 과거의 훈련경험이 재훈련(retraining)에 의한 근비대의 효과를 더욱 촉진시킬 수 있음을 의미한다. 그러나 근육 기억 기전이 다양한 근섬유에서 나타나는지를 밝힌 연구는 많지 않으며, 특히 대표적인 지근 섬유인 가자미근에서의 근력 재훈련에 따른 근육 특성 변화에 관한 연구는 매우 부족한 실정이다. 따라서 본 연구는 과거의 근력훈련 경험이 장기간의 훈련중단 후 재훈련시 가자미근의 횡단면적과 단백질 함량 변화에는 어떠한 영향을 미치는 지를 알아보는데 그 목적이 있다.
연구 방법
1. 실험동물
선행연구[ 16, 18]에 따라 8주령의(217.38±3.77 g) Sprague-Dawley (SD) 암컷 흰쥐 24마리(217.4±3.8 g)를 실험 전 일주일 동안 실험실 환경에 적응시킨 후, 각각 통제 집단(CON; n=6), 훈련중단 집단(DT; n=6), 근력훈련 집단(ST; n=6), 재훈련 집단(RT; n=6)으로 분류하였다. 실험동물은 전 실험기간을 통하여 고형 사료와 물을 자유롭게 섭취하도록 하였으며, 실내 온도는 22–24℃, 습도는 60%가 유지되며, 밤낮주기가 12시간 간격으로 자동 조절되는 실험실 환경에서 사육하였다. 모든 운동 처치 및 실험은 텍사스 A&M 국제대학교의 동물실험윤리위원회(Institutional Animal Care and Use Committee, IACUC)의 승인 하에 이루어졌다.
2. 실험 절차 및 방법
통제집단(CON)에게는 36주간 어떠한 운동 처치도 취하지 않았고, 훈련중단 집단(DT)에게는 8주간의 근력훈련 후 20주 동안 운동 처치를 중단하였으며, 중단 직후 실험에 참여하였다. 근력훈련 집단(ST)은 28주간 운동 처치없이 사육된 후 8주간의 근력훈련 직후 실험에 참여하였으며, 재훈련 집단(RT)은 8주간의 근력훈련 후 20주간의 훈련중단 기간을 거쳐 8주간의 재훈련 실시 후 실험에 참여하였다. 전체적인 실험 절차는 Fig. 1과 같다.
Fig. 1.
Fig. 1.Experimental procedure. CON, Control; DT, Detraining; ST, Strength training; RT, Retraining. 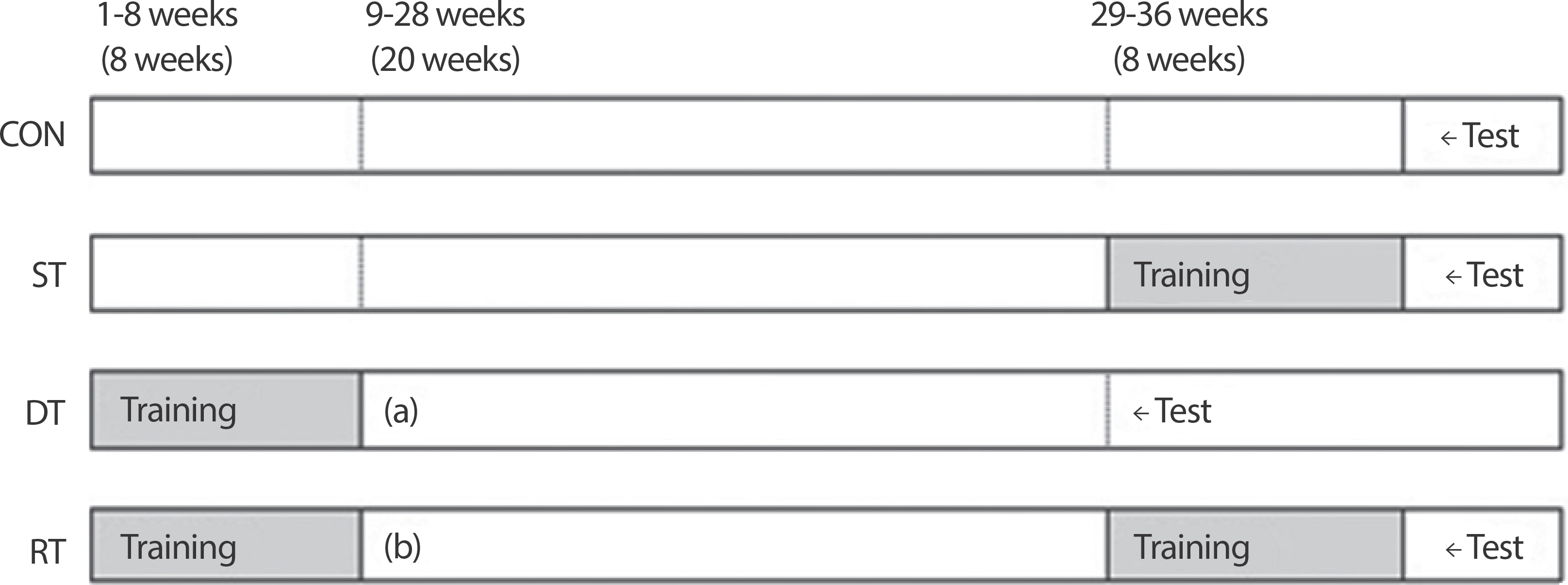
1) 근력훈련 프로토콜
근력훈련은 사다리 오르기(ladder climbing)를 이용하였으며, 근력훈련 프로토콜은 선행연구[ 15, 16]에서 실시한 방법과 동일하게 진행되었다. 근력훈련은 계획된 일자에 정확하게 실시되었으며, 주 3회, 8주간 실시하였다. 근력훈련을 위한 사다리의 총 길이는 1 m, 사다리 칸 사이의 간격은 2 cm, 그리고 경사도는 85°를 유지하도록 제작하였다( Fig. 2). 훈련 시작 전 사다리 오르기 운동에 적응하기 위하여 3일간은 꼬리에 무게를 달지 않은 상태에서 오르는 연습을 실시하였다. 근력 훈련의 운동 강도를 점진적으로 증가시키기 위해 흰쥐의 꼬리 중간에 부착할 실린더를 제작하였고, 꼬리에 상처가 발생하지 않도록 부드러운 천으 로 제작된 테이프(3M Conan)와 Velcro Strap을 부착하였다( Fig. 2). 모든 훈련은 5회의 사다리 오르기 운동을 1세트로 간주하여 총 3세트로 이루어졌으며, 사다리 오르기 시도 후에는 1분간의 휴식이 주어졌고, 세트 간 휴식 시간은 2분이 주어졌다. 근력훈련의 강도를 결정하는 실린더의 무게는 최초 체중의 50%의 무게로 시작하여, 매번 훈련마다 체중의 10% 무게를 점진적으로 증가시켜 실시하였다. 만일 사다리 오르기에 실패하게 되면 직전 훈련시의 무게를 부착하여 실시하였다. 사다리 오르기 동기 부여를 위해 필요에 따라 전기자극(0.2–0.3 mA)을 사용하였고, 3회간의 연속적인 꼬리 자극에도 오르지 않을 경우에는 사다리 오르기 운동을 중단하였다.
Fig. 2.
Fig. 2.Ladder climbing exercise. 
2) 훈련중단(detraining)과 재훈련(retraining)
Fig. 1과 같이 훈련중단 집단(DT)과 재훈련 집단(RT)의 모든 실험 동물은 최초 8주간의 근력훈련 실시 후 20주간 어떠한 운동도 실시하지 않는 훈련중단(detraining)을 (a), (b)와 같이 실시하였다. 훈련중단 기간 동안 흰쥐의 체중을 주 1회 측정하였으며, 집단 간의 체중 균형을 맞추기 위하여 필요에 따라서는 사료의 섭취를 적절하게 조절하였다. 20주간의 훈련중단 후 재훈련 집단(RT)의 모든 쥐들은 근력훈련 집단 (ST)과 함께 근력훈련 프로토콜에 따라 동일한 방법으로 8주간의 사다리 오르기 운동을 실시하였다.
3) Hematoxylin & Eosin staining
이 연구에서는 각 집단별 근육의 횡단면적 변화를 측정하기 위해 Sprague Dawley 쥐의 가자미근(soleus muscle)을 적출하여 Hematoxylin & Eosin staining을 실시하였다. OCT compound에 몰딩 처리된 가자미근 1/2 지점의 횡단면을 10 μm 두께로 cryosection 하여 slide glass 에 고정하였다. 근육은 100% 에탄올에 1분간 고정 후 증류수에 세척과정을 거치고 Hematoxylin 용액에 약 8분간 처치하여 근세포 핵을 염색하였다. 이후 증류수로 세척하고 다시 95% 에탄올에 세척 · 탈수 처리 후 Eosin Y 솔루션에 1분간 처치하여 근세포질을 염색하였다. 최종적으로 에탄올에 탈수처리 후 Xylene 용액에 고정하였다. 횡단면적의 관찰과 분석은 NIH Image J 프로그램을 통해 실시하였다.
4) 총 단백질량과 근원섬유 단백질량 측정
가자미근의 총 단백질량과 근원섬유 단백질량 측정을 위해 가자미근 샘플을 8.5% sucrose, 50 mM KCl, 5 mM EGTA, 100 mM MgCl2 혼합용액에 넣어 polytron blade homogenizer로 균질화 하였다. 균질액의 일부는 Bradford assay (Bio Rad Laboratories, Hercules, CA, USA)를 통해 총단백질량 측정에 이용하였으며, 균질액의 남은 부분은 4℃ 온도에 2,500 rpm의 속도로 15분간 원심분리 후 침전물은 100 mM KCl, 5 mM EGTA, 5 mM MgCl2, 0.1% Triton X-100 혼합용액에 풀어 다시 10분간 2,500 rpm 속도로 원심분리 하는 과정을 총 3회 실시하였다. 최종 침전물은 150 mM KCl, 50 mM tris (hydroxymethyl) aminomethane 혼합용액에 풀어 Bradford assay를 통해 근원섬유 단백질량 측정에 이용하였다.
3. 자료 처리
이 실험에서 얻은 자료는 SPSS 통계 프로그램(IBM SPSS Statistics Version 25)을 이용하여 처리하였다. 측정된 결과들은 각 항목에 대한 평균(mean)과 표준오차(standard error of the mean)를 산출하였다. 집단 간의 차이 검정은 분산분석(analysis of variance, ANOVA)을 이용하였으며, 구체적인 유의차는 LSD 사후검정(post-hoc test)을 사용하여 분석하였다. 유의수준은 .05로 설정하였다.
연구 결과
1. 가자미근(Soleus muscle)의 횡단면적(cross-sectional area; CSA) 변화
Fig. 3은 각 집단의 가자미근 횡단면적을 보여주고 있다. 훈련중단 집단(DT: 12,751.63±192.39 A.U. [arbitrary unit])과 근력훈련 집단(ST: 13,199.4±194.52 A.U.)이 통제집단(CON: 12,153.3±192.77 A.U.)에 비하여 각각 통계적으로 큰 횡단면적을 나타냈으며( p <.05, p <.001), 재훈련 집단(RT: 14,055.43±205.02 A.U.)은 나머지 모든 집단에 비하여 각각 통계적으로 큰 횡단면적을 나타냈다( p <.001, p <.01, p <.05).
Fig. 3.
Fig. 3.Cross sectional area of rat soleus muscle. Myofibers of soleus were visualized by H & E staining (Magnification= ×10) and analyzed cross sectional area using NIH Image J. Bar graph represented means±S.E. for n=3 each group. CON, Control; DT, Detraining; ST, Strength training; RT, Retraining. Scale bar=100 µm. The data were analyzed using one-way ANOVA followed by a post-hoc test with Least Significant Difference (LSD) method. * p<.05, ** p<.01, *** p<.001. 
2. 총 단백질량(total protein contents)과 근원섬유 단백질량 (myofibrillar protein contents)의 변화
Table 1과 Fig. 4는 가자미근의 총 단백질량과 근원섬유의 단백질량 을 나타낸 것이다. 각 집단 간 총 단백질량은 재훈련 집단(RT: 45.9±4.2 mg/g), 통제집단(CON: 44.5±3.8 mg/g), 근력훈련 집단(ST: 42.5±2.2 mg/g), 훈련중단 집단(DT: 41.7±2.6 mg/g) 순으로 나타났으나, 집단 간 유의한 차이는 나타나지 않았다. 근원섬유의 단백질량에서는 재훈련 집단(RT)이 35.1±4.0 mg/g으로 22.8±1.6 mg/g인 통제집단(CON)과 23.6±3.4 mg/g인 훈련중단 집단(DT)에 비하여 유의하게 높게 나타났으며( p <.001), 28.9±2.0 mg/g인 근력훈련 집단(ST)에 비하여 높게 나타났으나 통계적인 유의차는 나타나지 않았다.
Table 1.
Total and myofibrillar protein contents of rat soleus muscle
|
Variables |
CON |
DT |
ST |
RT |
|
Total protein contents (mg/g) |
44.5±3.8 |
41.7±2.6 |
42.5±2.2 |
45.9±4.2 |
|
Myofibrillar protein contents (mg/g) |
22.8±1.6 |
23.6±3.4 |
28.9±2.0 |
35.1 ±4.0†,*
|
Fig. 4.
Fig. 4.Total and myofibrillar protein contents of rat soleus muscle. Bar graph represented means±S.E. for n=3 each group. CON, Control; DT, Detraining; ST, Strength training; RT, Retraining. The data were analyzed using one-way ANOVA followed by a post-hoc test with Least Significant Difference (LSD) method. * p<.05 vs. CON; † p<.05 vs. DT. 
논 의
이 연구는 흰쥐를 대상으로 수의적인 사다리 오르기를 이용한 8주간의 근력훈련 후 20주간의 훈련중단을 거쳐 다시 8주간의 재훈련을 하였을 때, 대표적인 지근 섬유인 가자미근의 횡단면적과 단백질 함량에 어떠한 변화가 나타나는 지를 과학적으로 검증한 것이다. 실험 동물, 절차, 운동 및 휴식기 설정 등은 선행연구[ 16, 18]를 참고하였으며, 근력훈련은 흰쥐가 중력을 거슬러 사다리를 자발적으로 오르려는 특성을 이용한 사다리 오르기를 근력훈련 방법으로 사용하였다. 실험 결과, 20주간의 훈련중단 후에도 불구하고 가자미근의 횡단면적은 통제집단에 비해 유의하게 큰 것으로 나타났다. 이러한 결과에 대하여 다음의 가능성을 생각해 볼 수 있는데, 첫째, 지근 섬유인 Type I형의 횡단면적은 20주간의 장기간 훈련중단에도 큰 변화가 나타나지 않을 수 있다는 것이다. 이는 20주간의 훈련중단 후 8주간의 재훈련시 가자미근의 무게의 변화를 확인한 선행 연구결과와도 일치하였다[ 18]. 둘째, 사다리 오르기 운동은 흰쥐의 하지근육 중 가자미근이 주동근으로 사용되지 않았을 수도 있다는 점을 생각해 볼 수 있다. 많은 동물 실험에서 사용되고 있는 저항성 운동용 사다리( Fig. 2)는 흰쥐 하지의 발끝에 부하가 가해지도록 제작되었기 때문에 운동 중 자극을 받을 수 있는 주요 근육은 긴 발가락굽힘근(flexor hallucis longus, FHL)이 될 가능성이 제기된다. 따라서, 사다리를 이용한 근력훈련에 따른 FHL 근형태 및 근기능 변화에 대한 추후 연구가 필요할 것으로 판단된다. 셋째, 다른 선행연구를 보더라도 훈련중단에 따른 근력 및 근육량의 변화는 지구력 훈련중단 후 나타나는 심폐지구력 감소비율에 비하여 보다 느리게 나타나며, 특히 Type I형 섬유가 Type II형 섬유에 비하여 훈련중단 후 횡단면적의 변화가 훨씬 적게 나타났다는 것이다[ 26]. 실제로 Staron et al. (1991)의 연구에서도 20주간의 근력훈련 후 30주간의 훈련중단에서 최대근력은 31% 감소하였으나, Type I 섬유의 횡단면적은 2%밖에 감소하지 않은 것으로 보고하였다. 이는 10–14%까지 감소한 Type II 근섬유의 변화와는 큰 차이가 있는 것을 의미하며, 본 연구에서 발견한 결과 또한 선행연구와 일치하는 것으로 판단된다. 또한 이 연구에서는 재훈련 집단이 근력훈련 집단에 비해 8주라는 같은 훈련기간에도 불구하고 근육의 횡단면적에서 통계적으로 유의한 증가를 가져왔는데, 이는 “근육 기억(muscle memory)”의 기전을 확립한 선행연구와 일치한다고 사료된다. 즉, 처음 8주간의 근력훈련 경험을 통해 동원된 위성세포(satellite cell)의 수는 장기간의 훈련중단 후에도 유지되며, 이것은 근육세포 내 핵(nucleus) 분열 촉진을 통해 핵의 수를 증가시킴으로써 근육 섬유의 횡단면적을 유의하게 증가시키는데 기여한 것으로 설명될 수 있다[ 31]. 그리고 최초의 근력훈련을 통해 얻어진 근육 세포 핵의 수는 장기간의 훈련중단에 따른 근육 횡단면적 의 감소에 따라 현저하게 줄어들지 않고 유지되며, 재훈련 시 유지되었던 핵의 수에 의해 보다 쉽게 근육 섬유의 비대를 나타낼 수 있다는 선행연구와도 일치한다고 볼 수 있다[ 4]. 또한 이번 연구결과, 각 집단 간 총 단백질량의 변화는 유의한 차이가 나타나지 않았으나, 근원섬유 단백질량에서는 재훈련 집단이 통제집단과 훈련중단 집단에 비해 유의하게 높은 차이를 보였다. 이는 비록 재훈련 집단이 근련훈련 집단에 비하여 높은 경향을 나타냈지만, 통계적으로 유의한 차이가 나타나지 않은 것은 Type I형 섬유라는 특수성에 기인한 것이라 사료된다. 추후 Type II형 섬유의 변화를 분석하는 연구가 추가로 이루어진다면, 다른 연구결과를 나타낼 수도 있을 것이라 판단된다. 또한 본 연구에서 도출된 연구결과는 흰쥐의 성별에 영향을 받은 것으로 사료된다. 근력훈련에 따른 근비대 및 근력 증가는 내분비계(예: 테스토스테론, 인슐린 유사 성장인자-1 등)의 중추적인 역할과 매우 밀접한 관련이 있다. 본 연구에서 사용된 흰쥐 암컷의 성호르몬 및 성장호르몬 분비는 가자미근의 단백질 합성에 크게 기여하지 못한 것으로 판단되며, 추후 수컷 흰쥐를 이용한 연구를 통해 성별에 따른 근력훈련 중단의 영향과 재훈련에 따른 변화를 확인할 필요가 있을 것이다.
근력훈련은 액틴과 마이오신을 포함한 근원섬유 단백질량의 증가를 가져오며, 이는 결국 근육의 횡단면적 증가와 연결될 수 있다. 근원섬유인 액틴과 마이오신 필라멘트의 증가는 근절(sarcomere)의 수를 증가시키며, 이러한 근절의 증가는 결국 근육 섬유의 비대를 이끌어 낼 수 있다[ 34]. 또한 근원섬유 단백질의 증가는 결국 근육 섬유 안에서 액틴과 마이오신의 십자형가교(cross-bridge)의 수를 증가시켜 근육의 수축기능 및 수축력을 증가시키게 될 것이다. 근력훈련은 Type I형 섬유와 Type II형 섬유의 크기를 모두 증가시킬 수 있으나, 특별히 Type I형 섬유에 비하여 Type II형 섬유의 비대(hypertrophy)를 보다 쉽게 가져올 수 있다고 알려져 있는데[ 32, 33], 이와 같은 과학적 지식을 바탕으로 근섬유의 형태별 근력훈련의 효과와 근수축력 및 장력(tension) 등 기능 변화를 검증하는 연구가 추후 이루어져야 할 것이다. 더불어 “근육 기억”에 관한 분자생물학적 기전연구(mechanistic study) 또한 절실히 필요할 것으로 사료된다.
결 론
이 연구는 근력훈련 경험이 장기간의 훈련중단 후 재훈련시 흰쥐 가자미근의 근육 횡단면적과 단백질함량의 변화에 미치는 영향을 검증한 것이며, 실험결과 8주간의 근력훈련 경험은 20주간 훈련을 중단하더라도, 재훈련시 근력훈련 집단에 비하여 많은 근원섬유 단백질의 증가를 가져올 수 있었고, 이는 보다 큰 근육 횡단면적의 증가를 가져왔음을 확인할 수 있었다.
REFERENCES
1. Andersen JL, Aagaard P. Myosin heavy chain IIX overshoot in human skeletal muscle. Muscle Nerve.. 2000;23(7):1095-104.   2. Andersen LL, Andersen JL, Magnusson SP, Suetta C, Madsen JL, et al. Changes in the human muscle force-velocity relationship in response to resistance training and subsequent detraining. J Appl Physiol.. 2005;99(1):87-94.  5. Colliander EB, Tesch PA. Effects of detraining following short term resistance training on eccentric and concentric muscle strength. Acta Psychiatr Scand.. 1992;144(1):23-9.  7. Hakkinen K, Alen M, Komi PV. Changes in isometric force- and relaxation-time, electromyographic and muscle fibre characteristics of human skeletal muscle during strength training and detraining. Acta Psychiatr Scand.. 1985;125(4):573-85.  8. Hakkinen K, Komi PV. Electromyographic and mechanical characteristics of human skeletal muscle during fatigue under voluntary and reflex conditions. Clin Neurophysiol.. 1983;55(4):436-44.  9. Harris C, DeBeliso M, Adams KJ, Irmischer BS, Spitzer Gibson TA. Detraining in the older adult: effects of prior training intensity on strength retention. J Strength Cond Res.. 2007;21(3):813-8.   10. Ho KW, Roy RR, Tweedle CD, Heusner WW, Van Huss WD, et al. Skeletal muscle fiber splitting with weight-lifting exercise in rats. Dev Dyn.. 1980;157(4):433-40.  11. Hortobagyi T, Houmard JA, Stevenson JR, Fraser DD, Johns RA, et al. The effects of detraining on power athletes. Med Sci Sports Exerc.. 1993;25(8):929-35.  12. Houston ME, Froese EA, Valeriote SP, Green HJ, Ranney DA. Muscle performance, morphology and metabolic capacity during strength training and detraining: a one leg model. Eur J Appl Physiol.. 1983;51(1):25-35.   13. Ivey FM, Tracy BL, Lemmer JT, NessAiver M, Metter EJ, et al. Effects of strength training and detraining on muscle quality: age and gender comparisons. J Gerontol.. 2000;55(3):152-9.   14. Klitgaard H, Zhou M, Richter EA. Myosin heavy chain composition of single fibres from m. biceps brachii of male body builders. Acta Psychiatr Scand.. 1990;140(2):175-80.  15. Kraemer WJ, Koziris LP, Ratamess NA, Hakkinen K, Triplett-McBride NT, et al. Detraining produces minimal changes in physical performance and hormonal variables in recreationally strength-trained men. J Strength Cond Res.. 2002;16(3):373-82.  16. Lee S, Barton ER, Sweeney HL, Farrar RP. Viral expression of insulinlike growth factor-I enhances muscle hypertrophy in resistance-trained rats. J Appl Physiol.. 2004;96(3):1097-104.  17. Lee S, Farrar RP. Resistance training induces muscle-specific changes in muscle mass and function in rat. J Exerc Physiol Online.. 2003;6:80-7.
19. MacDougall JD, Elder GC, Sale DG, Moroz JR, Sutton JR. Effects of strength training and immobilization on human muscle fibres. Eur J Appl Physiol.. 1980;43(1):25-34.   20. Mujika I, Padilla S. Muscular characteristics of detraining in humans. Med Sci Sports Exerc.. 2001;33(8):1297-303.   21. Narici MV, Roi GS, Landoni L, Minetti AE, Cerretelli P. Changes in force, cross-sectional area and neural activation during strength training and detraining of the human quadriceps. Eur J Appl Physiol.. 1989;59(4):310-9.   22. Roy RR, Wilson R, Edgerton VR. Architectural and mechanical properties of the rat adductor longus: response to weight-lifting training. Anat Rec.. 1997;247(2):170-8.   23. Rutherford OM, Jones DA. The role of learning and coordination in strength training. Eur J Appl Physiol.. 1986;55(1):100-5.   24. Smith K, Winegard K, Hicks AL, McCartney N. Two years of resistance training in older men and women: the effects of three years of detraining on the retention of dynamic strength. Can J Appl Physiol.. 2003;28(3):462-74.   25. Soukup T, Zacharova G, Smerdu V. Fibre type composition of soleus and extensor digitorum longus muscles in normal female inbred Lewis rats. Acta Histochem.. 2002;104(4):399-405.   26. Staron RS, Leonardi MJ, Karapondo DL, Malicky ES, Falkel JE, et al. Strength and skeletal muscle adaptations in heavy-resistance-trained women after detraining and retraining. J Appl Physiol.. 1991;70(2):631-40.  27. Taaffe DR, Marcus R. Dynamic muscle strength alterations to detraining and retraining in elderly men. Clin Physiol Funct Imaging.. 1997;17(3):311-24.  28. Tamaki T, Uchiyama S, Nakano S. A weight-lifting exercise model for inducing hypertrophy in the hindlimb muscles of rats. Med Sci Sports Exerc.. 1992;24(8):881-6.   29. Trappe TA, Raue U, Tesch PA. Human soleus muscle protein synthesis following resistance exercise. Acta Psychiatr Scand.. 2004;182:189-96.  30. Wong TS, Booth FW. Skeletal muscle enlargement with weight-lifting exercise by rats. J Appl Physiol.. 1988;65(2):950-4.  32. Kraemer WJ, Deschenes MR, Fleck SJ. Physiological adaptations to resistance exercise: implications for athletic conditioning. Sports Med.. 1988;6:246-56.   33. Tesch PA. Skeletal muscle adaptations consequent to long-term heavy resistance exercise. Med Sci Sports Exerc.. 1988;20:132-4.  34. Folland JP, Williams AG. The adaptations to strength training: morphological and neurological contributions to increased strength. Sports Med.. 2007;37:145-68.  
|
|









