지구성 운동에 의한 AMPK 활성은 MEF2A 통하여 PPARβ/δ의 발현을 조절한다
Abstract
PURPOSE:
The aim of this study was to identify whether the increased PPARβ/δ gene expression induced by exercise is mediated by activation of AMPK and MEF2A.
METHODS:
To analyze PPARβ/δ mRNA, rat triceps muscles were dissected immediately after a single bout of swimming exercise, and constitutively active (CA) AMPK over expressed L6 rat skeletal muscle cells were harvested. MEF2A activation by AMPK was analyzed by a Gal4 and green fluorescence system in the L6 cells. Dominant negative AMPK was over expressed in rat tibialis anterior (TA) using electrical pulse-mediated gen transfer (electroporation [EPO]) method before 2 weeks swimming exercise.
RESULTS:
PPARβ/δ mRNA in rat TA muscle after exercise was increased by 5.5 fold compared with the sedentary muscle, and was increased by 6.7 fold in the CA-AMPK over expressed cells compared with the empty vector (EV) treated cells. MEF2A-Gal4 was activated by a 1.9 fold in the L6 cells transfected with CA-AMPK constructs. AMPK and HDAC5 phosphorylation, and PPARβ/δ expres-sion were increased 3.2, 2.8, and 2.1 fold, respectively, by exercise in EV treated muscle, but were not increased by exercise in DN-AMPK over expressed muscle.
CONCLUSIONS:
MEF2A activation by AMPK increases the PPARβ/δ expression in endurance exercised muscle.
색인어: 지구성 운동, AMPK, HDAC5, MEF2A, PPARβ/δ
Keywords: Endurance exercise, AMPK, HDAC5, MEF2A, PPARβ/δ
서론
지구성 운동은 골격근 미토콘드리아의 산화적 효소 증가를 통하여 근지구력을 향상시킨다[ 1]. 지구성 운동에 의한 골격근의 미토콘드리아 생합성은 많은 전사인자들 상호작용에 의하여 진행되며, peroxisome proliferator-activated receptor gamma coactivator 1-α (PGC-1α)는 이러한 전사인자들을 조절한다[ 2- 4]. Peroxisome proliferator-activated receptor (PPAR) β/δ는 지방산에 의하여 활성화되는 핵수용체로서[ 5], PGC-1α의 공활성(co-activation) 없이도 nuclear respiratory factor (NRF)-1의 발현을 조절하여[ 6] NADH dehydrogenase와 succinate-ubiquinone oxidoreductase (SUO)와 같은 일부 미토콘드리아 효소의 발현을 증가시킬 수 있으며[ 7], MEF2A 활성을 통한 GLUT4의 발현을 조절한다[ 6]. 특히 PPARβ/δ는 지구성 운동에 의하여 증가한 PGC-1α 안정성을 증가시키며, 이는 골격근 내 미토콘드리아 효소를 증가시킨다[ 8- 10]. 따라서 지구성 운동에 의한 PPARβ/δ의 발현은 골격근 적응의 핵심 요소로 간주된다. 그러나 지구성 운동에 의한 PPARβ/δ 발현이 어떠한 기전으로 유도되는지 확인되지 않았다. Myocyte enhance factor2 (MEF2)는 다른 특성을 지닌 4개의 일원(MEF2A, MEF2B, MEF2C 그리고 MEF2D)으로 구성되어 있으며, 전사인자이다[ 11]. MEF2는 세포 외부신호를 목표 유전자에 전달하여 세포의 분화, 증식, 형태 발생(morphogenesis), 생존 및 세포사멸(apoptosis)을 조절하는 유전자 프로그램을 활성화시킨다[ 11]. MEF2는 외부 자극이 주어지지 않으면 Histone deacetylase (HDAC) 4와 HDAC5에 의하여 억제되어 있다[ 12, 13]. 근수축에 의한 칼슘(calcium) 및 AMP:ATP의 비율 증가는 골격근 적응을 유도하는 주요 인자이며, AMP-activated protein kinase (AMPK)는 세포의 에너지 항상성을 위해 Adenosin monophosphate (AMP)의 농도를 모니터링한다[ 14, 15]. 근수축은 AMPK 활성 loop에 있는 T-172의 인산화를 통하여 AMPK의 활성을 증가시키는데[ 16- 21], 이는 HDAC4와 5를 인산화하여 MEF2A로부터 HDACs를 분리시키며[ 12, 22], MEF2는 활성화되어 목표 유전자의 전사를 가능하게 한다[ 12, 23]. 그러나 Gan et al. [ 24]은 AMPK가 MEF2A를 직접 활성화시킬 수 없으며 PPARβ/δ와 협력하여 MEF2A를 활성화시킨다고 하였다. 따라서 선행연구들의 의견이 일치되지 않고, HADCs를 분석하는 간접적 방법으로 MEF2A의 활성을 분석하였으므로 본 연구는 Gal4/UAS system으로 AMPK가 MEF2A를 직접 활성화시키는지 확인하였다. PPARβ/δ의 프로모터(promoter)에는 MEF2 반응 요소(CTATTTTAGGTGAAT)가 있다. 이는 AMPK가 MEF2A를 활성화시켜 PPARβ/δ promoter에 결합해 PPARβ/δ mRNA 전사를 조절할 가능성을 나타내므로 본 연구는 AMPK 활성이 PPARβ/δ mRNA 발현을 증가시키는지 확인하였다. AMPK 활성에 의한 결과가 지구성 운동에서도 동일하게 나타나는지 확인하기 위하여 지구성 운동을 실시하는 Wistar rat의 왼쪽 tibialis anterior (TA) 근육에서 AMPK 활성이 억제되도록 하였으며, 운동 후 PPARβ/δ 발현을 살펴보았다. 본 연구의 결과들은 지구성 운동에 의한 PPARβ/δ 발현이 어떠한 기전으로 유도되는지 설명할 수 있을 것이다.
연구 방법
1. 실험 동물과 시료의 준비
실험동물은 약 50 g의 3주령 수컷 Wistar rat 28마리를 구입하여 이용하였다. 이 중 12마리(좌업군 n = 6; 운동군 n = 6)는 지구성 운동에 의한 mRNA를 분석하기 위한 것이며, 1회 지구성 운동 직후 Triceps 근육을 각각 적출하였다. 나머지 16마리는 AMPK 활성을 감소시키기 위하여 전기자극을 이용한 유전자 전이법(electroporation, EPO) [ 25]으로 dominant negative (DN) AMPK와 empty vector (EV, control gene)를 각각 좌우측의 tibialis anterior (TA) 근육에 2회 과발현시켰다. 유전자 도입한 대상은 2주 후 각각 8마리씩 좌업 그룹(Sededantary, Sed)과 1회 수영 운동 그룹(Exercise, Ex)으로 무작위 분류하여 1회 운동 후 18시간 뒤 근육을 적출하였다. Wistar rat은 한 케이지에 2마리씩 사육하였으며, Purina chow (Purina, USA)를 물과 함께 자유롭게 섭취하도록 하였다. 사육실 온도는 21˚C로 유지하였으며, 명기(06:00-18:00)와 암기는 각각 12시간으로 조절하였다. 본 연구는 Animal Studies Committee of Washington University School of Medicine에 의해 승인되었다.
2. 운동 프로그램
수영 운동은 Terada et al. [ 26]의 방법을 일부 수정하여 1회 수영 운동을 실시하였다. 본 연구에서 실시하는 수영 운동의 강도는 speed 13 m/min, grade 0%의 트레드밀 달리기와 유사한 장시간 저강도의 운동[ 26, 27]이다. 본 운동 전 물에 대한 적응훈련은 하루 15분간 2회 실시하였다. 본 운동은 3시간씩 1회 실시하였으며, 첫 번째 운동 후 45분간 휴식을 취하도록 하였으며, 이 시간 동안 자유롭게 물과 사료를 섭취할 수 있도록 하였다. 수영은 원통형 수조(80 cm×120 cm, 수심 50-60 cm)에 4마리씩 넣어 자유롭게 수영하도록 하였다. 수온은 35˚C로 일정하게 유지하였다.
3. 세포 처치
PPARβ/δ mRNA와 MEF2A 활성을 분석하기 위하여 rat의 근세포인 L6 (ATCC, USA)를 이용하였다. 세포는 10% Fetal bovin serum (FBS) (Gibco, USA), penisillin G (100 μU/mL), streptomycin (100 μU/mL), 0.5% Chick Embryo Extract (US Biological, USA)를 함유하고 있는 Dulbecco’s Modified Eagle’s medium (DMEM) (Sigma, USA)을 이용하여 5% CO2가 공급되는 37˚C의 환경(cell incubator)에서 배양하였다[ 8]. mRNA를 분석하기 위한 세포는 6 well tissue culture plate 2개(EV: n = 6, CA-AMPK: n = 6)에 분주(약 0.3×106 /well)한 후 약 70-90% confluence에 도달하였을 때 Lipofectamine transfection reagent (Invitrogen, USA)를 이용하여 CA-AMPK 또는 EV를 각각 형질주입하였다. 72시간 후 배지를 제거하고 배양한 세포를 수확하였다. MEF2A-Gal4의 활성을 분석하기 위하여 6 well tissue culture plate 2개(EV: n = 6, CA-AMPK: n = 6)를 이용하였으며, 모든 well에 MEF2A-Gal4, Gal4-pZs-Green, DsRed를 처치하였으며, 각각 6 well에 EV 또는 CA-AMPK를 처치하였다. 처치 72시간 후 세포를 수확하였다. 수확한 세포는 microplate reader (Biotek, USA)를 이용하여 GFP와 DsRed의 발광 강도를 측정하였으며, DsRed의 발광 강도는 GFP의 발광 강도의 표준화를 위해 이용하였다.
4. 유전자 제작
pCMX Gal4 vector (Addgene, USA)에 MEF2A plasmid (Addgene, USA)를 삽입하여 MEF2A-Gal4 유전자를 제작하였으며, pZsGreen 1.1 vector (Addgene, USA)에 Gal4 response element (Addgene, USA)를 삽입하여 Gal4-pZsGreen을 제작하였다. Constitutively active (CA) AMPK와 pAMPKα2 K45R (Addgene, USA)을 각각 pcDNA3.1/V5-His vector에 삽입하여, pcDNA3.1/CA-AMPK/V5-His와 pcDNA3.1/DNAMPK/V5-His를 제작하였다.
Cloning 산물은 E. coli (One Shot ®TOP10 Competent Cell, Invitrogen, USA)를 이용하여 형질전환(transform)하였다. Agar-plate에서 하나의 colony를 골라 4 mL의 LB broth를 이용하여 plasmid를 증폭하였으며, plasmid mini-prep kit (Qiagen, USA)로 plasmid DNA를 정제하였다[ 8].
5. Semiquantitative-PCR
약 20 mg의 근육을 1 mL TRIzol (invitrogen)을 이용하여 균질화하였으며, 200 μL chloroform을 첨가하였다. Phage seperating Gel tube (Phase-Lock-Gel, 5Prime, USA)로 옮겨 담아 5분간 상온에서 배양하고, 11,000 g 4˚C에서 10분간 원심분리하였다. 분리된 샘플은 새로운 tube로 옮겨 isopropyl alcohol 0.4 mL을 첨가하여 10분간 상온에서 배양 후 11,000 g 4˚C에서 10분간 원심분리하였다. 상층액을 제거한 후 75% EtOH로 pellet을 세척하기 위하여 11,000 g 4˚C에서 5분간 원심분리하였다. Alcohol을 제거하고 50 μL DNase digestion regents (Ambion, USA)를 첨가하여 37˚C에서 30분간 배양하였다. 0.1 volume DNase 비활성 시약을 첨가하여 2분간 배양하였으며, 10,000 g 4˚C에서 2분간 원심분리하였다. Alcohol precipitation을 실시한 후 RNA 농도(260/280 ≤ 1.8, 230/260 ≤ 2.0)를 측정하였으며[ 7], PPARβ/δ (F: 5'-TTCCAGCAGCTGCACAGACC-3'; R: 5'-CGTGGACCCCGTAGTGGAAG-3')와 18S (F: 5'-GACCATAAACGATGCCGACT-3'; R: 5'-AGACAAATCGCTCCACCAAC-3') Primer를 이용하여 PCR을 실시한 후 전기영동하였다.
6. Western blotting
근육은 ice-cold buffer (50 mmol/L Tris-HCl [pH 7.4], 1% NP-40, 0.25% sodium deoxycholate, 150 mmol/L NaCl, 1 mmol/L EDTA, 1 mmol/L phenylmethylsulfonyl fluoride, 1 mmol/L NaF, 1 μg/mL aprotinin, 1 μg/mL leupeptin, 1 μg/mL pepstatin, 0.1 mmol/L bpV [phen], 2 μg/mL β-glycerophosphate)를 이용하여 균질화하였다[ 7]. 균질화된 시료는 동결과 해동 과정을 3회 반복하고, 10분간 원심분리(1,500×g, 4˚C)하여 상층액을 사용하였다. 단백질 농도는 Lowry et al. [ 28]의 방법으로 정량하였다. 정량된 시료는 laemmli sample buffer (100 mM dithiothreitol 함유)를 첨가하여 5분간 가열하여 용해하였다 준비된 시료는 SDS-polyacrylamide gel을 이용하여 전기영동하고, nitrocellulose membrane에 전이(transfer)하였다. Membrane은 5% nonfat dry milk로 1시간 동안 block하고, TBST (TBS + 0.1% Tween-20, pH 7.5)로 세척한 다음 일차항체와 함께 배양하였다[ 8]. 일차항체는 다음과 같다. PPARβ/δ (Santacruz, USA), AMPK (Cell signalling, USA), pAMPK (Cell signaling), β-actin (Sigma, USA). 이차항체는 Horseradish peroxidase (HRP)-conjugated donkey anti-rabbit Ig (for PPARβ/δ, pAMPK)와 donkey anti-mouse IgG (for AMPK, β-actin)는 Jackson ImmunoResearch Laboratories (USA)에서 구매하였다. Band의 시각화는 ECL (Amersham)을 이용하였으며, band의 상대적 강도는 sigmaGel (Jandel Scientific Corp., Erkrath)을 이용하였다.
7. 자료처리방법
수집된 자료는 SigmaPlot 12.0 통계패키지를 이용하여 측정항목별 평균 및 표준편차를 산출하였다. 분석항목의 그룹 간 차이를 분석하기 위하여 two-way 또는 one-way ANOVA를 실시하였으며, 사후 검정은 Tukey를 이용하였다. 모든 통계적 유의수준(α)은 5% 미만으로 설정하였다.
연구 결과
1. 1회 지구성 운동과 AMPK 활성에 따른 PPARβ/δ mRNA의 발현
1회 지구성 운동과 AMPK의 활성이 PPARβ/δ mRNA를 증가시킬 수 있는지 확인한 결과는 Fig. 1에 나타난 바와 같다. 1회 지구성 운동을 실시한 그룹의 골격근 PPARβ/δ mRNA는 좌업 그룹보다 5.5배 증가하였다( Fig. 1A). 지구성 운동은 AMPK를 활성화시킨다. 따라서 지속적으로 AMPK가 활성화되도록 제작된 CA-AMPK를 근세포에 처치한 결과 PPARβ/δ mRNA가 EV를 처치한 그룹보다 6.7배( p< .001) 증가하였다( Fig. 1B).
2. AMPK에 의한 MEF2A의 활성
PPARβ/δ promoter에는 MEF2 반응요소가 존재한다. 따라서 AMPK가 MEF2A를 활성화시킨다면 AMPK는 MEF2A를 통하여 PPARβ/δ의 발현을 조절하는 것을 증명하는 것이다. 따라서 본 연구는 MEF2A의 활성을 분석하기 위하여 MEF2A-Gal4를 제작하였다. MEF2A가 활성화되면 Gal는Gal4 반응 요소가 붙어 있는 녹색발광 plasmid (Gal4-pZsGreen)에 결합하여 빛을 발하게 된다. 이 두 plasmid를 rat L6 세포에 유전자 도입하였으며, 지속적으로 활성화되도록 유전자 조작된 AMPK (CA-AMPK)를 처치하여 MEF2A의 활성 효과를 확인하였다( Fig. 2A, B). 지속적으로 활성화되도록 유전자 조작된 AMPK가 처치된 세포는 EV가 처치된 세포보다 MEF2A의 활성이 1.9배( p< .01) 높게 나타났다( Fig. 2A, B).
3. DN-AMPK가 지구성 운동에 의한 PPARβ/δ의 발현에 미치는 영향
1회 지구성 운동과 AMPK의 활성은 PPARβ/δ mRNA를 증가시키며( Fig. 1A, FB), AMPK의 활성은 PPARβ/δ promoter를 자극하기 위해 MEF2A의 활성을 증가시킨다( Fig. 2A, B). 본 연구는 1회 지구성 운동에 의한 AMPK의 활성이 PPARβ/δ의 발현을 조절하는지 확인하기 위해서 Wistar rat의 왼쪽 TA 근육에 AMPK의 활성이 감소하도록 DNAMPK를 과발현시켰으며, 이와 대조하기 위하여 오른쪽 근육에 empty vector를 과발현시켰다( Fig. 3). DN-AMPK를 처치한 좌업 그룹의 근육에서 AMPK 활성은 EV를 처치한 근육보다 69% ( p< .01) 감소하였으며, HDAC5의 인산화와 PPARβ/δ 발현도 각각 54% ( p< .01) 및 63% ( p< .01) 감소하였다. 1회 지구성 운동은 EV를 처치한 TA 근육의 AMPK 활성을 좌업 그룹보다 3.2배( p < .01) 증가시켰으며, HDAC5의 인산화와 PPARβ/δ도 각각 2.8배( p < .01) 및 2.1배( p < .01) 증가시켰다. 그러나 1회 지구성 운동과 DNAMPK를 병행 처치한 근육은 AMPK 활성과 HDAC5의 인산화가 좌업 EV 처치 그룹보다 각각 65% ( p < .001) 및 51% ( p < .05) 감소하였다. DN-AMPK와 운동을 병행 처치한 근육의 PPARβ/δ 발현은 DNAMPK를 처치한 좌업 그룹보다 1.9배( p< .01) 증가하였다( Fig. 3).
논의
지구성 운동에 의한 골격근 내 대사 적응은 다양한 신호 분자들의 상호작용이 요구된다[ 2- 4]. 지구성 운동에 의하여 활성화된 분자들은 근 대사와 관련된 유전자의 발현을 유도하기 위해 핵 내로 신호를 보내야 하는데, 운동에 의하여 활성화된 AMPK도 핵 내로 신호를 전달하기 위해 전사인자를 인산화하므로써 그 인자를 조절한다[ 12, 23]. 세포의 에너지 요구 증가로 활성화된 AMPK는 MEF2에 결합된 억제인자 HDAC4와 5를 인산화하여 MEF2로부터 분리시키며[ 29], 이로 인하여 활성화된 MEF2는 비로소 목표 유전자 promoter에 결합하여 유전자를 전사시킬 수 있다[ 11, 13]. Gan et al. [ 24]의 결과에서 AMPK는 MEF2A를 직접 활성화시키지 않으며, PPARβ/δ와 함께 MEF2A를 활성화시킬 수 있는 것으로 나타났다. 그러나 본 연구는 AMPK 활성 자체만으로도 MEF2A가 활성화되며( Fig. 2A, B), PPARβ/δ mRNA 발현을 증가시키는 것으로 나타났으므로( Fig. 1B), 이는 AMPK가 PPARβ/δ promoter에 있는 MEF2A의 반응 요소(CTATTTTAGGTGAAT)를 자극함으로써 PPARβ/δ의 발현을 조절할 수 있음을 나타낸다. 따라서 지구성 운동에 의한 AMPK의 활성이 MEF2A를 통한 PPARβ/δ의 발현에 반드시 필요한지 확인해 볼 필요가 있다. 1회 지구성 운동은 AMPK, HDAC5 및 PPARβ/δ의 발현을 증가시켰다. 그러나 AMPK의 활성을 억제시킨 근육은 1회 지구성 운동을 실시하더라도 HDAC5 인산화와 PPARβ/δ의 발현이 차단되었는데, 이는 지구성 운동에 의한 AMPK 활성이 MEF2A를 통하여 PPARβ/δ의 발현을 조절하는 데 반드시 필요하다는 것을 의미한다( Fig. 3). 그러나 AMPK의 활성을 억제시키고 1회 지구성 운동을 실시한 그룹의 PPAR β/δ 발현이 AMPK의 활성을 억제시킨 좌업 그룹보다 증가한 것은 PPARβ/δ의 발현을 증가시키는 다른 기전이 존재할 가능성을 나타내므로 이를 확인하기 위한 추가 연구가 요구된다( Fig. 3). 운동 트레이닝으로 활성화된 AMPK는 골격근의 유전자 발현과 산화적 대사에 영향을 미치며[ 30, 31], PPARβ/δ뿐만 아니라 다른 대사를 조절하는 전사인자들(예; PGC-1α 또는 PPARα)과 상호작용을 통해 다양한 전사 프로그램을 통합할 수 있다[ 32- 35]. 약리학적으로 활성화된 AMPK의 활성은 트레이닝되지 않은 생쥐의 러닝 지구력을 증가시키는 것으로 나타났으며[ 36], 대조적으로 AMPK의 신호 결핍은 러닝 능력을 감소시키는 것으로 나타났다[ 37, 38]. 골격근에 PPARβ/δ가 과발현되도록 유전자 도입된 생쥐도 러닝 지구력이 증가되며, 이는 PPARβ/δ에 의한 골격근의 산화적 대사 능력과 근피로에 대한 저항성이 증가되었기 때문이다[ 5]. 약리학적 AMPK의 운동 모방 효과는 PPARβ/δ에 의한 골격근 산화적 대사 능력의 증가에 의한 것일 가능성이 높다. 실제로 PPARβ/δ knock out 세포에 AMPK의 활성을 증가시킨 연구에서 산화적 대사의 주요 생물학적 지표들이 증가되지 않았는데[ 36], 이는 산화적 유전자에 대한 AMPK의 전사 효과는 핵수용체인 PPARβ/δ가 요구됨을 의미한다. 따라서 지구성 운동으로 활성화된 AMPK가 MEF2A를 통한 PPARβ/δ의 발현을 증가시키는 것은 핵으로 신호 전달을 용이하게 하여 산화적 대사와 관련된 유전자의 전사를 증가시키기 위한 것으로 생각된다. 골격근은 근신경 활성으로 증가된 칼슘에 의하여 수축된다[ 39, 40]. 칼슘과 칼슘 결합 단백질 calmodulin은 calcium calmodulin-dependent protein kinase (CaMK)와 단백질 phosphatase calcineurin A (CnA) 등을 활성화 시키는데[ 41], 활성화된 CAMK는 HDAC1/2 또는 HDAC4/5와 같은 MEF2 억제 인자를 인산화 및 분리시켜 MEF2를 활성화시키는 것으로 나타났다[ 42]. 또한 Handschin et al. [ 43]은 PGC-1α에 의한 CnA의 활성이 MEF2를 활성화시킬 수 있다고 하였다. 최근 Koh et al. [ 8]은 PPARβ/δ를 생쥐의 골격근에 과발현시킨 결과 내인성 PPARβ/δ가 증가하였음을 보여주었으며, 이는 PPARβ/δ 자신에 의한 자가 조절(auto-regulation) 기능이 있음을 나타낸다. PPARβ/δ의 과발현은 AMPK의 활성을 증가시키므로[ 36], AMPK 활성을 통하여 증가된 PPARβ/δ는 다시 AMPK를 통하여 자신의 발현을 조절할 수 있다. 또한 PPARβ/δ는 NRF-1을 통한 MEF2A의 발현을 조절할 수 있으므로[ 6], AMPK-MEF2A축을 통하여 증가된 PPARβ/δ는 NRF-1-MEF2A축을 통하여 다시 자신의 발현을 증가시킬 수 있다. 따라서 근수축에 의한 칼슘 신호 기전, PGC-1α 및 PPARβ/δ의 자가조절이 PPARβ/δ의 발현을 증가시킬 수 있으므로 이를 확인하기 위한 추가 연구가 요구된다.
결론
본 연구는 1회 지구성 운동에 의한 AMPK의 활성이 MEF2A를 통하여 PPARβ/δ의 발현을 증가시키는지 확인하였다. AMPK의 활성은 MEF2A의 활성과 PPARβ/δ mRNA를 증가시킨다. 또한 1회 지구성 운동에 의한 AMPK의 활성은 HDAC5 인산화 증가를 통하여 PPARβ/δ 발현을 증가시키지만 AMPK의 활성 억제는 1회 지구성 운동에 의한 HDAC5 인산화와 PPARβ/δ 발현을 감소시킨다. 따라서 1회 지구성 운동에 의한 AMPK의 활성은 MEF2A를 통하여 PPARβ/δ의 발현을 증가시킨다.
Fig. 1.
Fig. 1.The expression of PPARβ/δ mRNA by endurance exercise and CA-AMPK. To analyze PPARβ/δ mRNA expression, rat TA muscles were dissected immediately after a single bout of swimming exercise (A), and L6 cells were harvested 4 days after transfected with CA-AMPK (B). PPARβ/δ mRNA was normalized with 18S expression. Sed, sedentary; Ex, a single bout swimming exercise; EV, empty vector; CA-AMPK, constitutively active AMPK. *: p<.001 significantly different from Sed or EV group. 
Fig. 2.
Fig. 2.The effect of CA-AMPK transduction on MEF2A-Gal4 activation by CA-AMPK in L6. To analyze MEF2A-Gal4 activation, L6 cells were transfected MEF2A-Gal4 and Gal4-pZsGreen with or without CA-AMPK. MEF2A-Gal4 activation was analyzed by green fluorescence with microplate reader, and green fluorescence was normalized by red fluorescence (DsRed) (A). The image of green fluorescence by MEF2A-Gal4 activation and red fluorescence by DsRed were captured by microscope (B). EV, empty vector; CA-AMPK, constitutively active AMPK. *: p<.01 significantly different from EV group. 
Fig. 3.
Fig. 3.The effect of DN-AMPK on PPARβ/δ expression by endurance exercise. DN-AMPK, pAMPK, and PPARβ/δ expressions were analyzed after a single bout of swimming exercise in 2 weeks DN-AMPK over expressed TA muscle. Sed, sedentary; Ex, a single bout of swimming exercise; pAMPK, phosphor AMPK; DN-AMPK, dominant negative AMPK. *: p<.01 significantly different from EV group (within group); † : p<.01 significantly different from Sed group (between group). 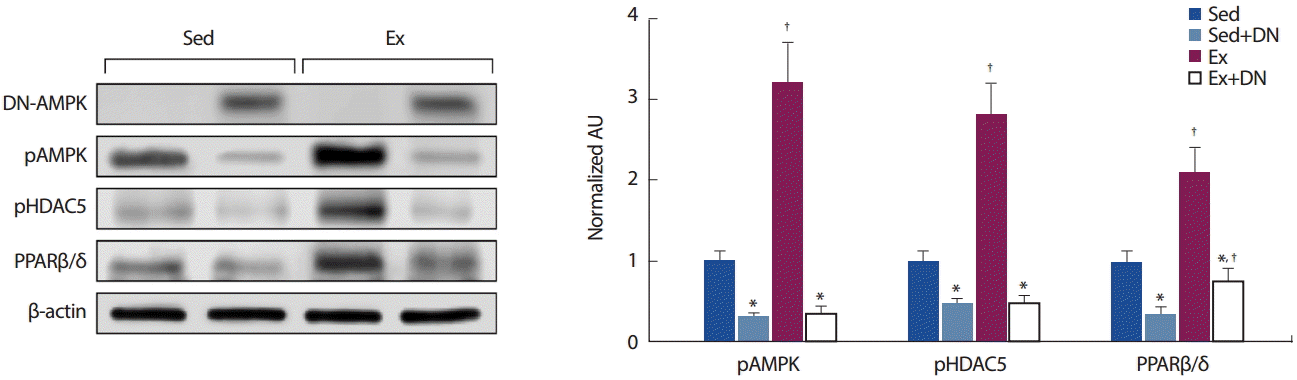
REFERENCES
1. Holloszy JO. Regulation by exercise of skeletal muscle content of mitochondria and GLUT4. Journal of Physiology and Pharmacology. 2008;59 Suppl 7:5-18.
2. Kelly DP, Scarpulla RC. Transcriptional regulatory circuits controlling mitochondrial biogenesis and function. Genes & Development. 2004;18(4):357-368.   3. Lin J, Handschin C, Spiegelman BM. Metabolic control through the PGC-1 family of transcription coactivators. Cell Metabolism. 2005;1(6):361-370.   4. Scarpulla RC. Nuclear control of respiratory gene expression in mammalian cells. Journal of Cellular Biochemistry. 2006;97(4):673-683.   5. Yu RT, Cho HK, Nelson MC, et al. Regulation of muscle fiber type and running endurance by PPARdelta. PLoS Biology. 2004;2(10):e294.
6. Koh JH, Jung SR, Kim SH, Kim KJ. The increased PPARβ/δ by endurance exercise control MEF2A-GLUT4 and mitochodrial enzymes through NRF-1 promoter activity in mouse skeletal muscle. Exrcise Science. 2015;24(2):153-160.  7. Koh JH, Kim SH, Jung SR, Kim KJ. The Role of PPARδ on Mitochondrial Biogenesis of Mouse Skeletal Muscle. Exrcise Science. 2014;23(4):315-322.  8. Koh JH, Kim HS, Kim KJ. PPARβ/δ over expression Increase PGC-1α protein through the decreased PGC-1α ubiquitination in mouse skeletal muscle. Exrcise Science. 2015;24(4):407-414.  9. Koh JH, Ahn NY, Kim HS, Kim KJ. PPARδ activation or overexpression attenuates PGC-1α protein degradation. Exrcise Science. 2015;24(1):49-58.  10. Jung SR, Kim KJ, Koh JH. PGC-1α concentration in skeletal muscle by exercise is controlled by PPARβ/δ through post-transcriptional mechanism: the effects of PPARβ/δ silence on PGC-1α ubiquitination and stability. Exrcise Science. 2015;24(3):1-7.
11. Potthoff MJ, Olson EN. MEF2: a central regulator of diverse developmental programs. Development. 2007;134(23):4131-4140.   12. McGee SL, van Denderen BJW, Howlett KF, Mollica J, Schertzer JD, et al. AMP-activated protein kinase regulates GLUT4 transcription by phosphorylating histone deacetylase 5. Diabetes. 2008;57(4):860-867.   14. Hardie DG, Hawley SA. AMP-activated protein kinase: the energy charge hypothesis revisited. Bioessays. 2001;23(12):1112-1119.   15. Hardie DG, Hawley SA, Scott JW. AMP-activated protein kinase - development of the energy sensor concept. The Journal of Physiology. 2006;574(1):7-15.  16. Hardie DG. AMP-activated protein kinase: a key system mediating metabolic responses to exercise. Medicine and Science in Sports and Exercise. 2004;36(1):28-34.   17. Park SH, Gammon SR, Knippers JD, Paulsen SR, Rubink DS, et al. Phosphorylation-activity relationships of AMPK and acetyl-CoA carboxylase in muscle. Journal of Applied Physiology. 2002;92(6):2475-2482.   18. Vavvas D, Apazidis A, Saha AK, Jamble J, Patel A, et al. Contraction-induced changes in acetyl-CoA carboxylase and 5’-AMP-activated kinase in skeletal muscle. Journal of Biological Chemistry. 1997;272(20):13255-13261.  19. Winder WW, Hardie DG. AMP-activated protein kinase, a metabolic master switch: possible roles in type 2 diabetes. American Journal of Physiology-Endocrinology And Metabolism. 1999;277(1 Pt 1):E1-E10.
20. Winder WW, Hardie DG. Inactivation of acetyl-CoA carboxylase and activation of AMP-activated protein kinase in muscle during exercise. American Journal of Physiology-Endocrinology And Metabolism. 1996;270(2 Pt 1):E299-E304.
21. Wojtaszewski JF, Hansen BF, Kiens B, Markuns JF, Goodyear LJ, et al. Insulin signaling and insulin sensitivity after exercise in human skeletal muscle. Diabetes. 2000;49(3):325-331.   22. McGee SL, Fairlie E, Garnham AP, Hargreaves M. Exercise‐induced histone modifications in human skeletal muscle. The Journal of Physiology. 2009;587(24):5951-5958.  23. Mukwevho E, Kohn TA, Lang D, Nyatia E, Smith J, et al. Caffeine induces hyperacetylation of histones at the MEF2 site on the Glut4 promoter and increases MEF2A binding to the site via a CaMK-dependent mechanism. American Journal of Physiology-Endocrinology and Metabolism. 2008;294(3):E582-E588.  24. Gan Z, Burkart-Hartman EM, Han DH, Finck B, Leone TC, et al. The nuclear receptor PPARβ/δ programs muscle glucose metabolism in cooperation with AMPK and MEF2. Genes & Development. 2011;25(24):2619-2630 http://doi.org/10.1101/gad.178434.111.    25. Akimoto T, Sorg BS, Yan Z. Real-time imaging of peroxisome proliferator-activated receptor-gamma coactivator-1alpha promoter activity in skeletal muscles of living mice. American Journal of Physiology-Cell Physiology. 2004;287(3):C790-C796.
26. Terada S, Goto M, Kato M, Kawanaka K, Shimokawa T, et al. Effects of low-intensity prolonged exercise on PGC-1 mRNA expression in rat epitrochlearis muscle. Biochemical and Biophysical Research Communications. 2002;296(2):350-354.  27. Terada S, Tabata I. Effects of acute bouts of running and swimming exercise on PGC-1alpha protein expression in rat epitrochlearis and soleus muscle. American Journal of Physiology-Endocrinology and Metabolism. 2004;286(2):E208-E216.
28. Lowry OH, Rosebrough NJ, Farr AL, Randall RJ. Protein measurement with the Folin phenol reagent. The Journal of Biological Chemistry. 1951;193(1):265-275.  30. Chen ZP, Stephens TJ, Murthy S, Canny BJ, Hargreaves M, et al. Effect of exercise intensity on skeletal muscle AMPK signaling in humans. Diabetes. 2003;52(9):2205-2212.   31. Reznick RM, Shulman GI. The role of AMP‐activated protein kinase in mitochondrial biogenesis. The Journal of Physiology. 2006;574(1):33-39.  32. Bronner M, Hertz R, Bar-Tana J. Kinase-independent transcriptional co-activation of peroxisome proliferator-activated receptor α by AMP-activated protein kinase. Biochemical Journal. 2004;384(2):295-305.  33. Varanasi US, Yang W, Leff T. AMP-activated protein kinase regulates HNF4alpha transcriptional activity by inhibiting dimer formation and decreasing protein stability. The Journal of Biological Chemistry. 2003;278(30):27495-27501.
34. Jäger S, Handschin C, St-Pierre J, Spiegelman BM. AMP-activated protein kinase (AMPK) action in skeletal muscle via direct phosphorylation of PGC-1alpha. Proceedings of the National Academy of Sciences. 2007;104(29):12017-12022.  35. Leff T. AMP-activated protein kinase regulates gene expression by direct phosphorylation of nuclear proteins. Biochemical Society Transactions. 2003;31(1):224-227.   37. Mu J, Brozinick JT Jr, Valladares O, Bucan M, Birnbaum MJ. A Role for AMP-Activated Protein Kinase in Contraction- and Hypoxia-Regulated Glucose Transport in Skeletal Muscle. Molecular Cell. 2001;7(5):1085-1094.   38. Thomson DM, Porter BB, Tall JH, Kim HJ, Barrow JR, et al. Skeletal muscle and heart LKB1 deficiency causes decreased voluntary running and reduced muscle mitochondrial marker enzyme expression in mice. American Journal of Physiology. Endocrinology and Metabolism. 2007;292(1):E196-E202.
39. Olson EN, Williams RS. Calcineurin Signaling and Muscle Remodeling. Cell. 2000;101(7):689-692.   40. Hood DA. Invited Review: contractile activity-induced mitochondrial biogenesis in skeletal muscle. Journal of Applied Physiology. 2001;90(3):1137-1157.  41. Berchtold MW, Brinkmeier H, Müntener M. Calcium ion in skeletal muscle: its crucial role for muscle function, plasticity, and disease. Physiological Reviews. 2000;80(3):1215-1265.  42. Corcoran EE, Means AR. Defining Ca 2+/calmodulin-dependent protein kinase cascades in transcriptional regulation. Journal of Biological Chemistry. 2001;276(5):2975-2978. 
|
|








