AbstractPURPOSE Bone mineral density (BMD) is known to diminish with aging. Despite numerous studies done on aging females, a limited number of studies have been published to elucidate cause of lowered BMD in elderly males. This study was conducted to analyze the relationship of the appendicular muscle mass to osteopenia in elderly Korean males.
METHODS Data for 873 men (60≥age≥79) from the Korea National Health and Nutrition Examination Survey 2010-2011 were included. Bone mineral density results (g/cm2) were used to divide the subjects in to the osteopenia and control groups for comparison of muscle masses of the whole body (WB), upper limb (UL), and lower limb (LL). The muscle masses were further classified into 4 quartiles (Q) to calculate the odd ratios (OR) of osteopenia in the lumbar spine (LS) and femoral neck (FN) areas.
RESULTS Muscle masses were significantly less in all areas of WB, UL, and LL. The sarcopenia incidence rates increased as the muscle mass decreased in WB, UL, and LL in both LS and FN areas. Fourth Quartiles of WB and LL showed greatest OR of 3.55 and 2.76. Although the muscle mass ratio showed less significance, WB, UL, and LL showed increasing tread of OR, especially in the FN area.
서 론골밀도 감소와 관련된 골다공증 및 골감소증은 연령과 함께 나타나는 대표적인 노화현상이며, 노인인구의 증가와 함께 발생률도 증가하고 있다[1,2]. 골밀도 감소는 그 자체로 생명에 위협을 주지는 않지만, 이러한 상태가 지속적으로 진행한다면 골절의 위험이 증가하게 된다. 특히, 노인에서 발생하는 낙상으로 인한 골절 및 척추의 압박골절은 삶을 질을 떨어뜨릴 뿐 아니라 통증을 유발하고, 개인적 사회적 비용을 증가시키며 장기적으로 사망과 연관되기도 한다[3-5].
골밀도 감소의 주 원인은 나이, 칼슘 및 비타민 D 결핍, 낮은 신체활동과 근력 그리고 낮은 BMI, 낮은 근육량이 언급되고 있다[6]. 한 연구에 의하면 침상 안정을 취한지 20일 만에 골밀도가 4.6%가 감소되었으며[7], 반대로 무거운 무게를 드는 역도선수들의 높은 골밀도에 대해 보고 되었다[8]. 이렇게 신체활동이 중요함에도 불구하고 노인의 특성상 신체활동이 줄어드는 경향이 강하고, 여성보다 낮은 발생률을 보인 남성에게까지 최근 골감소증과 같은 질환이 증가하고 있다[9].
전 국민에게 일반화 할 수 있는 국민건강영향조사 데이터를 기반으로 보고된 기존 분석자료에 따르면 60대와 70대 남성의 골다공증 유병률은 각각 7.2%와 18.0%로 국내 남성들도 골다공증에 취약한 상태에 있음을 알 수 있지만 60대와 70대 여성들의 유병률인 37.4%와 70.7%과 비교할 때 유병률이 높지 않아 여성들의 골다공증에 더 관심을 갖게 되는 경향이 있다[10]. 하지만 골감소증의 남성의 경우 60대와 70대 성인 남성들의 유병률은 각각 47.4%와 54.7%로 국내 노인 남성들 2명 중 1명은 골감소증이 있다고 보고 하고 있다. 이에 더불어 골밀도에 대한 미국과 일본 등의 발병률을 비교해 보았을 때 국내 남성들이 모든 연령대에 비교적 낮은 골밀도를 보고하고 있어 국내 노인들이 골감소증에 더 취약한 상태에 있음을 알 수 있다[10]. 낮은 골감소증은 향후 골다공증으로 이어질 가능성을 높이며 이는 증가되는 평균수명과 고령층 인구에 삶의 질을 현저히 감소시킬 수 있으므로 골밀도 감소와 이에 대한 예방책에 대한 연구는 필수적이라 할 수 있다. 최근 선진국에서 남성들의 골밀도 감소에 높은 관심을 가지면서 골밀도 발생률, 치료 경과 등은 물론 유병요인 등에서 성별의 차이를 규명하려는 연구들이 활발이 이루어지고 있다[11]. 남성들의 골다공증 유병률은 낮지만 골다공증으로 인한 골절의 취약성, 합병증으로 인한 사망률, 낮은 수검률 등이 여성들 보다 높게 보고되고 있기 때문에 남성과 여성의 특성에 적합한 차별화된 연구와 예방 전략이 필요하다라고 할 수 있다[11].
노화에 따른 골밀도의 변화에 영향을 주는 요소는 성별에 따라 차이를 보일 수 있으므로 남성 노인에 대한 개별적인 연구는 필수일 것이다. 현재 보고되고 있는 골감소증의 발병원인은 다양하지만 체질량지수와 체성분 등의 높은 연관성이 다수 보고되고 있다[11,12]. 성별에 따른 골감소증 관련 요인들이 성별에 있어 차이를 보고 있으며, 여성의 경우 체지방량과 높은 상관성을 다수의 연구결과에 보고되었지만 남성의 경우 유의하게 차이가 없거나 상반된 결과 등을 보고하는 등 다소 통일되지 못한 연구결과들을 보이고 있다[13,14].
노인에서 하지 근육의 유지는 매우 중요하게 여겨진다. 하지의 건강은 보행을 하고, 체중지지 기능을 유지하게 한다[15]. 노화와 저활동은 근육양을 감소시키게 되며 근육의 작용으로 자극을 받는 골밀도는 감소세가 뚜렷해지게 된다[16]. 근육량이 골밀도와 연관이 있다는 많은 연구에도 불구하고 아직까지 상지 또는 하지의 국부적 근육량과 골밀도와의 연관성에 대해서는 연구가 미흡하다. 따라서, 본 연구는 60대와 70대 남성들의 상지와 하지의 근육량이 요추부와 대퇴골경에서 발생하는 골감소증에 각각 어떤 영향을 미치는지에 대해 횡단적 분석을 실시하였다. 연구의 구체적인 목적은 다음과 같다. 첫째, 60에서 79세의 남성들의 골밀도를 국제보건기구(WHO)의 분리기준에 따라 골감소증 동반자와 정상인들을 구분하여 두 그룹 간의 근육량을 비교한다. 둘 째, 부위별 근육량과 근육비율(전신, 상지, 하지)을 사분위수로 구분하여 골감소증의 발생률을 비교한다. 마지막으로 부위별 근육량과 근비율에 따른 요추부와 대퇴골경의 골감소증 발병률을 비교한다.
연구 방법1. 연구 대상본 연구는 국민건강영양조사를 통해 측정된 결과를 활용하여 노인 남성들의 부위별 근육량에 따른 골밀도 정도를 확인하고 골감소증의 유병률을 비교 분석하였다. 국민건강영양조사에서는 골밀도 측정은 2008년에서 2011년간 실시되었으며 본 연구에서는 최근 측정된 2010년과 2011년 결과를 활용해 분석하였다. 남자 총 60세부터 79세 1,079명에서 포함대상으로는 분석 결과가 척추와 대퇴골경의 자료가 모두 있는 남성들 중 골다공증 진단기준으로 권고한 T-score값에 따라 골다공증(≤-2.5)으로 구분된 이들은 제외하였다. T-score값에 따라 골감소증(>-2.5, <-1.0), 정상(≥-1.0)으로 구분한 결과 해당되는 최종 분석대상은 873명이었다. 본 연구에 참여한 대상자의 일반적 특성은 Table 1과 같다. 골다공증으로 진단받아서 검사 당시에 골다공증 치료약을 복용중인 대상자는 본 연구에서 골다공증 유병자로 포함하였다[17].
2. 연구절차1) 골밀도 검사국민건강영양조사에서는 요추(1-4번)와 대퇴경부의 골밀도 측정을 위해 기기(DISCOVERY QDR-4500W, Hologic INC., USA)를 이용하여 이중에너지 방산선흡수 계측(DXA, Dual energy X-ray Absorptiometry) 방법으로 측정하였다[10]. 측정부위는 팔, 다리 및 요추 1-4번, 대퇴골두, 대퇴골경, 대퇴골 전체를 측정하였다. 본 연구를 위해서 사용한 값은 골다공증 진단을 위해 적용하는 요추 1-4번, 대퇴골경의 평균 골밀도 g/cm2와 T-score값을 사용하였다. 골밀도 측정치는 세계보건기구(WHO)에서 50세 이상 남성의 골다공증 진단기준으로 권고한 T-score값에 따라 골다공증(≤-2.5), 골감소증(>-2.5, <-1.0), 정상(≥-1.0)으로 구분하였다[18,19]. 골다공증은 본 연구에서 사용한 데이터의 특성상 발생률이 낮고 일관된 분석 방법을 적용하기 위해 제외하였다.
2) 근육량과 근육비율 측정과 계산근육량과 근육비율을 전신(whole body), 상지(upper limbs), 하지(lower limbs) 부분으로 나누었으며 근육량은 부위별 제지방에서 골량을 제외하여 적용하였다. 상지와 사지의 근육량은 좌우측의 팔과 다리의 근육량 각각 합하여 상지근육량과 하지근육량으로 계산하였다. 상지와 사지의 근육비율은 체중에서 차지하는 비율로 계산(상지근육량/체중×100, 하지근육량/체중×100)하였다. 전신, 상지, 하지에 대한 각각의 근육량과 근육비율을 계산한 후 이를 4분위수(quartile)로 구분하여 골감소증 유병률(Odds ratio, OR)을 산출하였다.
3. 자료 처리 방법2010년과 2011년에 수행한 제 5기 1, 2차년도 국민건강영양조사 원시자료는 국민건강영양조사 원시자료분석지침을 기준으로 하여 통합하였고, 국민건강영양조사는 다단계층화집락추출에 의한 자료이기 때문에 국민건강영양조사에서 제시한 표본 가중치와 복합표본설계요소를 지정하여 분석하였다. 분석은 SPSS 21.0 Window버전을 이용하였다. 일반적 특성의 연속형 변수는 independent t-test를 이용하였으며, 근육량과 비율에 따른 발생률 분석은 카이제곱을 이용하였다. 유병률을 분석하기 위한 방법으로는 로지스틱 회귀분석을 이용하였으며, 값은 odds ratio (OR)로 표현하였다. 그룹간 발생한 연령의 차이에서 발생하는 오차를 줄이기 위해 나이를 보정하였으며, 골감소증의 위험인자로 언급된 낮은 체질량 지수(BMI)를 보정하였다. 유의 수준은 p <.05로 하였으며, confidence interval (CI)은 95%로 설정하였다.
연구 결과1. 일반적 특성본 연구의 분석결과 총 873명 중 정상군이 365명, 골감소증이 508명으로 총 대상 중 약 58.1%에게 골감소증이 있은 것으로 나타났다. 나이의 경우 정상군은 66.9±5.0세이었고, 질환군은 68.4±5.2로 그룹간 평균 1.5세 정도 차이가 나는 것으로 났으며, 신장과 체중 역시 정상군이 키도 크고 몸무게도 더 많았으며, 체질량지수(BMI)도 정상군이 더 높았다. 척추의 골밀도는 정상군이 1.07±0.12 g/m2, 질환군이 0.88±0.10 g/m2로 21.6% 더 높았으며, 대퇴골경 골밀도는 25% 가량 높았다. 근육량의 경우 정상군이 질환군보다 전체 근육량은 3.3 kg 더 많았으며, 상지는 0.3 kg, 하지는 1.2 kg 더 많았다. 하지만 근비율로 볼 때 질환군이 전신, 상지, 하지의 근비율이 각각 1.5%, 0.2%, 0.2% 더 높은 것으로 나타났지만, 다리에서는 유의하지 않았다.
2. 근육량과 근육비율에 따른 골감소증 발생률
Fig. 1은 전신, 상지, 하지의 근육량과 근육비율에 따른 골감소증의 발생률에 대해 분석한 결과로 절대값으로 계산된 근육량은 전신, 상지, 하지 대부분에서 근량이 적을수록 발생률도 높아지는 일관된 경향을 나타냈으며, 특히 하지의 경우 이러한 경향이 두드러지게 나타났다. 하지 근육량을 4분위수로 구분하여 근육량이 가장 높은 그룹(Q1)부터 가장 낮은 그룹(Q4)로 세분화하여 골감소증의 발생률을 산출한 결과 Q1은 17.8%, 그룹2 (Q2)는 25.6%, 그룹3 (Q3)은 27.8%, 그룹4 (Q4)는 28.8%로 모두 유의한 결과(p =.02)를 보였으며 근량이 감소할수록 골감소의 발병률이 증가하였다. 근육의 비율로 골감소증 발생률을 산출한 부분에서는 근육의 비율 감소에 따른 발생률의 증가가 근육량에서와 같이 뚜렷하게 나타나지는 않았다. 전신과 상지에서는 각각 p=.02, p =.00로 유의하였지만, 일부 결과에서 근육비율이 낮을수록 발생률이 낮은 경향을 보이는 혼합된 결과를 보였다.
3. 근육량에 따른 골감소증의 유병률노인 남성들의 근육량에 따른 골감소증은 Table 2에 기술되어 있으며, 절대값을 4분위수로 나눈 후 각 분위수에 따른 골감소증 발병률을 산출하였다. 골감소증에 대한 발병률은 골부위에 따라 차이가 나기 때문에 골감소증을 측정하기 위해 대표적으로 측정되는 두 부위(요추부[L1-4]와 대퇴골경)에서 비교 분석하였다. 요추부(L1-4)에 있어서 전체 근육량이 가장 적은 그룹(Q4)이 가장 많은 그룹(Q1)보다 골감소증의 유병률(OR)이 3.5 (95%CI: 2.07-6.09, p =.00)이었으며, 대퇴골경에서는 2.3 (95%CI: 2.31-4.52, p =.01)로 나타났다. 요추부(Femoral head)에서는 그룹 Q2에서도 유의한 값이 도출되었으나(p =.02), 대퇴골경에서는 그룹 Q4에서만 유의하였다(p =.01). 상지근육량의 경우 대퇴골경에서는 유의한 값을 보이지 않았지만, 척추에서는 유의한 값을 보였다. 상지근육량이 가장 적은 그룹 Q4의 유병률의 경우 OR이 1.6 (95%CI: 1.06-2.57, p =.03)배 증가하였다. 하지근육량에서는 전체 근육량과 비슷한 결과를 나타냈다. 요추부에서는 다리근육이 적은 그룹(Q4)이 가장 많은 그룹(Q4)보다 유병률이 각각 1.6배, 2.2배, 2.7배 높았으며, 대퇴골경에서는 다리근육이 가장 적은 그룹(Q4)의 OR값이 2.28 (95%CI: 1.28-6.05, p =.01)로 증가하는 결과를 나타내었다.
4. 근육비율에 따른 골감소증의 유병률노인 남성들의 근육비율(%BW)에 따른 골감소증은 Table 3와 같다. 근육비율은 전체 체중에서 차지하는 근육비율을 %BW로 계산(상지근육량/전신근육량 ×100, 하지근육량/전신근육량 ×100)하였으며, 그 값을 4분위수로 나눈 값을 적용하였다. 대퇴골경에서는 전체 근육비율이 낮을수록 골감소증의 유병률이 높아지는 것으로 나타났다. 대퇴골경 3분위수인 그룹 Q3의 경우 1분위수(Q1)에 비해 OR값이 1.72(95% CI: 1.12-2.66, p =.01)로 나타났으며, 4분위수는 1.82 (95% CI: 1.14-2.92, p =.01)로 약 1.89배 증가하는 것으로 나타났다. 상지 근육비율은 유의하지 않았으며, 대퇴골경 부분은 전체 근육비율, 팔-다리 근육비율에서도 유의한 결과를 보이지 않았다. 하지 근육비율에서는 유일하게 4분위 값에서 유의한 결과를 보였으며, 근육의 비율이 가장 적은 4분위수(Q4)이 가장 많은 비율(Q1)보다 유병률이 1.7배로 증가하였다(p =.02).
논 의초고령화 사회로 진입하면서 인구고령화의 증가는 골다공증 등의 질환 발병률 증가에 따른 의료비 상승 및 삶의 질 저하로 이어지며 사회적 부담이 급증하고 있다. 골밀도는 유전적인 요인이나 개인의 특성에 의해서만 결정되기 보다는 식이습관, 음주, 흡연, 신체활동 등 다양한 요인들에 의해 영향을 받기 때문에 예방과 억제 측면에서 정확한 원인분석은 매우 중요한 영역이라 할 수 있다[10]. 특히 남성의 경우 골밀도 감소는 여성들보다 합병증과 골절의 취약성 등이 보고되기 때문에 골다공증이 발생하기 전에 위험요인을 예방하고 발병률 저하를 저하시키는 것은 필수적이라 할 수 있다[11,13]. 남성들의 골다공증 발생 원인이 여성들과 차이가 있다고 보고되어 있어 본 연구에서는 골다공증 전 단계인 골감소증(osteopenia)를 동반한 노인남성들과 정상인들의 전신 및 상, 하지별 골밀도와 근육량을 비교 분석하여 골감소증이 골다공증으로 악화되기 전에 효율적인 관리에 대한 대책을 수립하는데 근거자료를 제공하고자 본 연구를 수행하였다.
1. 노인남성들의 일반적인 특성현재 보고되고 있는 골감소증의 발병원인은 다양하지만 체질량지수와 체성분 등과 높은 연관성이 보고되고 있다[11,12]. 본 연구에서 골감소증을 동반한 노인들과 정상군의 체중과 체질량지수(BMI)를 비교해 보았을 때 기존 연구결과들과 동일한 결과를 보였다. 즉, 골감소증을 동반한 군이 정상군보다 낮은 체중과 체질량지수를 보였다. 선행연구에 따르면 높은 체중 혹은 체질량지수는 골밀도 보호효과를 제공한다고 보고하고 있다[20]. 이러한 현상은 체중이 골격에 물리적인 스트레스로 작용하며 스트레스가 가해지는 부위에 골형성 세포의 활성화가 상대적으로 증가되어 골량이 증가한다고 설명되고 있다[9,20]. 체중 증가에 따른 골밀도의 증가에 대한 연구보고는 오랫동안 다양한 환경과 대상자들을 대상으로 확인되었다.
하지만 체성분 구성에 있어 제지방과 체지방이 골밀도에 미치는 영향에 대해서는 성별에 따라 다른 결과들과 해석들이 보고되고 있다. 여성의 경우 폐경 후 지방이 골밀도의 유의한 영향을 미친다고 보고되고 있는 반면 근육량은 비교적 큰 영향력을 주지 않는다고 보고되고 있다[13,21-23]. 폐경으로 인한 에스트로겐 결핍은 조골세포 자극물질을 억제하여 골 조직의 상실이 가속화시킨다[5,14]. 폐경 후 체지방량의 증가는 에르스로겐 수치의 감소에 따른 골밀도 저하를 대신 보호하는 역할을 하기 때문에 근육량보다는 체지방량이 골밀도에 더 많은 영향을 미칠 수 있다고 보고되고 있다[14,21].
본 연구에서 골감소증 노인 남성들의 전신근량은 물론 상지와 하지의 근량 모두 유의하게 낮게 확인되었다. 이러한 결과는 노인 남성들에게 있어서 근육량이 골밀도에 중요한 역할을 의미한다. 이러한 결과는 최근 노인들을 대상으로 수행한 연구결과들을 통해 보고되고 있다. 40대에서 70대 성인 남녀들 14,789명을 대상으로 체지방량과 골다공증 성 골절을 분석한 대규모 연구결과를 보면, 여성의 경우 체지방량이 20% 미만의 여성들의 골반 골절 발생률이 체지방량 ~40%의 여성들보다 3.5배 높았지만 남성의 경우 체지방량에 따른 골밀도의 변화의 경향은 확인되지 않았다[14]. 비교적 동일한 신체조건을 가진 중국인들을 대상으로 실시한 연구에서도 여성에게 있어서만 체지방량이 골절의 독립적인 변인이라고 보고하고 있다[24].
최근 논문들은 체지방량이 골밀도에 영향을 주지만 이는 체중 증가에 따른 물리적인 부하를 증가이기 때문에 체지방이 골밀도 유지 및 증가에 유의한 영향을 준다고 보고하고 있다[13,14]. 특히 남성에게 있어서 체지방 자체로 인한 골밀도 증가 효과는 미비하다고 할 수 있다. 체지방으로 인해 발생되는 물리적인 영향을 통계학적 방법으로 통제한 후 통계적인 유의성을 분석한 결과 체지방이 골밀도 감소에 유의한 역할을 하지 않을 뿐만 아니라, 연령, 체중, 신장, 규칙적인 운동 등을 통제해 골밀도와 허리둘레와의 상관성을 계산한 결과 남녀 모두에게 있어서 음의 상관관계가 확인되었다고 보고하고 있다[13,14]. 이러한 결과들로 인해 특히 남성들에게 있어서는 체지방량 보다는 근육이 골밀도에 미치는 영향에 대해 더 집중 연구가 이루어 지고 있다.
2. 전신, 상지, 하지 근육량과 근량비율에 따른 골감소증 발생률본 연구에서는 근육량의 중요성을 확인하기 위해 전신, 상지, 하지의 근육량과 근육비율을 사분위수로 나눈 뒤 골감소증의 발생률을 계산하여 근육량 증가에 따른 골밀도의 변화를 좀 더 심층적으로 분석하였다(Fig. 1). 사분위수(Q1-Q4)로 근육량과 근육비율을 나눠 발생률을 분석한 결과 전신, 상지, 하지 모든 부위에서 근육량이 감소할수록 골감소증 발병률이 유의하게 증가한다는 것을 확인할 수 있었다. 근육과 골은 서로 유기적인 관계를 가지고 있어 서로에게 영향을 미친다. 특히 골격근이 골에 미치는 여러 가지 물리적, 생화학적 역할로 인해 골밀도 증감에 매우 중요한 역할을 하는데, 특히 노인남성들에게 있어 골밀도와 밀접한 관계를 가지고 있다라고 보고되고 있다[25]. 근육량 감소에 따른 골밀도 저하는 노인 남성들을 대상으로 근감소증(sarcopenia)과 전근감소증(pre-sarcopenia), 그리고 이에 따른 골밀도 감소에 대한 변화를 검사한 Pereira et al. [26]의 연구결과에서도 보고되고 있다. Pereira et al. [26]이 60세 이상의 노인 남성들을 근감소증과 전근감소증 그룹으로 나누어 골밀도 유병률을 확인한 결과 정상 그룹에 비해 전근감소증 그룹은 8배, 근감소증 그룹은 9배 증가하였다.
근육량 증가에 따른 골밀도 증가의 기전에 대한 여러가지 가설들이 있지만 일반적으로 인정되고 있는 가설들은 다음과 같다. 첫 번째로, 운동과 같이 반복적인 동작으로 인해 증가된 근육의 힘과 면적은 골세포의 기계수용기에 물리적인 압박과 부하를 가해 골막을 성장시킨다[27]. 둘째, 근육과 골은 동일한 줄기세포에서 유도되므로 동일한 배아형성과 함께 호르몬과 유전자 등의 관련요소들로 생성, 유지되어 서로에게 지속적으로 영향을 주며 상호작용한다[28]. 즉, 근육조직은 근육조직과 골대사의 상호작용을 통해 중요한 생리학적, 병태생리학적 역할을 한다[25]. 더불어 근육의 내분비기능은 근육뿐만 아니라 골의 항상성 관리에 영향을 준다[28]. 셋째, 근육량의 증가는 골의 표면에서 콜라겐 섬유와 골막의 신장을 유발하여 주변 골성장을 촉진한다. 이에 더불어 특정부위로 혈액의 흐름을 증가시켜 골의 강도를 향상시킬 수 있어 근육량의 증가는 주변 골의 강도와 밀도를 증가시킨다[25]. Szulc et al. [29]은 상지근육과 근력이 저조한 피질골과 해면질골의 미세구조에 영향을 미친다라고 보고하였다. 또한, Kaji [25]와 Glass et al. [30]은 골절부위에 근육피판을 입혀 자가골이식의 회복률을 관찰한 결과 골절부위의 회복이 촉진된 것을 확인하였다. 이와 같이 골과 근육은 밀접한 관계를 가지고 있으며 근육의 변화는 골증감에 유의한 영향을 미친다.
상, 하지 근육량과 골밀도는 밀접한 관계를 가지고 있으며, 근육량 감소에 따른 골밀도 감소는 상, 하지의 근육량에 따른 골밀도 연구에서 더 유의하게 확인되었다[12,22,24,26]. 본 연구결과에서도 상, 하지근육량에 따른 골밀도의 변화가 확인되었다. 이러한 경향은 상지근육량(Q1, 21.1%)보다는 하지근육량(Q1, 17.8%)에 있어 더 현저히 확인되었으며 Q1과 Q4 차이에 있어 하지근육량이 상지근육량보다 더 큰 차이(11.0% vs. 5.9%)를 보였다. 비율적인 부분에서 전신과 상지에서는 유의한 결과를 보였지만 근육비율이 감소할수록 근감소증이 증가하는 추세는 보이지 않았다. 이는 부위별 근육량도 중요하지만 절대적인 체중도 골밀도에 중요한 역할을 한다는 것을 시사한다.
앞서 논하였듯이 근육량의 증가는 물리적, 생화학적 변화로 인한 골밀도의 증가로 이어지며, 이는 체순환을 통한 전신적인 영향은 물론 국소 부위에 영향을 준다. 이로 인해 움직임과 근육의 변화가 가장 많은 사지 근육으로 인한 국소 부위인 하지와 상지 골에 유의한 영향을 미친다고 보고되고 있다. Gonnelli et al. [22]는 골과 근육의 관계는 대퇴골과 손에서 가장 현저히 나타난다고 보고하고 있다. 대퇴와 손 부위의 골형태는 피질골량이 상대적으로 높으며 비교적 높은 운동량을 가지고 있기 때문에 운동을 통한 근육의 물리적인 압박이 골막 골세포의 기계수용기에 자극을 주어 골밀도를 증가시킨다라고 추측되고 있다[22].
3. 전신, 상지, 하지 근육량 및 근비율에 따른 요추부와 대퇴골경의 골감소증 유병률본 연구에서는 골밀도의 변화를 확인하기 위해 검사되는 부위 중 대표적인 부위인 요추부와 대퇴골경의 골밀도 결과를 활용하여 근육량 및 근비율의 변화가 부위별 골밀도 감소에 미치는 영향을 확인하였다(Table 2,3). 대상자들의 근육량을 사분위수로 구분하여 요추부와 대퇴골경의 골감소증 여부를 확인할 결과 전신과 하지의 3집단(Q2, Q3, Q4)에서 요추부 골감소증 유병률이 유의하게 증가하는 결과를 보였다. 요추부의 이러한 유의한 유병률 증가는 하지의 근육량이 가장 낮은 Q4에서 가장 높게(2.76배) 나타났다. 상지의 경우 유의한 유병률 증가는 보였지만 근육량이 가장 낮은 Q4에서만 유의한 유병률을 보였다. 반면 대퇴골경에서의 유의한 유병률은 전신과 하지에서 보였으며, 근육량이 가장 낮은 Q4에서 확인되었다. 이러한 결과들은 절대적인 근육량이 하지의 골밀도에도 영향을 주지만 상지에도 영향을 준다는 것을 시사하고 있다. 근육비율에 따른 골감소증 유병률을 확인하여 상대적인 근비율의 중요성을 확인한 결과, 절대적인 근육량과는 상반되게 요추부보다는 대퇴골에서만 낮은 근육량 군에서 유의한 골감소증 유병률이 확인되었다. 근육비율이 상지의 골밀도보다는 하지의 골밀도에 비교적 더 많은 영향을 준다고 볼 수 있다.
대퇴골경과 같이 체중지지가 높은 신체부위의 골밀도는 기존 다수의 연구에서도 확인할 수 있다. 노인 남성들의 부위별 골밀도를 비교한 Pereira et al. [26]도 대퇴골두에서 정상군에 비해 근육량이 낮은 노인들에게 낮은 골밀도(0.91 vs. 0.79 g/cm2)와 T-Score (-1.17 vs. -2.12)을 보고하였으며, 요추부에서도 낮은 골밀도(1.03 vs. 0.97 g/cm2)와 T-Score(-1.54 vs -2.03) 경향을 보고하였다. Gonenelli et al. [22]은 대퇴골두와 요추부의 모든 부위에서 근감소와 골밀도 저하에 대한 상관관계(r= 0.19; 0.23 [p =.03])을 보고하였으며, 이러한 유의한 상관성은 Hong et al. [24]에서도 보고되었다. 이와 같이 남성 노인들의 대퇴골경과 요추부에서의 골밀도 감소는 근육량 감소와 높은 상관성을 보이고 있어 근육량은 남성들의 골밀도에 중요한 역할을 한다고 볼 수 있다. 본 연구에서는 비율적인 근육보다는 절대적인 근육량이 골밀도와 더 높은 상관성을 보인 원인이 남성 노인들의 전반적인 근 감소율이 여성들보다 높기 때문일 것이라 추정된다. 남성들의 경우 초기 근육량이 여성들보다 높지만 절대적인 근육량은 비교적 더 빠른 속도로 감소될 뿐만 아니라 골감소보다 상대적으로 먼저 근위축이 확인되고 있다고 보고하고 있다[24,25].
결 론골다공증으로 이어질 수 있는 골감소증은 노인 남성에 있어 높은 발생률을 보인다. 골밀도 감소의 원인은 다양하지만 여성과 다른 발생 원인들이 보고되고 있으며, 사지의 근육량이 골감소증을 증가시키는 발생원인으로 보고되고 있다. 골밀도 감소는 근육과 뼈의 내분비적인 상화작용으로 증감되며 물리적인 체중 부하와 근육의 반복적인 움직임을 통해 국소적으로, 그리고 전신적으로 골밀도에 영향을 줄 수 있으므로 근육을 통한 골밀도 유지 및 관리는 특히 노인 남성들에게 필수적이라 할 수 있을 것이다. 더 나아가 체지방을 통한 골밀도 유지는 체지방 증가로 인한 물리적인 체중 부하로 골밀도 증가에 영향을 줄 수 있을지 모르지만 비만으로 인한 신체활동 저하가 골격근량과 기능 손실 및 저하, 낙상의 위험, 다양한 장애 및 질환 등으로 이어지기 때문에 골절의 위험은 더 증가될 수 있다[25]. 본 연구결과를 토대로 간략히 정리하면 요추부의 골밀도는 전신과 상지의 근량은 물론 하지의 근량과 밀접한 관계를 가지고 있으므로 규칙적인 신체활동을 통한 근육량의 유지 및 증가는 낙상 등을 통한 골절의 위험이 높은 척추와 대퇴골을 보호하는데 중요할 것이라 판단된다.
Fig. 1.Fig. 1.Incidence rate of osteopenia based on the muscle mass (kg) and ratio (%BW) of the whole body (WB), lower limbs (LL), and upper limbs (UL). 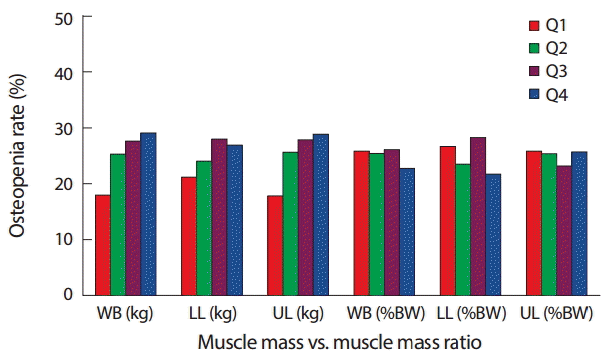
Table 1.Basic characteristics of the study subjects Table 2.Incidence rates of osteopenia at lumbar spine and femoral neck based on the whole body, upper limb, and lower limb muscle mass Table 3.Incidence rates of osteopenia at lumbar spine and femoral neck based on the whole body, upper limb, and lower limb muscle mass ratios REFERENCES1. Faibish D, Ott SM, Boskey AL. Mineral changes in osteoporosis a review. Clinical Orthopaedics and Related Research. 2006;443:28.
2. Lim YW, Sun DH, Kim YS. Review osteoporosis: pathogenesis and fracture prevention. The Korean Hip Society. 2009;21(1):6-16.
3. Burge R, Dawson-Hughes B, Solomon DH, Wong JB, King A, et al. Incidence and economic burden of osteoporosis-related fractures in the United States, 2005-2025. Journal of Bone and Mineral Research. 2007;22(3):465-475.
4. Greenspan SL, Myers ER, Maitland LA, Resnick NM, Hayes WC. Fall severity and bone mineral density as risk factors for hip fracture in ambulatory elderly. JAMA. 1994;271(2):128-133.
5. Svejme O, Ahlborg H, Nilsson JÅ, Karlsson M. Early menopause and risk of osteoporosis, fracture and mortality: a 34-year prospective observational study in 390 women. BJOG: An International Journal of Obstetrics & Gynaecology. 2012;119(7):810-816.
7. Nishimura Y, Fukuoka H, Kiriyama M, Suzuki Y, Oyama K, et al. Bone turnover and calcium metabolism during 20 days bed rest in young healthy males and females. Acta Physiologica Scandinavica. Supplementum. 1993;616:27-35.
8. Karlsson MK, Johnell O, Obrant KJ. Bone mineral density in weight lifters. Calcified Tissue International. 1993;52(3):212-215.
9. Nguyen T, Center J, Eisman J. Osteoporosis in elderly men and women: effects of dietary calcium, physical activity, and body mass index. Journal of Bone and Mineral Research. 2000;15(2):322-331.
10. Park EJ, Joo IW, Jang MJ, Kim YT, Oh K, et al. Prevalence of osteoporosis in the Korean population based on Korea National Health and Nutrition Examination Survey (KNHANES), 2008-2011. Yonsei Medical Journal. 2014;55(4):1049-1057.
11. Kim YM, Kim JH, Cho DS. Gender difference in osteoporosis prevalence, awareness and treatment: based on the Korea national health and nutrition examination survey 2008~2011. Journal of Korean Academy of Nursing. 2015;45(2):293-305.
12. Visser M, Kiel DP, Langlois J, Hannan MT, Felson DT, et al. Muscle mass and fat mass in relation to bone mineral density in very old men and women: the Framingham Heart Study. Applied Radiation and Isotopes. 1998;49(5-6):745-747.
13. Cui LH, Shin MH, Kweon SS, Choi JS, Rhee JA, et al. Sex-related differences in the association between waist circumference and bone mineral density in a Korean population. BMC Musculoskeletal Disorders. 2014;15:326.
14. Moayyeri A, Luben RN, Wareham NJ, Khaw KT. Body fat mass is a predictor of risk of osteoporotic fractures in women but not in men: a prospective population study. Journal of Internal Medicine. 2012;271(5):4724-4780.
15. Visser M, Kritchevsky SB, Goodpaster BH, Newman AB, Nevitt M, et al. Leg muscle mass and composition in relation to lower extremity performance in men and women aged 70 to 79: the health, aging and body composition study. Journal of the American Geriatrics Society. 2002;50(5):897-904.
16. Chilibeck PD, Sale DG, Webber CE. Exercise and bone mineral density. Sports Medicine. 1995;19(2):103-122.
17. Kim KH, Lee K, Ko YJ, Kim SJ, Oh SI, et al. Prevalence, awareness, and treatment of osteoporosis among Korean women: The Fourth Korea National Health and Nutrition Examination Survey. Bone. 2012;50(5):1039-1047.
18. Assessment of fracture risk and its application to screening for postmenopausal osteoporosis. Report of a WHO Study Group. World Health Organization Technical Report Series. 1994;843:1-129.
19. Kanis JA, Melton LJ, Christiansen C, Johnston CC, Khaltaev N. The diagnosis of osteoporosis. Journal of Bone and Mineral Research. 1994;9(8):1137-1141.
20. Gillette-Guyonnet S, Nourhashemi F, Lauque S, Grandjean H, Vellas B. Body composition and osteoporosis in elderly women. Gerontology. 2000;46(4):189-193.
21. Baumgartner RN, Stauber PM, Koehler KM, Romero L, Garry PJ. Associations of fat and muscle masses with bone mineral in elderly men and women. The American Journal of Clinical Nutrition. 1996;63(3):365-372.
22. Gonnelli C, Caffarelli C, Cappelli S, Rossi S, Giordano N, et al. Gender- specific associations of appendicular muscle mass with BMD in elderly italian subjects. Calcified Tissue International. 2014;95(4):340-348.
23. Yoo HJ, Park MS, Yang SJ, Kim TN, Lim KI, et al. The differential relationship between fat mass and bone mineral density by gender and menopausal status. Journal of Bone and Mineral Metabolism. 2012;30(1):47-53.
24. Hong W, Cheng Q, Zhu X, Zhu H, Li H, et al. Prevalence of sarcopenia and its relationship with sites of fragility fractures in elderly chinese men and women. PLoS One. 2015;10(9):e0138102.
26. Pereira FB, Leite AF, de Paula AP. Relationship between pre-sarcopenia, sarcopenia and bone mineral density in elderly men. Archives of Endocrinology and Metabolism. 2015;59(1):59-65.
28. Karasik D, Kiel DP. Evidence for pleiotropic factors in genetics of the musculoskeletal system. Bone. 2010;46(5):1226-1237.
29. Szulc P, Blaizot S, Boutroy S, Vilayphiou N, Boonen S, et al. Impaired bone microarchitecture at the distal radius in older men with low muscle mass and grip strength: the STRAMBO study. Journal of Bone and Mineral Research. 2013;28(1):169-178.
|
|
|||||||||||||||||||||||||||||||||||||||