일회성 운동 중 초미세먼지(PM2.5) 과흡입이 마우스 폐의 염증 및 세포사멸 반응에 미치는 영향
Effects of Hyperventilation of Fine Particulate Matter (PM2.5) During a Single Exercise Bout on Inflammatory and Apoptotic Responses in the Mouse Lung
Article information
Trans Abstract
PURPOSE
The purpose of this study was to investigate the effects of hyperventilation in the presence of fine particulate matter (PM2.5) on inflammatory and apoptotic responses in the lungs of mice during a single bout of aerobic exercise.
METHODS
The FVB/N mice were housed in a controlled SPF room and randomly divided into four groups: control (CON, n=7), fine particulate matter exposure (PM, n=7), PM and exercise (PME, n=7), and exercise only (EX, n=7). Acute PM exposure and/or aerobic treadmill exercise were undertaken according to the groups using a specially designed PM treadmill chamber.
RESULTS
Protein expression and phosphorylation of p65 NF-kB in mouse lungs were significantly increased by acute exercise, but not by PM exposure. Basal protein levels and phosphorylation of MAPKs (p38, ERK, and JNK) were significantly increased in the PME group, but were lower in the PM and EX groups. Although the percentage of collagen fibers in lung tissue was not affected by PM exposure, the expression of pro- and antiapoptotic factors BAX, BID, and Bcl-2 was significantly elevated by inhalation of PM during exercise.
CONCLUSIONS
In this study, the MAPKs family was activated by excessive PM inhalation during exercise and similar changes in apoptosis-related signaling were observed. This suggests that even a single bout of inhalation of fine particulate matter during exercise can affect factors associated with inflammation and cell death.
서 론
세계보건기구(World Health Organization, WHO)에 따르면 세계인구의 99%는 미세먼지(particular matter, PM) 대기질 안전 범위에 벗어난 환경에서 거주 중이며 PM으로 인하여 매년 700만 명이 사망한다고 하였다[1]. 미세먼지는 화석연료와 석유를 사용하는 다양한 시설(소각시설, 열처리 시설, 정제시설, 제조시설, 발전시설)의 공정에서 발생하는 연소 과정 중 발생하며 주요 구성성분으로 탄소 입자(Carbonaceous Particles), 황산화물(Sulfur Oxides), 질소산화물(Nitrogen Oxides)로 1급 발암물질인 크롬(Cr), 니켈(Ni), 비소(As), 카드뮴(Cd), 베릴륨(Be), 구리(Cu), 철(Fe)을 포함하여 수백가지의 다양한 물질로 인체에 부정적인 영향을 미친다고 하였다. 미세먼지는 입자의 지름 크기에 따라 10 μm 이하의 미세먼지는 PM10, 2.5 μm 이하를 초미세먼지 PM2.5로 분류한다[2,3]. 그중 PM2.5는 코점막과 후인두에서 걸러지지 않고 침투하여 세포 에너지 대사에 필요한 산소를 전달하는 호흡기계와 심혈관계에 더욱 치명적이다. 특히, 폐의 염증반응을 증가시켜 폐가 딱딱하게 굳는 폐 섬유화를 유발하고[4] 기침, 가래와 같은 증상과 함께 폐용적의 감소 및 폐렴을 유발하여 결국 사망에 이르게 할 수도 있다. 한편, 미세먼지는 염증인자 인터루킨-1베타(interleukin-1Beta, IL-1β)와 형질전환 성장인자-베타1(Transforming growth factor-beta1, TGF-β1)의 수준을 증가시켜 폐의 콜라겐 침착을 유도함으로써 폐 섬유화를 유발하는 것으로 나타났다[5].
미세먼지의 흡입은 과도한 활성산소(Reactive oxidative species, ROS)를 유발한다. 적정수준의 ROS는 신호전달 매개체로서 세포의 발달과 구조 재형성에 작용하지만, 과도한 ROS 등 스트레스자극을 통하여 핵인자카파비(Nuclear factor kappa-light-chain-enhancer of activated B cells, NF-κB) 및 mitogen-activated protein kinases (MAPK) 신호경로의 활성화를 통해서 염증수준을 증가시킨다[6,7]. 한편 세포사멸은 세포의 스트레스 상황에서 조직의 항상성을 유지하기 위한 프로그램화 된 과정이며, 관련 단백질은 항세포사멸 단백질과 세포사멸 단백질로 구성되어 있다. 특히, Bcl-2 계열 단백질인 Bcl-2는 항세포사멸 작용을 하며 반대로 BAX, BID 단백질은 세포사멸을 유도하여 서로 길항 작용을 통한 세포사멸의 균형을 유지한다[8]. 과도하게 축적된 세포사멸은 세포 수를 감소시키고 만성 폐 질환을 야기하는 것으로 알려져 있으나 이에 반해 비약물요법인 운동은 폐 섬유화의 개선 및 폐활량을 증진 시키는 것으로 알려져 있다[9]. 즉 유산소 운동은 항산화 수준 향상과 항염증인자의 증가를 통해 염증인자를 감소시킴으로써 폐 염증, 산화스트레스 및 세포사멸을 감소시키고, 폐 섬유증을 유발하는 염증인자 IL-1β, TGF-β1의 감소와 콜라겐을 제거하여 폐 섬유증을 예방 및 완화시킨다[10]. 이와 같이 운동은 폐의 병리-생리학적 측면에서 긍정적인 영향을 미치는 것으로 알려져 있으나, 초미세먼지 흡입을 동반한 급성 운동 시 나타나는 in vivo 영향에 관한 연구는 부족한 실정이다. 따라서 본 연구는 자체적으로 최초 구축한 마우스 미세먼지 운동 장치 챔버를 이용하여 운동 중 초미세먼지 1회성 노출이 폐 염증반응 기전 및 세포사멸과 폐 섬유화에 미치는 영향에 대해 관찰하였다.
연구 방법
1. 연구 대상
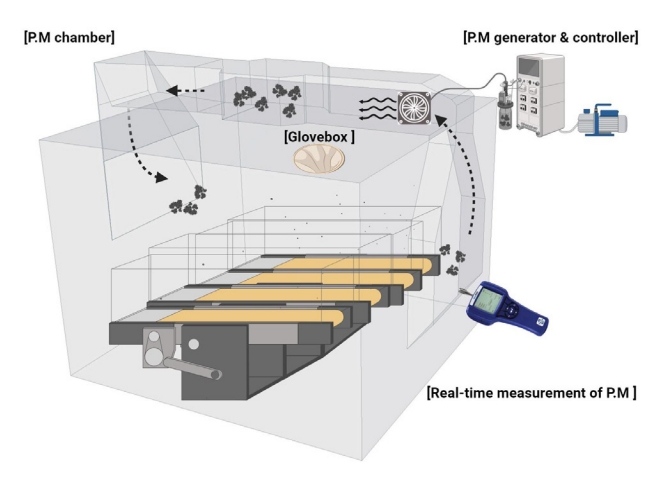
생후 3주 된 암컷 FVB/N 마우스(n =28)는 명암 12시간(09:00-21:00) 및 온도(22°C)와 습도(40-60%)가 조절된 특정 병원균이 없는(specific pathogen free, SPF) 시설에서 사육되었으며, 일반적으로 사용되는 설치류 사료(단백질 20.5%, 섬유질 8%, 지방 3.5%, DBL)와 함께 물을 자유롭게 섭취할 수 있게 하였다. 1주 동안 적응 기간 후 무작위 선별을 통해 대조군(CON, n =7), PM 노출군(PM, n =7), PM 노출+트레드밀 운동군(PME, n =7), 트레드밀 운동군(EX, n =7) 등 모두 네 집단으로 구분하였다. 실험이 완료된 직후 30분 후, 마우스들은 Ethyl ether를 이용한 흡입 마취 및 경추 탈골법을 통한 안락사가 진행되었으며 이후 폐 조직을 적출하여 실험 분석에 사용되었다. 본 연구는 연구소의 동물보호 및 이용 위원회(IACUC, 승인번호 IH 190211-616)의 승인 후 진행되었으며, 본 연구의 연구집단 및 실험 도식도는 Fig. 1과 같다.
2. 연구절차
1) PM 트레드밀 챔버
트레드밀 운동은 먼지 공급기, 트레드밀, 순환 팬과 글러브 박스로 구성된 PM 트레드밀 챔버(Windas, Korea)를 사용하게 실시되었다. 미세먼지 공급기는 PM 저장, 먼지 공급 모터, 먼지 흡입 장치를 포함하고 있으며, 고체 상태의 PM을 균일한 농도로 공급될 수 있도록 전기 진동기가 갖추어져 있다. 6개의 레인의 마우스 트레드밀은 각도와 속도 조절이 가능하며 그룹에 따라 운동 중 순환 팬을 통해 챔버 내부로 PM을 일정수준의 농도를 유지하였다.
2) 미세먼지 노출 설정 및 운동 프로토콜
PM2.5 농도는 미국의 ISO 12103-1 (Power Technology Inc.)을 사용하여 측정하였으며, 미세먼지 농도는 미세먼지 ‘아주 나쁨 수준’인 100 μg/m3 수준으로 유지하며 90분 동안 흡입되었다. 운동 수행은 오르막 경사(5°)를 적용하여 초기 30분 동안 4 m/min의 속도로 시작하여 점진적으로 15 m/min까지 증가시켰으며, 이후 60분 동안 15 m/min으로 유지되어 모두 90분 동안 1회 진행하였다(Fig. 2).
3) Immunoblotting
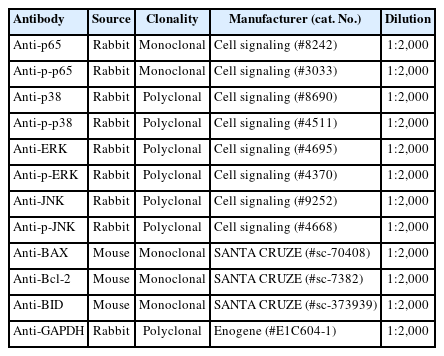
실험 후 적출 된 폐 조직은 액체질소 급속 동결 이후 -80℃에 보관되었다. 동결된 폐 조직은 차가운 RIPA 완충액에 넣고 FastPrep-24TM 5G bead beating system (MP biomedicals, USA)를 이용하여 균질화(Homogenizing) 시킨 후, 12,000 RPM에서 15분간 원심 분리하여 상층액만 수집하여 사용하였다. 단백질 농도는 Pierce BCA 단백질 분석 키트를 사용하여 측정하였으며, 각 샘플들은 20 μg의 단백질 농도로 polyacrylamide gel에 loading 후에 실온에서 2시간 동안 단백질을 SDSPAGE 전기영동을 통해 단백질을 분리하였다. 분리된 단백질은 PVDF membrane으로 옮긴 후 1차 항체 처리 전 2시간 동안 skim milk (5%) 용액 처리하였으며, 항원항체 반응에 사용된 항체는 Table 1과 같다. 1차 항체는 제조사의 매뉴얼대로 4℃에서 overnight (12시간 이상)로 처리하였다. 이후 TBST용액으로 10분씩 3회 세척한 후 2차 항체 Antirabbit IgG (Cell Signaling Technology, MA, USA)으로 1시간 처리한 후 Luminol 반응을 위해 PVDF membrane을 TBST로 1회 세척한 후 ECL 용액을 골고루 분주하여 반응시켰다. Chemidoc (Bio-Rad, CA, USA) 분석 시스템을 사용하여 이미지 촬영하였으며, 단백질 발현 정도는 Image lab 소프트웨어(Bio-Rad, CA, USA)를 활용 하였다.
4) 폐 조직 형태학적 분석
마우스 폐 조직은 4%의 포롬알데히드(sigma, 50-00-0)에 2일 동안 반응한 후 70% 에탄올로 탈수 과정 및 세척을 거쳤다. 폐 조직은 자일렌으로 처리 후 5 μm 두께로 절편하여 헤마토실린과 에오신(H&E)과 Masson’s trichrome (MT)으로 염색 후 파라핀을 덮어 박절 시켰다. 이후 Leica DM i8 현미경(Leica, Germany)을 이용하여 폐 조직의 단면적을 촬영하였으며, 이미지는 image-j 소프트웨어(NIH, USA)를 이용하여 픽셀단위로 수치화하여 분석하였다.
3. 자료처리방법
통계적 자료 분석은 SPSS (21.0 소프트웨어, spss Inc.)를 사용하여 분석하였다. 실험 데이터는 평균±표준 오차(SEM)로 나타내었으며, 집단 간 비교는 표준 유의 수준(p < .05)을 설정하여 독립 T-test 혹은 일원 분산 분석(One-way between measures ANOVA) 및 Tukey-Kramer의 사후 검정을 통하여 분석하였다.
연구 결과
1. 1회 트레드밀 운동에 따른 NF-kB 발현
염증성 싸이토카인 발현 조절 인자인 NF-kB의 발현 및 활성화를 관찰하기 위해 p65 및 phospho(p)-p65 단백질을 정량화하였다(Fig. 3A). 그 결과 p65 수준은 PM 그룹이 CON 그룹에 비해 11% 감소하였으나 유의한 차이는 나타나지 않았다. PM 대비 PME 집단에서 72%, EX 집단에서 85% 각각 증가하였지만, EX 집단에서만 유의한 증가를 나타내었다(p<.05) (Fig. 3B). P-p65의 수준은 CON 대비 PM 집단에서 19% 감소하였으나 유의한 차이는 없었으며, PME 집단에서 CON 대비 42%, PM 대비 75% 증가하였으며(p<.05) EX 그룹과 비슷한 값을 나타내었다(Fig. 3C). P-p65/p65 수준은 CON 대비 PM 집단에서 15% 감소하였지만 유의한 차이는 나타나지 않았으며, PME 집단에서는 PM 및 EX에 비해 각각 54% 및 45% 증가하였지만 유의한 차이를 보이지 않았다(Fig. 3D).

The chart illustrates the variation in the change of p65 Western blot analysis of Increasing quantification of western blots for protein expression of p65, p-p65, GAPDH. Values are expressed in mean±SEM, Significant difference from the baseline value (*p<.05 vs. CON, #p<.05 vs. PM). Control group (CON, n=7), fine particulate matter exposure group (PM, n=7), PM and exercise group (PME, n=7), and exercise only group (EX, n=7).
2. 1회 트레드밀 운동에 따른 MAPK 발현
세포의 산화스트레스 및 염증 매개물질을 유도하는 MAPK의 발현 및 활성화를 관찰하기 위해 p38 미토겐 활성화 단백질 키나아제(p38 mitogen activated protein kinase, MAPK, p-p38), 세포 외 신호조절 인산화효소(extracellular signal-regulated kinase, ERK, p-ERK), Jun-말단인산화효소(c-Jun N-terminal kinase, JNK, p-JNK) 단백질을 정량화하였다(Fig. 4A). 그 결과 p38 수준은 CON 대비 PM 집단에서 25% 감소하였으나 유의한 차이는 나타나지 않았다. PME 집단에서는 PM 대비 60% 수준의 증가가 나타났으며(p<.05), EX 집단은 PME 대비 49% 낮은 값을 보였다(p<.05) (Fig. 4B). p-p38 수준은 CON 대비 PM 집단에서 24% 증가하였으나 유의한 차이는 나타나지 않았다. PME 집단에서는 PM 그룹과의 비교에서는 72% 유의하게 증가하였고(p<.01), EX 집단은 PME 대비 50% 감소하였다(p<.001) (Fig. 4C). P-p38/p38 비율은 CON 대비 PM 집단에서 50% 증가하였으나 유의한 차이는 나타나지 않았다. 그러나 PME 집단에서 62% 수준으로 증가하였다(p<.05) (Fig. 4D). 특히 ERK 수준은 PME 집단에서 PM 대비 2배 이상 증가된 발현을 나타내었다(p<.05). PME 대비 EX 집단에서는 31% 낮은 수준을 보였으나 유의한 차이는 나타나지 않았다(Fig. 4E). P-ERK 수준은 CON 대비 PM 집단에서 42% 감소하였으나 유의한 차이는 나타나지 않았다. 그러나 PME 집단에서는 85% 수준으로 유의하게 증가된 값을 나타내었다(p <.01). PME 그룹에서는 PM 대비 2배 이상 유의하게 증가하였으며(p<.001), EX 집단은 PME 대비 46% 낮은 수준을 보였다(p<.05) (Fig. 4F). P-ERK/ERK의 수준은 CON 대비 PM 집단에서 22%, PME 집단에서 24% 그리고, EX 집단에서 14% 증가하는 경향을 나타내었지만 유의한 차이는 없었으며, PME 대비 EX 집단과의 차이 또한 나타나지 않았다(Fig. 4G). JNK의 수준은 CON 대비 PM 집단에서 21% 감소하였지만 유의한 차이는 나타나지 않았다. 그러나 PME 집단에서 CON과 PM 대비 각각 97%, 148% 증가하였으며(p<.001), EX 집단은 PME 대비 44% 낮은 수준을 보였다(p<.05) (Fig. 4H). P-JNK 발현량은 CON 대비 PM 집단에서 17% 감소하였지만 유의한 차이는 나타나지 않았다. 그러나 PME 집단에서 CON과 PM 대비 각각 68% 및 102% 증가하였으며(p<.05) (p<.01), EX 집단은 PME 대비 51% 낮은 발현량을 나타냈다(p<.01) (Fig. 4I). P-JNK/JNK의 비율은 집단 간의 유의한 차이는 나타나지 않았다(Fig. 4J).
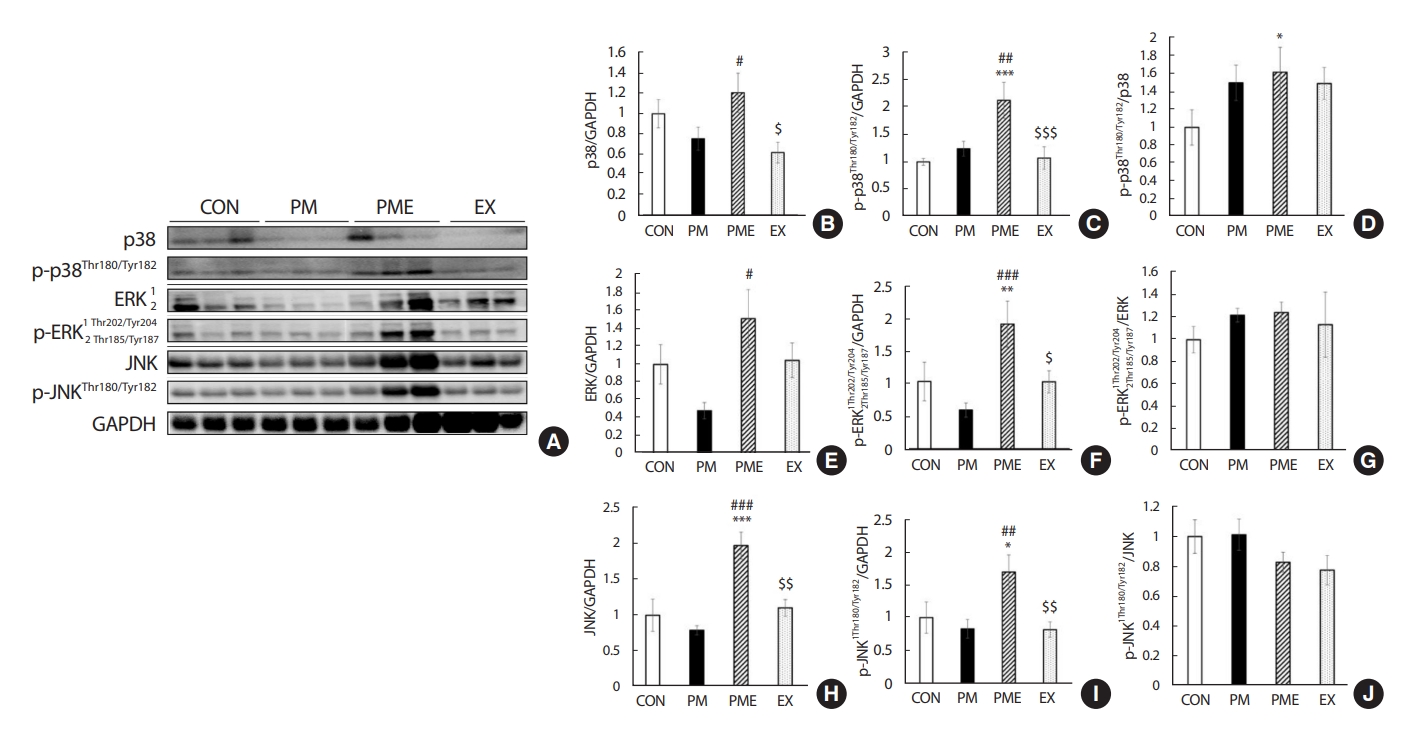
The change of variation subfactor of MAPK family. Western blot analysis of Increasing quantification of western blots for protein expression of p38, p-p38, p38/p-p38, ERK, p-ERK, ERK/p-ERK, JNK, p-JNK, JNK/p-JNK. Values are expressed in mean±SEM, Significant difference from the baseline value (*p<.05 vs. CON, **p<.01 vs. CON, ***p<.001 vs. CON, #p<.05 vs. PM, ##p<.01 vs. PM, ###p<.001 vs. PM, $p<.05 vs. PME, $$p<.01 vs. PME, $$$p<.001 vs. PME). Control group (CON, n=7), fine particulate matter exposure group (PM, n=7), PM and exercise group (PME, n=7), and exercise only group (EX, n=7).
3. 1회성 초미세먼지 처치 및 트레드밀 운동을 통한 마우스 폐의 섬유화
폐 조직의 형태 및 폐 섬유화를 분석하기 위해서 폐 조직을 염색한 후 Leica DM i8 현미경으로×10 배율로 촬영하여 분석하였다. 그 결과 집단 별 폐 조직의 형태학적 변화는 관찰되지 않았으며, Masson’s trichrome stain을 통한 폐 조직의 콜라겐 섬유의 비율 또한 그룹 간의 차이가 나타나지 않았다(Fig. 5).
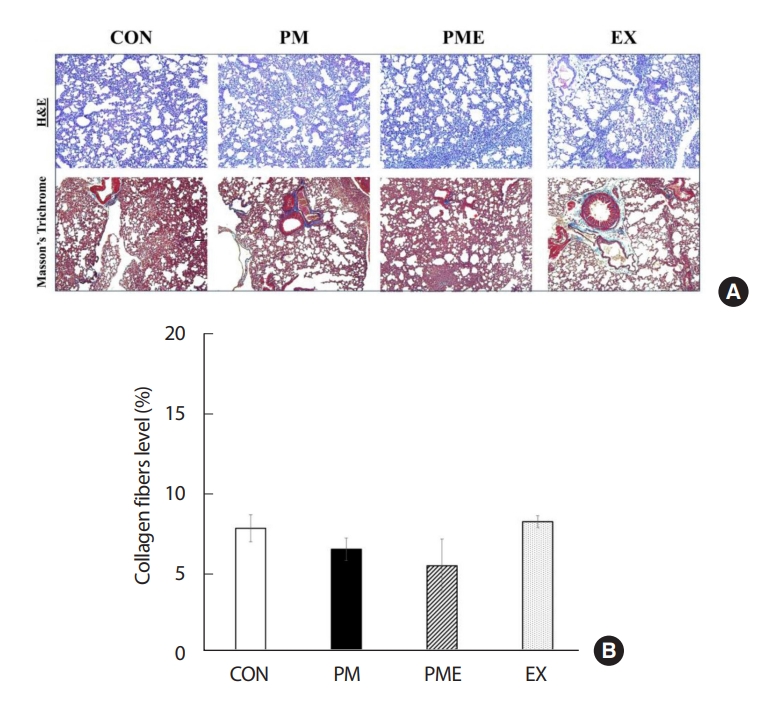
The image of lung tissue. To investigate the percentage of collagen-positive area caused by inhalation of fine dust, we assessed the extent of collagen deposition in lung tissues. The values are expressed in mean±SEM, Significant difference from the baseline value. Control group (CON, n=7), fine particulate matter exposure group (PM, n=7), PM and exercise group (PME, n=7), and exercise only group (EX, n=7).
4. 1회 트레드밀 운동을 통한 마우스 폐의 세포사멸 유발 인자의 변화
폐 조직 세포사멸 유발 인자들의 발현 및 활성화를 관찰하기 위해 BAX, Bcl-2 및 BID 단백질을 정량화하였다(Fig. 6A). BAX의 발현 수준은 CON 대비 PM 집단에서 35% 감소하였지만 유의한 차이가 나타나지 않았다. 하지만 PME 집단에서 64% 유의하게 증가하여 PM 대비 1.5배 유의하게 증가된 수준을 보였다(p<.05) (Fig. 6B). Bcl-2의 수준은 CON 대비 PM 집단과 PME 각각 24% 감소 혹은 43% 증가하였지만 유의한 차이는 나타나지 않았다. 그러나 PM 대비 PME 집단과 EX 집단에서 각각 2배 정도 높은 수준을 나타내었으며(p<.05), EX 집단은 CON 대비 54% 유의하게 높은 수준을 보였다(p<.05) (Fig. 6C). Bcl-2/BAX의 발현 수준은 CON 대비 PM 집단에서 14% 증가하였지만 유의한 차이는 나타나지 않았다. 또한 PME 집단에서는 PM 대비 24% 감소한 값을 보였지만 역시 유의한 차이는 나타나지 않았으며, EX 집단에서 1.5배 이상 높은 값을 나타내었다(p<.05) (Fig. 6D). BID의 발현 수준은 CON 대비 PM 집단에서 26% 감소하였으며 유의한 차이는 나타나지 않았다. 그러나 PME 집단에서 PM 대비 2배 정도 유의한 증가(p<.01)를 나타냈으며, EX 집단은 PME 대비 40% 감소를 나타냈다(p<.05) (Fig. 6E).

The variation of apoptosis trigger factor through one-time treadmill exercise in lung tissue. Western blot analysis of apoptosis trigger factor markers and quantification of western blots for protein expression of BAX. Bcl-2, BID, GAPDH. Values are expressed in mean±SEM, Significant difference from the baseline value (*p<.05. vs. CON, **p<.01 vs. CON, #p<.05 vs. PM, ##p<.01 vs. PM, $p<.05 vs. PME, $$p<.01 vs. PME). Control group (CON, n=7), fine particulate matter exposure group (PM, n=7), PM and exercise group (PME, n=7), and exercise only group (EX, n=7).
논 의
미세먼지는 주로 호흡을 통해 공기와 함께 흡입되는 물질로서, 지속적인 노출은 폐 기능을 저하시키고 호흡기 및 심혈관계 질환과 폐암 유병률을 증가시키는 것으로 알려져 있다[11,12]. 최근 연구에 따르면 미세먼지의 비강 내 투여를 통한 흡입은 폐 조직의 산화스트레스 및 ROS 수준을 증가시킴으로써 세포사멸을 유발할 수 있음을 보고하였지만, 호흡계를 통한 미세먼지의 급성 흡입이 염증반응 및 세포사멸 신호에 미치는 영향은 잘 알려져 있지 않다[13,14]. 최근 주목할 연구로서 1회성 운동 중 초미세먼지 흡입이 동맥 경직도 및 혈압에 부정적인 영향을 미친다고 하여 초미세먼지가 운동 중 심혈관계에 미치는 영향의 중요성을 시사한다고 할 수 있다[15]. 운동은 비약물적 치료 요법으로써 다양한 신체 손상과 질병 개선에 효과적이며, 그중 유산소 운동은 미세먼지 침투로 발생되는 항산화 방어계의 불균형과 염증수준 및 세포사멸을 완화시키고 폐활량 및 폐 기능을 개선시키는 것으로 보고되고 있다[10,16,17]. 본 연구는 일회성 급성 초미세먼지 흡입이 폐의 염증 및 세포 사멸 신호 및 폐 섬유화 등의 조직학적 변화에 미치는 영향에 대해 알아보기 위하여 특수 제작된 마우스 PM 트레드밀 챔버를 이용하였다.
마우스 모델의 미세먼지 기관지 투여 후 기관지 상피세포 조직에서의 폐 염증을 분석한 연구에 따르면 미세먼지는 기관지 상피세포 조직의 활성산소와 ROS를 증가시키는 것으로 알려졌다[6]. 몇몇 연구에서 세포의 증식과 생존 및 성장에 관여하는 ERK, JNK, p38 및 NF-κB 경로의 활성화를 통해 세포사멸을 유발할 수 있는 TNFα, IL-1β, 인터루킨-6 (interleukin-6, IL-6), 인터루킨-8 (interleukin-8, IL-8)의 수준의 증가가 유도된다고 보고되었지만[18,19], 일회성 운동 중 초미세먼지 과흡입에 따른 효과를 검증한 연구는 없었다. 본 연구의 NF-κB 경로에 있어 p65 및 p65 인산화 발현 수준은 미세먼지 노출 유무와 무관하게 운동에 따른 증가만 관찰되었다. 하지만 MAPKs family인 p38와 ERK 및 JNK의 발현양은 급성 미세먼지 노출에 따른 변화는 없었으나 운동 중 과호흡으로 인한 발현양 및 인산화가 증가가 관찰되어 산화스트레스 및 염증성 반응 신호전달에 있어 본 연구에 적용된 운동 강도, 형태, 시간 및 미세먼지 처치 수준의 경우 운동 유도 미세먼지 과호흡은 NF-κB의 경로가 아닌 MAPKs 신호에 의존적임을 확인할 수 있었다.
MAPKs의 활성화가 세포사멸을 유발하는 선행연구에 따르면 세포 사멸은 pro-apoptotic ligands의 신호로 인한 카스파제 활성으로 인한 외인성 경로와 pro-apoptotic 단백질 활성을 통한 내인성 경로로 발생된다[20,21]. 세포사멸은 염증을 증가시키는 경로이자 항상성 유지를 위해 프로그램화 된 과정으로써 Bcl-2 계열 단백질인 Bcl-2/BAX 수준 변화와 BH3 단백질인 Bid의 카스파제-8에 의해 절단된 t-Bid로 인한 BAX 활성화를 통해서 진행된다[8,22]. 또한 미토콘드리아의 세포사멸 신호를 통해 미토콘드리아의 막전위를 변화시키고, 미토콘드리아 내막에 위치한 사이토크롬c를 방출한다[13]. 사이토크롬c의 방출은 기질을 절단하여 세포사멸에 관여하는 카스파제-9 및 카스파제-3가 활성을 유발하며, 이에 따라 BAX 수준이 증가하고 Bcl-2 수준을 감소시킨다[23]. 선행연구에서 미세먼지 급성 노출은 과도한 ROS를 발생시키고 미토콘드리아 손상시킴으로써 마우스 폐 조직의 섬유화, BAX/Bcl-2, 카스파제-9 및 카스파제-3의 발현을 증가시킨다고 하였다[13]. 한편 1주일 동안의 미세먼지 흡입 노출은 산화스트레스, ROS 및 염증 수준을 높이고 트레드밀 운동을 통한 미세먼지 과흡입으로 인해 관련 마커들이 증가되지 않고 오히려 감소된 결과를 보였다. 또한 미세먼지로 증가된 ROS에 반응한 PINK1/Parkin 경로로 손상된 미토콘드리아를 선택적으로 분해하는 자가포식(mitophagy)을 통해 산화스트레스, ROS 및 염증을 감소시키고 폐 조직의 섬유화와 세포사멸을 억제 및 감소시킨다고 알려져 있는데 선행연구의 1주간의 초미세먼지 흡입 및 운동 처치에서는 차이가 나타나지 않았다[24-26]. 이는 본 연구 결과와 종합해 볼 때 운동을 통한 초미세먼지의 급성 과호흡은 산화스트레스 및 염증성 반응을 증가시키나 1주간의 단기간 처치로도 초미세먼지에 대한 항산화 및 항스트레스 반응이 운동으로 매개될 수 있음을 시사한다.
폐 조직의 형태학적 손상을 확인되지 않았으며 폐 섬유화 마커인 콜라겐 섬유(Collagen fibers)의 비율 또한 그룹 간의 차이는 나타나지 않았다. 동일한 조건에서의 1주간의 초미세먼지 흡입으로 인한 콜라겐 섬유 비율의 증가 및 운동으로 인한 감소와는 대조적으로 폐 조직 섬유화의 진행 시간에 있어 1회성 노출은 충분치 못한 것으로 보여진다[26]. 중-단기간의 초미세먼지 노출과는 달리 1회성 운동으로 인한 초미세먼지의 과흡입은 폐의 콜라겐 섬유 형성에는 차이를 보이지 않으나 MAPKs 및 세포사멸 신호의 자극으로 인해 초미세먼지에 지속적 노출될 경우 폐 섬유화 병변의 진행을 가속화시킬 수도 있다. 다만 본 연구에서 1회성 노출 후 30분 내 안락사 및 폐 조직 적출로 인해 1회성 노출 후의 폐섬유화 진행의 평가가 시간별로 이루어지지는 못하였다. 한편 운동 중 초미세먼지 과흡입에 따른 폐조직의 염증반응 및 섬유화는 운동의 보호 효과 및 운동 중 초미세먼지 과흡입에 따른 부정적인 효과가 같이 고려되어야 한다. 본 연구의 1회성 운동 및 선행연구의 1주간의 운동을 통한 초미세먼지 과흡입의 연구 설계뿐만 아니라 장기간의 처치 및 다양한 운동 강도와 초미세먼지 농도를 적용한 검증이 필요하다[27]. 세포사멸 인자 BAX, BID 및 항세포사멸 인자 Bcl-2의 단백질 수준 모두 일회성 초미세먼지 흡입에 따른 차이는 없었으나 운동 중 초미세먼지 과흡입에 따른 증가가 관찰되었다. 이는 세포사멸 유도 및 방어에 있어 ROS 등의 세포 산화스트레스와 항산화 능력, 미토콘드리아 세포사멸 경로를 통한 기전 등이 다발성으로 자극되어 진행된 것으로 보인다[28,29]. 본 연구의 결과 일정기간 미세먼지 노출에 관한 선행연구들과는 달리 폐 콜라겐 섬유화를 증가시키기는 않았지만 운동을 동반하였을 때 세포사멸 인자의 조절 반응은 충분히 나타났다[30-33]. 세포 스트레스 및 염증반응의 전사(transcription)조절로서 NF-κB p65 인산화 수준은 미세먼지 흡입에 따른 차이 없이 운동자극으로 증가하였으며, 반면에 MAPKs 및 세포사멸 조절 인자들의 단백질 수준은 운동 중 미세먼지 과흡입으로 증가되어 상반된 특이점을 나타내어 향후 미세먼지 환경에서의 급성 운동 시 항산화방어능력, 항염증인자 및 산화스트레스와 세포사멸 방어 메커니즘 연구에 있어 MAPKs 인자들의 억제를 통한 접근 방법에 주목할 필요성이 제기된다. 또한 본 연구에서는 확인되지 않았으나, 선행연구에 따르면 장기간 운동은 세포사멸 인자의 긍정적 조절로 인해 손상된 근육 및 심장과 같은 주요 장기의 기능 회복에 도움을 준다 하였으며, 이는 또한 미세먼지 침착으로 인한 폐섬유화에 기인한 기능적 감소를 방어 혹은 회복시킬 수 있는 가능성을 시사한다[34,35]. 미세먼지의 호흡기 내 침투가 폐 조직에 미치는 영향과 운동의 효과는 일부 연구에서 확인되었지만 본 연구와 같이 급성 운동 중 미세먼지 흡입으로 인한 폐 조직의 염증 반응 및 세포사멸 신호의 변화를 관찰한 보고는 없었다. 다만 본 연구에서 제시한 연구결과는 단일 설정 값의 초미세먼지 농도, 노출 시간 및 운동 강도가 적용되어 초미세먼지의 세포 조직학적 영향을 규명하기에는 일부 한계가 있으며, 폐의 병리-생리학적 기능적 평가가 이루어지지않아 실제 호흡계에 미치는 영향을 알 수는 없었다. 또한 본 연구에서 사람의 기준으로 쓰여진 미세먼지 농도는 실제 호흡 및 대사량에 있어 차이를 보이는 마우스에 적용하기에는 한계가 있을 수 있다. 향후 다양한 미세먼지 농도 및 노출 기간을 통한 운동과 미세먼지 체내 방어 효과를 적용함으로써 후속 연구에 있어 운동 중 초미세먼지 흡입에 따른 인체 위해 효과 검증에 중요한 단서를 제공할 것으로 사료된다.
결 론
운동 및 초미세먼지 처치에 따른 산화스트레스 및 염증반응을 매개하는 신호에 있어 특히 MAPKs 군들의 경우 운동 중 초미세먼지 초과 흡입으로 인한 활성화가 나타났으며, 세포사멸 관련 시그널 또한 비슷한 변화가 관찰되었다. 이는 운동 중 미세먼지 과흡입으로 인한 염증 반응 및 세포 항상성에 대한 기전에 있어 MAPKs 신호경로를 타겟으로 한 다양한 미세먼지 농도 노출 및 운동 강도, 기간의 후속 연구가 필요함을 시사한다.
Notes
이 논문 작성에 있어서 어떠한 조직으로부터 재정을 포함한 일체의 지원을 받지 않았으며, 논문에 영향을 미칠 수 있는 어떠한 관계도 없음을 밝힌다.
AUTHOR CONTRIBUTIONS
Conceptualization: Z Zhang, D Yeom; Data curation: D Yeom, K Lee; Formal analysis: D Yeom, J Park; Funding acquisition: D Yeom; Methodology: J Park, J Jang, B So; Project administration: J Jang; Visualization: D Yeom; Writing - original draft: Ziyi Zhang, D Yeom; Writing - editing: Z Zhang, C Kang.