지역사회 노인의 거동장애증후군과 비타민 D 수준과의 연관성
Association Between Dysmobility Syndrome with Serum Vitamin D in Community-Dwelling Older Adults
Article information
Trans Abstract
PURPOSE
To investigate the association between serum vitamin D levels and dysmobility syndrome (DMS) in community-dwelling older adults.
METHODS
This cross-sectional study included 390 older adults (80.7% female) with a mean (±SD) age of 74.8±5.5 years. Based on high body fat level, osteoporosis, low muscle mass, slow gait speed, low grip strength, and fall(s), participants were classified as robust, pre-DMS, or DMS. Based on serum vitamin D levels, subjects were classified as high 33%, middle 33%, and lower 33%, and/or ≥20 ng/mL and <20 ng/mL, respectively. Logistic regression analyses were performed to determine odds ratios (OR) for serum vitamin D levels in DMS.
RESULTS
There were linear increases in DMS variables such as high body fat (p=.040), slow gait speed (p=.048), fall(s) (p=.005), and prevalence of DMS (p=.001) across decremental serum vitamin D levels. Compared with the high vitamin D group (as reference), the low 33% group exhibited a higher OR for DMS (OR 2.776, p=.02). Similarly, compared with the vitamin D ≥20 ng/mL group (as reference), the <20 ng/mL group had a higher OR for DMS (OR 2.486, p=.002).
CONCLUSIONS
Findings of this study suggest higher serum vitamin D levels through promoting outdoor physical activity and a healthy diet are key components protecting older adults against DMS.
서 론
최근 우리나라는 평균수명의 증가 및 출산율 감소로 인해 급격한 고령화가 진행되고 있으며, 2022년 기준으로 우리나라 노인인구 비율은 17.5%로 나타났고, 이러한 추세라면 2025년에는 20.6%로 초고령사회, 2050년에는 전체 인구 중 노인인구 비율이 40%를 상회할 것으로 예상하고 있다[1]. 이에 의료불균형 해소, 의료서비스 확대, 경제적 지원 등의 대책 마련이 사회·국가적 차원에서 이루어지고 있을 뿐만 아니라 개인적 차원의 건강관리를 통한 질병예방 및 건강한 노화에 대한 관심이 꾸준히 증가하고 있다[2].
노화와 더불어 골량 및 근육량 감소, 체지방 증가 등 급격한 신체구성의 변화가 일어나며, 이러한 각 신체구성의 부정적 상태에 대해 골감소/골다공증, 근감소증, 비만 등의 표현을 사용하고 있다. 거동장애증후군(dysmobility syndrome, DMS)은 뼈, 근육, 지방에 대한 비정상적 신체구성 표현형을 동시에 동반하는 상태인 골다공증-근감소성 비만(osteosarcopenic obesity, OSO)에 낙상 및 신체적 기능 저하가 혼합된 개념으로 Binkley et al. [3]에 의해 정의되었으며, 유사한 개념으로 운동기능 저하 증후군(locomotive syndrome)이라고 표현되기도 한다. 이러한 거동장애증후군은 골다공증, 낙상, 근육량, 보행, 근력, 비만에 근거하여 진단하며, 우리나라 노인의 거동장애증후군 유병률은 약 20%인 것으로 보고되고 있다[4].
거동장애증후군은 과거 대사증후군을 고혈압, 고지혈증, 당뇨 등에 근거하여 하나의 범주로 접근한 것과 유사하게 노년기 신체적 변화를 하나의 문제로 간주하여 근골격계 질환의 위험을 예측하는 도구로 사용되고 있다[3]. 이러한 거동장애증후군은 최근 연구에서 정신질환, 퇴행성 질환 등 주요 노년기 질환과 밀접한 연관성이 있을 뿐만 아니라 이로 인한 조기 사망과도 밀접한 연관성이 있는 것으로 보고되고 있다[5,6]. 구체적으로, 미국 노인을 대상으로 실시한 Chen et al. [7]의 연구에서 거동장애증후군 세부지표는 대사증후군과 유의한 양의 상관관계가 있다고 보고한 바 있으며, 일본 여성 노인을 대상으로 실시한 Nakamura et al. [8]의 연구에서는 심혈관 대사질환 위험인자의 수가 많을수록 운동기능 저하 증후군이 심각했다고 보고한 바 있다. 또한, 사망과 관련하여, 미국과 대만 중 ·고령자를 대상으로 실시한 Looker [9]와 Lee et al. [10]의 연구에서도 거동장애증후군이 심각할수록 사망 위험이 높게 나타났다고 보고한 바 있다. 즉, 이러한 선행연구들을 볼 때, 노년기 거동장애증후군은 만성 퇴행성질환 및 조기사망과 밀접한 연관성이 있음은 물론, 중년 이후 건강관리에 있어 중요한 요인이 될 수 있다는 점을 시사한다.
한편, 피하에 있는 7-dehydrocholesterol이 자외선의 자극을 통해 합성되는 것으로 알려져 있는 비타민 D는 체내에서 골대사, 칼슘 항상성 유지 등에 관여하는 것으로 알려져 있으며, 오랜 연구를 통해 건강요인과도 밀접한 연관성이 있는 것으로 보고되고 있다[11,12]. 특히, 노년기 비타민 D 수준은 인지기능 및 우울증 등 정신건강과 연관성이 있을 뿐만 아니라 거동장애증후군의 세부지표인 체력, 보행기능, 독립생활, 근감소증, 골다공증 등 전반적인 근골격계 건강에 대한 독립예측인자로 알려져 있다[13,14]. 이와 관련한 Gschwind et al. [15]과 Kim et al. [16]의 연구에서 유럽 및 국내 중·고령자의 비타민 D 수준은 보행기능, 근감소증, 골다공증과 밀접한 연관성이 있었다고 보고한 바 있으며, 유럽 중 ·고령자를 대상으로 실시한 Iolascon et al. [17]의 연구에서도 비타민 D 수준이 거동장애증후군으로 인한 골절 위험에 대해 중요한 매개작용을 할 수 있다고 보고한 바 있다. 즉, 이러한 선행연구들을 보면, 중년 이후 비타민 D 수준은 거동장애증후군의 세부지표인 신체구성 및 기능뿐만 아니라 그로 인한 건강상태와 밀접한 연관성이 있는 것으로 판단된다. 이에 노년기 비타민 D 수준은 거동장애증후군의 전반적인 상태와 밀접한 연관성이 예견됨에도 불구하고, 국내 노인을 대상으로 실시한 연구는 매우 미흡한 실정이며, 국외 선행연구에서도 거동장애증후군의 세부지표와 비타민 D의 연관성 검증에만 국한되어 있는 실정이다. 따라서, 본 연구에서는 국내 노인의 비타민 D 수준이 전반적인 거동장애증후군 상태와 어떠한 연관성이 있는지 검증하는 것을 주요 목적으로 하였다.
연구 방법
1. 연구 대상
본 연구는 근골격계 및 보행문제, 심장질환, 장애 등을 포함한 특별한 의학적 질환이 없고 신체구성 및 체력 측정에 제한이 없는 경기도 S 시 지역에 거주하는 65세 이상 노인 458명을 대상으로 실시하였으며, 대상자 모집 후 신체구성 측정 누락 23명, 보행측정 누락 20명, 채혈 누락/거부 25명을 포함하여 68명을 제외한 390명을 최종 대상자로 선정하였다. 또한, 모든 대상자는 자발적인 참여의사를 통해 연구에 참여하였으며, 연구 시작 전 연구목적 및 방법에 대해 구두와 문서로 자세히 설명한 뒤, 참여 동의서에 서약을 받아 진행하였다. 또한 본 연구는 S 대학교 기관윤리심의위원회의 승인(IRB-2015-09-001-002)을 받아 진행되었으며, 성별에 따른 측정변인을 비교한 대상자 특성은 Table 1과 같다.
2. 측정변인 및 방법
1) 신체구성 및 혈압
신장은 신장계(DS-102, Jenix, Seoul, Korea)를 이용하여 측정하였다. 체중, 체지방률, 사지 근육량, 골밀도 등 전반적인 신체구성은 금속 물질이 포함되지 않은 옷으로 갈아입은 뒤, 바르게 누운 자세에서 이중 에너지 X-ray 방사선 흡수 계측(dual-energy X-ray absorptiometry, DXA) 원리를 사용하는 Lunar prodigy (GE medical systems Lunar, WI, USA)를 이용하여 측정하였다. 골밀도(bone mineral density, BMD)는 대퇴 전체 및 경부(femur total and neck), 요추 1번-4번(lumbar)의 골밀도를 측정하였으며, 체질량지수(body mass index, BMI)와 사지근육비율(appendicular skeletal muscle mass index, ASM index)은 각각 체중(kg)/신장(m2), 사지근육량(kg)/신장(m2) 공식을 이용하여 산출하였다. 혈압은 충분한 휴식을 취한 뒤 자동혈압계(FG-500R, Jawon medical, Seoul, Korea)를 이용하여 2회 측정 후 평균값을 사용하였다.
2) 악력 및 보행 측정
악력은 악력계(TKK-5401, Takei, Niigata, Japan)를 이용하여 바르게 선 자세에서 좌, 우 2회씩 측정한 값 중 최대값을 이용하였다. 보행은 보행분석기(Optogait, Microgait, Bolzano, Italy)를 이용하여 전체 10 m 구간 중 처음 2.5 m의 출발 가속구간과 마지막 2.5 m의 정지 감속구간을 제외한 가운데 5 m 구간에 대해서 측정을 실시하였다[18].
3) 혈액변인 분석 및 비타민 D 분류
채혈은 12시간 이상 공복을 유지한 후 대상자의 상완정맥에서 일회용 주사기를 이용하여 10 mL를 채혈하였으며, 혈액은 혈청 튜브에 넣고 원심분리기(MF-300, Hanil, Incheon, Korea)를 이용하여 10분간 3,000 RPM (revolution per minute)으로 원심분리 후 혈청을 분리하였다. 분리된 혈청은 AU680 (Beckman coulter, CA, USA)과 동일회사의 시약을 사용하고 효소비색법(enzymatic & colorimetric assay)을 통하여 중성지방(triglyceride, TG), 총 콜레스테롤(total cholesterol, TC), 고밀도 지단백 콜레스테롤(high density lipoprotein-cholesterol, HDL-C), 공복혈당(fasting blood glucose, FBG)을 분석하였다. 또한 CLIA 방법으로 Advia (Syemens, USA)를 사용하고 동일회사의 시약을 사용하여 혈청 25(OH)D를 분석하였다.
또한, 비타민 D 수준에 근거하여 성별 상위 33% (High 33%), 중위 33% (Middle 33%), 하위 33% (Low 33%)로 집단을 분류하였으며, 추가적으로 20 ng/mL 미만일 경우 비타민 D 결핍 집단으로 분류하였다[19].
4) 거동장애증후군 정의
거동장애증후군은 높은 체지방, 골다공증, 낮은 근육량, 느린 보행속도, 낮은 악력, 낙상에 근거하여 정의하였다. 각 하위요인별 해당 기준으로 높은 체지방(high fat)은 남성 ≥30%, 여성 ≥40%에 해당하는 경우, 골다공증(osteoporosis)은 대퇴 경부, 대퇴 전체, 요추 중 어느 하나의 부위에서 ≤T-score 2.5에 해당하는 경우, 낮은 근육량(low muscle mass)은 사지근육량에 근거하여 남성 ˂7.0 kg/m2, 여성 ˂5.4 kg/m2에 해당하는 경우[20], 느린 보행속도(slow gait speed)는 3 m 돌아오기 ≥12초 또는 보행속도 ˂1.0 m/s에 해당하는 경우, 낮은 악력(low grip strength)은 남성 ˂26 kg, 여성 ˂18 kg에 해당하는 경우, 낙상(fall)은 지난 1년간 경험 유무로 정의하였다. 이후 6가지 항목에 대해 어느 하나에도 해당되지 않을 경우 정상(robust), 1-2가지에 해당할 경우 전 단계 거동장애증후군(pre-dysmobility syndrome), 3가지 이상에 해당할 경우 거동장애증후군(dysmobility syndrome)으로 분류하였다[3].
5) 공변량
공변량으로 폐경(menopause)을 조사하였으며, 교육수준(education)은 초졸 이하, 중/고졸, 전문대졸 이상으로 구분하였다. 신체활동 부족(physical inactive)은 한국형 단문형 국제 신체활동 설문지(Korean version of international physical activity questionnaire)를 통해 측정된 주당 신체활동이 ˂ 600 MET인 경우로 구분하였으며[21,22], 흡연(smoking)은 현재 흡연 중이거나 과거 100개비 이상의 흡연을 한 경험이 있는 경우로 구분하였다[23]. 과도한 음주(heavy alcohol)는 용량에 무관하게 주당 2회 이상 음주하는 경우로 구분하였으며[24], 인지기능 저하(cognitive impaired)는 MMSE-DS (mini mental state examination-de-mentia screening)를 이용하여 ≤23점에 해당하는 경우로 구분하였다[25]. 심혈관질환 위험인자(CVD risk factors)는 고혈압, 고지혈증, 비만, 좌식생활, 가족력에 해당하는 수를 조사하였다.
3. 자료처리방법
본 연구의 모든 연속형 변인은 평균과 표준편차로 표기하였으며, 범주형 변인은 집단별 비율로 표기하였다. 일원변량분석(one-way ANO-VA)의 대비다항식(polynomial contrast)과 카이 제곱 분석(chi square)의 선형대결합(linear by linear)을 이용하여 거동장애증후군 및 비타민 D 수준에 따른 측정변인의 선 경향 유무를 검증하였다. 이후 이분형 로지스틱 회귀분석(binary logistic regression)을 통해 95% 신뢰구간(confidence interval, CI)에서 비타민 D 수준에 따른 거동장애증후군 노출에 대한 승산비(odds ratio, OR)를 산출하였다. 가설 검정을 위한 유의수준은 α=0.05로 설정하였으며, 모든 통계분석은 SPSS-PC (version 23.0)를 이용하여 분석하였다.
연구 결과
1. 거동장애증후군에 따른 측정변인 비교
Table 2는 거동장애증후군 수준에 따른 측정변인을 비교한 결과이다. 먼저, 정상에서 거동장애증후군으로 진행될수록 높은 체지방(p<.001), 골다공증(p<.001), 낮은 근육량(p<.001), 느린 보행속도(p<.001), 낮은 악력(p<.001), 낙상(p<.001) 비율이 유의하게 높아지는 선 경향이 있는 것으로 나타났다. 또한, 정상에서 거동장애증후군으로 진행될수록 여성(p =.002), 나이(p<.001), 신체활동 부족(p =.012), 인지기능 저하(p<.001), 심혈관질환 위험인자(p =.009)가 유의하게 높아지는 선 경향이 있는 것으로 나타났으며, 교육수준(p<.001), 비타민 D (p =.008)는 유의하게 낮아지는 선 경향이 있는 것으로 나타났다.
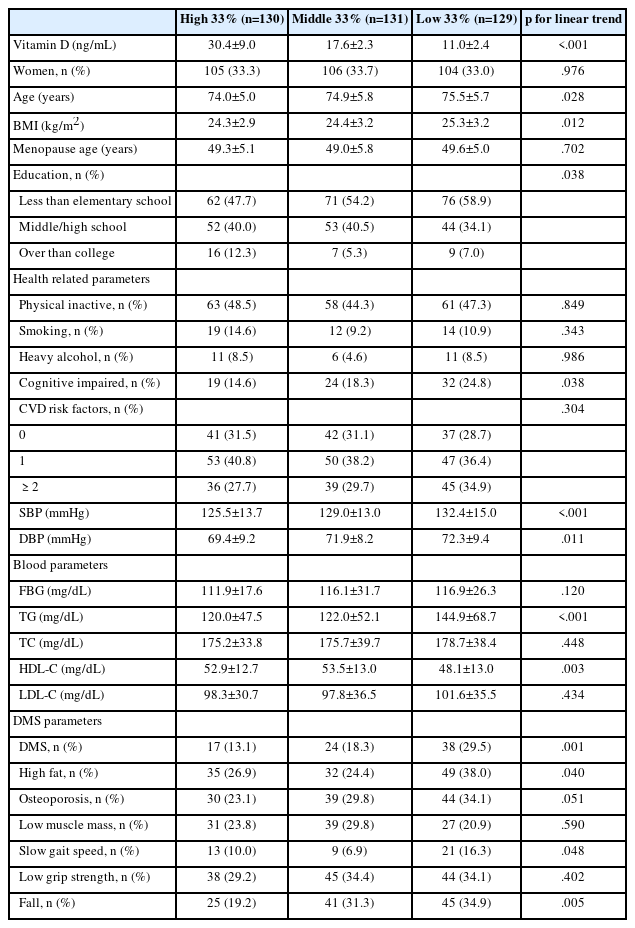
2. 비타민 D 수준에 따른 측정변인 비교
Table 3은 비타민 D 수준에 따른 측정변인을 비교한 결과이다. 비타민 D 수준이 낮아질수록 나이(p =.028), 체질량지수(p =.012), 인지기능 저하(p =.038), 수축기혈압(p <.001), 이완기혈압(p =.011), 중성지방(p <.001), 거동장애증후군(p =.001), 높은 체지방(p =.040), 느린 보행속도(p =.048), 낙상(p =.005)이 유의하게 높아지는 선 경향이 있는 것으로 나타났으며, 교육수준(p =.038), 고밀도 지단백 콜레스테롤(p =.003)은 유의하게 낮아지는 선 경향이 있는 것으로 나타났다.
3. 비타민 D 수준에 따른 거동장애증후군 노출 위험
Table 4는 비타민 D 수준에 따른 거동장애증후군 노출 위험을 산출한 결과이다. 비타민 D 상위 33% 집단(reference)에 비해 하위 33% 집단(OR=2.776, p =.002)의 거동장애증후군 노출 위험이 유의하게 높은 것으로 나타났으며, 나이와 성별을 보정한 모델 2 (OR=2.413, p =.009)와 추가적인 공변량을 보정한 모델 3 (OR=2.509, p =.010)에서도 하위 33% 집단의 거동장애증후군 노출 위험이 유의하게 높은 것으로 나타났다. 추가적으로, 비타민 결핍 여부에 따른 거동장애증후군 노출 위험을 산출한 결과, 비타민 D 결핍 집단(OR=2.486, p =.002)이 정상/부족 집단(reference)에 비해 거동장애증후군 노출 위험이 유의하게 높았으며, 공변량을 보정한 모델 2 (OR=2.191, p =.008)와 모델 3 (OR=2.201, p =.001)에서도 비타민 D 결핍 집단의 거동장애증후군 위험이 유의하게 높은 것으로 나타났다.
3. 비타민 D 수준에 따른 거동장애증후군 단계별 노출 위험
Table 5는 비타민 D 수준에 따른 거동장애증후군 단계별 노출 위험을 산출한 결과이다. 먼저 비타민 D 삼분위수에 근거하여, 정상에서 거동장애증후군으로 노출될 위험을 산출한 결과, 비타민 D 상위 33% (reference) 집단에 비해 하위 33% 집단(OR=3.207, p =.003)의 거동장애 증후군 노출 위험이 높은 것으로 나타났으며, 공변량을 보정한 모델 2 (OR=3.157, p =.011)와 모델 3 (OR=2.840, p =.035)에서도 하위 33% 집단의 노출 위험이 높은 것으로 나타났다. 추가적으로, 비타민 D 결핍 여부에 따른 분석 결과, 비타민 D 결핍 집단(OR=3.081, p =.001)이 정상/부족 집단(reference)에 비해 거동장애증후군 노출 위험이 높은 것으로 나타났으며, 공변량을 보정한 모델 2 (OR=2.909, p =.006)와 모델 3 (OR=2.519, p =.029)에서도 비타민 D 결핍 집단의 노출 위험이 높은 것으로 나타났다.
또한, 비타민 D 수준에 근거하여, 전 단계 거동장애증후군에서 거동장애증후군으로 노출될 위험을 산출한 결과, 상위 33% 집단(reference)에 비해 하위 33% 집단(OR=2.630, p =.004)의 거동장애증후군 노출 위험이 높은 것으로 나타났으며, 공변량을 보정한 모델 2 (OR=2.220, p =.024)와 모델 3 (OR=2.431, p =.017)에서도 하위 33% 집단의 노출 위험이 높은 것으로 나타났다. 추가적으로, 비타민 D 결핍 여부에 따른 분석 결과, 비타민 D 결핍 집단(OR=2.303, p =.005)이 정상/부족 집단(reference)에 비해 거동장애증후군 노출 위험이 높은 것으로 나타났으며, 공변량을 보정한 모델 2 (OR=1.979, p =.026)와 모델 3 (OR=2.076, p =.021)에서도 비타민 D 결핍 집단의 노출 위험이 높은 것으로 나타났다.
그러나, 비타민 D 삼분위수와 결핍여부에 따른 정상에서 전 단계 거동장애증후군 노출 위험은 집단 간 유의한 차이가 없는 것으로 나타났다.
논 의
본 연구는 지역사회 65세 이상 노인 390명(남성 75명, 여성 315명)을 대상으로 비타민 D 수준이 거동장애증후군에 대해 어떠한 역할을 하는지 검증하는 것을 주요 목적으로 진행하였다. 이에 전체 대상자 중 전 단계 거동장애증후군 58.9% (n=230), 거동장애증후군 20.3% (n=79)로 나타났으며, 비타민 D 수준이 낮을수록 거동장애증후군 노출 위험이 높아지는 것으로 나타났다. 또한, 비타민 D 수준에 따른 거동장애증후군 단계별 노출 위험을 조사한 결과, 정상에서 거동장애증후군, 전 단계 거동장애증후군에서 거동장애증후군의 관계에서 비타민 D 수준에 따른 차이가 나타났던 반면, 정상에서 전 단계 거동장애증후군의 관계에서는 비타민 D 수준에 따른 차이가 없는 것으로 나타났다.
인구 고령화로 인해 건강수명과 관련된 사회적 중요성이 부각되고 있는 가운데 노년기 적절한 신체구성 및 기능 유지를 통한 독립생활유지에 대한 관심이 증가하고 있다. 이에 신체구성의 비정상적 표현형 및 기능적 상태에 근거하여 정의되는 거동장애증후군은 노년기 근골격계 건강을 파악할 수 있는 중요한 임상적 증후군으로 보고되고 있으며[3,26], 노년기 거동장애증후군에 노출될 경우 근골격계 문제, 만성질환, 정신질환에 대한 높은 취약성을 가질 뿐만 아니라 이로 인한 사망 위험에도 부정적 역할을 하는 것으로 알려져 있다[5,6]. 이에 본 연구에서는 국내 노인의 거동장애증후군 유병률을 조사한 결과, 정상 20.8%, 전 단계 거동장애증후군 58.9%, 거동장애증후군 20.3%로 나타났다. 이는 국내·외 선행연구의 결과에 비해 다소 높은 수치이며, 이러한 본 연구의 결과는 연구 대상자의 평균 연령이 선행연구에 비해 높았다는 점과 여성 노인의 비율이 많았다는 점에서 기인한 결과인 것으로 해석된다[10].
한편, 오랜 연구를 통해 체내의 비타민 D 수준은 연령에 무관하게 건강증진과 밀접한 연관성이 있는 것으로 알려져 있으며, 특히 노년층의 경우, 영양불균형, 저작능력 저하, 야외활동 감소 등의 원인에 근거하여 타 연령층에 비해 비타민 D 결핍률이 높은 것으로 알려져 있다. 반면, 영양섭취 및 야외활동 등을 통한 노년기 높은 비타민 D 수준은 정신질환, 내분비질환, 심혈관질환을 예방할 뿐만 아니라 근골격계 질환에도 긍정적인 역할을 하는 것으로 보고되고 있다[14,27]. 그러나, 최근 독립적인 생활유지에 대한 관심과 더불어 거동장애증후군에 대한 관심이 증가하고 있음에도 불구하고, 대부분의 선행연구에서는 거동장애증후군의 전반적인 상태가 아닌 세부요인과 비타민 D의 연관성을 검증한 연구에만 국한되어 있는 실정이다[16,28]. 이에 본 연구에서는 지역사회 노인들의 비타민 D 수준에 따른 거동장애증후군 노출 위험을 산출한 결과, 비타민 D 상위 집단에 비해 하위 집단은 약 2.8배 높은 것으로 나타났으며, 비타민 D 20 ng/mL 이상 집단에 비해 20 ng/mL 이하 집단 또한 거동장애증후군 노출 위험이 약 2.5배 높은 것으로 나타났다. 이러한 본 연구의 결과는 아시아 중·고령자에서 성별에 무관하게 비타민 D 결핍 집단은 정상 집단에 비해 근감소성 비만 노출 위험이 높게 나타났다고 보고한 Jia et al. [19]의 연구와 유럽 노인에서 비타민 D 수준이 낮을수록 보행속도 및 악력을 포함한 신체적 기능 저하 위험이 높은 것으로 나타났다고 보고한 Mendes et al. [30]의 연구와 유사한 결과이다. 이러한 선행연구와 본 연구의 결과들을 미루어 볼 때, 신체구성의 부정적 변화 및 기능적 저하 등을 포함한 거동장애증후군의 세부요인은 비타민 D 수준과 개별적인 연관성이 있을 뿐만 아니라 노년기 비타민 D 수준의 적절한 유지는 정상적인 신체구성 및 기능 유지를 통해 일상생활수행능력 증진에 긍정적인 역할을 할 수 있다고 보고한 선행연구들과 유사한 맥락에서 해석된다[15,31].
또한, 비타민 D 수준에 따른 거동장애증후군 단계별 노출 위험을 산출한 결과, 비타민 D 수준이 낮을수록 정상에서 거동장애증후군, 전 단계 거동장애증후군에서 거동장애증후군으로 노출될 위험은 유의하게 높았던 반면, 정상에서 전 단계 거동장애증후군으로 노출될 위험은 차이가 없는 것으로 나타났다. 이러한 본 연구의 결과는 국내 중 ·고령자를 대상으로 비타민 D 수준과 신체구성 변화의 연관성을 조사한 결과, 비타민 D는 비만, 골다공증, 근감소증에 단일 노출보다는 심각한 상태를 의미하는 2개 이상의 복합적인 신체구성 변화와 연관성이 있었다고 보고한 Kim et al. [32]의 연구와 미국 여성 노인을 대상으로 비타민 D 수준과 단계별 허약 노출 연관성에 대해 조사한 결과, 비타민 D 수준은 정상에서 전 단계 허약으로 진행되는 과정보다는 전 단계 허약에서 허약으로 진행되는 과정에 대한 역할이 더 크게 나타났다고 보고한 Ensrud et al. [33]의 연구와 유사한 결과이다. 이러한 연구결과들을 미루어 볼 때, 중년 이후 비타민 D 수준은 신체구성 및 기능 변화에 있어 심각한 상태로의 변화에 대해 중요한 역할을 하는 것은 물론, 노년기 거동장애증후군 관리 및 근골격계 건강을 통해 독립생활을 유지하고자 하는 측면에서 비타민 D의 역할이 적지 않음을 시사한다[17,34].
그러나 본 연구는 다음과 같은 몇 가지 제한점을 가진다. 첫째, 본 연구에서는 거동장애증후군 유병률이 선행연구에 비해 높게 나타났기에 추후 연구에서는 연령별 세분화를 통해 비타민 D와 거동장애증후군의 관계를 보다 구체적으로 검증하는 연구가 필요할 것으로 생각된다. 둘째, 본 연구에서는 계절, 야외노출시간, 보조식품 복용 등에 대한 정보가 조사되지 않았기에 추후 연구에서는 비타민 D 수준에 영향을 미칠 수 있는 요인을 고려한 연구가 필요할 것으로 생각된다. 셋째, 본 연구는 횡단적 연구에 근거하였기에 추후 연구에서는 시계열 연구 또는 종단적 연구를 통해 비타민 D와 거동장애증후군의 인과관계를 파악할 수 있는 추가적인 연구가 필요할 것으로 판단된다. 넷째, 본 연구는 거동장애증후군에 근거한 결과만 제시되어 있기에 추후 운동기능저하 증후군 등을 포함한 다양한 신체기능 지표에 근거한 결과 도출을 통해 다양한 관점에서 노년기 기능적 요인과 비타민 D의 연관성을 검증하는 연구가 필요가 있을 것으로 판단된다.
결 론
본 연구의 결과를 종합하면, 노년기 비타민 D 수준이 낮을수록 거동장애증후군 노출 위험이 높은 것으로 나타났으며, 이러한 비타민 D 의 역할은 전 단계 거동장애증후군으로 진행되는 과정보다 거동장애증후군으로 진행되는 과정에서의 역할이 중요한 것으로 나타났다. 따라서, 규칙적인 야외활동 또는 식단관리를 통해 적절한 비타민 D 수준을 유지하는 것은 노년기 거동장애증후군을 예방 및 관리하는데 있어 긍정적인 요인이 될 수 있음을 시사한다.
Notes
이 논문 작성에 있어서 어떠한 조직으로부터 재정을 포함한 일체의 지원을 받지 않았으며, 논문에 영향을 미칠 수 있는 어떠한 관계도 없음을 밝힌다.
AUTHOR CONTRIBUTIONS
Conceptualization: I Lee; Data curation: I Lee; Formal analysis: JY Kong; Funding acquisition: I Lee; Methodology: JY Kong; Project administration: I Lee; Visualization: I Lee; Writing - original draft: JY Kong; Writing - re-view & editing: I Lee.