악력과 하지 단일 근섬유 아형별 수축특성의 상관성 분석
Hand Grip Strength and Its Relation to Thigh-derived Single Muscle Fiber Contractile Properties
Article information
Trans Abstract
PURPOSE
Grip strength has been well documented to represent whole body strength. This study was performed to investigate whether absolute and relative grip strength is associated with thigh strength, and thigh-derived single muscle fiber contractile properties.
METHODS
Twelve healthy young adults (mean age 27.42 years) received needle biopsy on vastus lateralis muscles. Chemically skinned muscle fibers (n=215) were used to analyze single muscle fiber contractile properties (cross sectional area, maximal force, specific force, maximal shortening velocity) and MHC isoform composition. Pearson correlation was tested to identify the relationship between dominant hand grip strength, thigh strength, and thigh-derived single muscle fiber contractile properties.
RESULTS
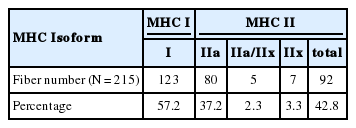
The distribution of MHC I was higher in all the subjects compared to MHC II (type I: 57.2%, IIa: 37.2%, IIa/IIx: 2.3%, IIx: 3.3%). Specific force (8.2%) and maximal shortening velocity (74%) in MHC II were greater than those of MHC I. Absolute and relative grip strength normalized by height had a positive correlation with knee extensor isometric (r=.777, r=.75) and isokinetic (r=.632, r=.603) strength. In addition, the positive correlation of knee extensor isometric and isokinetic strength was observed against both CSA and Po in the thigh-derived single muscle fiber. Finally, Absolute and relative grip strength normalized by height were positively correlated with CSA (r=.279, r=.267) and Po (r=.373, r=.351) in MHC II, but not in MHC I.
CONCLUSIONS
These data suggest that hand grip strength is highly associated with not only whole thigh muscle strength, but also thigh-derived fast single muscle fiber contractile properties (MHC II).
서 론
일상적인 활동을 수행함에 있어 원활한 신체 기능을 유지하는 것은 매우 중요하다. 전신의 근력은 신체 기능 수준을 결정짓는 필수적인 요인이 되며, 사망률, 장애, 수술 후 합병증과 같이 건강에 직결된 문제에 대한 예측 지표로서 인식되고 있다[1,2]. 따라서 전신의 근력을 과학적으로 평가하고 이를 개선시키거나 유지함으로써 다양한 질환으로 이환 될 가능성을 낮추는 것은 개인과 사회적 건강 문제를 해소하는 데 기여할 것으로 보인다.
전신의 근력을 측정하는 방법은 다양하나 대표적인 방법으로 등속성 장비를 이용한 등척성 및 등속성 근력 측정과 악력계를 활용하는 방법이 있다[3,4]. 특히, 악력은 등척성[5] 및 등속성 하지 근력[6]과의 유의미한 정적 상관성을 가진다는 연구결과들에 의해 악력 자체만으로도 전신 근력을 대신할 수 있다고 주장되어 왔다[7-9]. 또한 일부 선행연구들은 악력을 통해 전신의 근육, 신경, 뼈, 관절의 장애에 대한 신뢰할 수 있는 정보를 제공하여 재활분야에 적용될 수 있다고 제안하였으며[10-12], 최근 수행된 메타분석 연구[13]와 코호트 연구[14]들은 악력이 높을수록 질병 및 사망률이 감소된다고 제안한 바 있다. 그 뿐만 아니라 악력을 통한 전신 근력 측정 방법은 여타 측정 방법에 비해 측정 절차가 간단하고 측정 장비 구입이 용이하기 때문에 전신의 근력을 예측하는 유용한 지표로서 다양한 연구 영역에 적용되어 왔다[15-17].
일반적으로 악력을 측정함에 있어 측정 후 악력계에 제시되는 절대 악력 수치를 결괏값으로 사용해 왔다. 마찬가지로 악력과 전신 근력 및 기능과의 상관성을 보고한 대다수의 선행연구들도 절대악력 수치를 사용하여 왔다[9,18-20]. 절대악력은 체중, 신장, 체질량 지수와 같은 신체계측 지표들과 높은 상관관계를 보이며[21-23] 특히 최근에는 신체계측 지표에 표준화된 상대적인 악력이 절대악력에 비해 심혈관 건강 및 사망률을 예측하는 데 보다 유용한 지표로서 제시되고 있다[24,25].
한편 여러 선행연구들이 악력이 하지의 근력을 반영할 수 있다는 연구결과들을 제시해 왔으나, 골격근의 기능과 근력 생성 능력은 본질적으로 근섬유의 수축 특성에 의해 결정되며[26,27], 인간의 근섬유는 각 아형에 따라 서로 다른 대사적 기능[28]과 수축 특성[29]을 가지는 것으로 알려져 왔다. 지근 섬유인 type I 섬유는 수축 속도가 느리지만 산화성, 피로저항이 높은 특성이 있는 반면에 속근 섬유인 type IIa 섬유는 빠르지만 산화성, 중간 정도의 대사특성을 가지며 type IIx 섬유는 수축 속도가 아형 중에서 가장 빠르지만 해당성, 피로도가 상대적으로 높은 특성을 가지고 있다. 또한 두 가지 아형의 특성이 모두 나타나는 hybrid 섬유(type I/IIa, type IIa/IIx)는 운동, 노화와 함께 증가하며 일부 병적 상태에서 나타난 바 있다[30]. 이와 같이 근섬유 유형별로 서로 다른 특성을 보이기 때문에 하지를 구성하는 근섬유 유형에서 어떠한 유형이 악력과 보다 높은 상관성을 나타낼지에 대해서도 구분하여 분석해야 할 것으로 사료된다.
일부 연구들은 상지와 하지에서 보여지는 근 기능의 차이를 설명하고 있다[31]. 하지 대퇴사두근은 빠른 수축 속도를 가진 반면 악력측정에 동원되는 상지 근육은 하지 근육에 비해 MHC I 아형의 비율이 높은 것으로 알려져 있다[32]. 이러한 결과들은 악력이 하지 근력과의 상관성을 보이는 데 있어 단일 근섬유 수준에서도 동일한 양상을 나타낼지에 대한 의문점을 제기한다. 근섬유의 구성 비율과 기능이 전신근력에 직접적인 영향을 미친다는 점을 고려할 때, 근 기능에 부가적인 영향을 미치는 근 신경 및 결합조직 등의 요인들[33,34]을 제외한 단일 근섬유 자체의 수축 특성과 악력과의 상관성을 분석함으로써 악력 측정의 효용성을 입증할 필요가 있다.
종합하면, 전신의 근력을 예측할 수 있는 유용한 방법으로 악력 측정이 활용되고 있는 상황임에도 불구하고 악력과 단일 근섬유의 수축 특성 간의 관계를 보고한 연구는 현재 전무한 실정이다. 악력 측정에 의한 전신 근력 평가에 대한 보다 과학적인 정보를 제시하기 위해 절대 악력 및 상대적인 악력과 단일 근섬유 아형별 상관성을 조사할 필요성이 있다. 따라서 이 연구는 성인의 외측광근에서 단일 근섬유를 추출하여 첫째, 단일 근섬유 아형 분포 및 수축특성을 분석하였으며 둘째, 하지근력과 악력 및 단일 근섬유 아형별 수축력과의 상관성을 분석하고 셋째, 절대악력 및 신체계측지표(체중, 신장)에 표준화된 상대악력과 단일 근섬유 아형별 수축특성과의 상관성을 제시하고자 하였다. 단일 근섬유의 아형별 수축 특성을 분석하여 실험을 통해 얻어진 결과는 실제 악력을 활용하는 건강 및 운동재활 분야에 소중한 기초정보로서 제공될 것이다.
연구 방법
1. 연구 대상
이 연구의 대상자들은 성남시 분당서울대학병원의 공고를 통해 모집되었으며, 젊은 성인 12명(남성 6명, 여성 6명)이 연구에 참여하였다. 연구 참여 대상자는 근골격계 질환 및 특별한 대사적 질환이 없으며, 3개월 이내에 규칙적인 운동을 수행하지 않은 성인으로 한정하였다. 연구 수행 개시 전, 대상자들에게 연구의 목적과 절차를 구두로 설명하고 연구진행 내용이 상세히 기술된 동의서에 이 연구에 자발적 참여를 희망한다는 서명을 받았다. 최종 연구에 참여한 대상자의 특성은 Table 1에 기술하였다. 이 연구는 분당서울대학병원 Institutional Review Board (IRB)의 승인을 받아 수행되었다(B-1610/365-001).
2. 실험 절차
1) 신체계측 및 신체조성
연구 참여 대상자들의 신장, 체중, 엉덩이 둘레 및 허리 둘레의 신체 계측을 통해 체질량지수(body mass index, BMI)와 엉덩이-허리 둘레 비율(wrist/hip ratio, WHR)을 구하였다. 골격근량과 체지방량 및 체지방률은 생체 전기 저항 측정법(bioelectric impedance analysis, Inbody S10, Inbody Co., Korea)을 이용하여 측정하였다.
2) 하지 근력
하지 대퇴사두근의 근 수축 기능을 평가하기 위하여 등속성 근력 측정 장비(BTE Primus RS, BTE tech, MD, USA)를 사용하여 주측 하지의 무릎 신전 시 등척성 근력(isometric strength), 등속성 최대근력(isokinetic strength, 60°/sec)을 측정하였다.
3) 상지 악력
상지의 악력은 디지털 악력계(Takei Scientific Instruments Co. Ltd., Japan)를 이용하였으며 각 대상자의 검지손가락 두 번째 마디가 90°가 되는 넓이로 조절하여 측정되었다. 측정자세는 양발을 10 cm 정도 벌리고 선 자세에서 어깨를 내리고 측정하는 팔의 팔꿈치를 아래로 180°로 편 후에 손바닥이 허벅지쪽으로 향하게 하여 악력계를 잡게 하였으며 손이 허벅지에 닿지 않도록 하였다. 측정 시, 구두로 독려하였으며, 주측 손의 악력을 2회 측정하여 가장 높게 나온 수치를 기록하였다.
4) 근육 조직 채취(muscle biopsy)
모든 근 조직 채취 과정은 서울대학병원에서 이루어졌으며 한 명의 전문의가 직접 근 생검(muscle biopsy)을 수행하였다. 근 생검 실시 전, 근육 표본의 안전한 채취를 위하여 초음파 장비(Ultrasound V20 Prestige, Samsung Medison Co. Ltd., Seoul, Korea)를 사용하여 대상자의 외측광근의 위치와 깊이를 확인하였다. 근육 조직 채취과정에서 느낄 수 있는 통증 등의 불편함을 덜기 위해 피하 및 근육 부위(외측광근)를 국소 마취(2% lidocaine hydrochloride)하였으며, 근 생검 바늘(biopsy needle) 두께보다 약간 큰 정도(5-7 mm)로 피부를 절개한 후, 근 생검 바늘을 삽입하여 흡입 방법을 통하여 근육 조직을 채취하였다.
5) 근육 조직 처리
근 생검 직후, 근육표본은 즉시 이완 용액(2.5 M KCl, 0.1 M EGTA, 0.1 M CaCl2, 0.5 M Imidazole, 0.1 M MgCl2)으로 옮겨져(4°C), 약 50-100여 개의 단일 근섬유(single muscle fiber)를 포함하는 크기로 분리되었다. 분리된 근섬유 다발은 분리용액(50% glycerol, 50% 이완용액)에 넣고 4°C에서 24시간 배양하였다. 배양 후, 근초(sarcolemma)가 제거된 근다발(skinned single fiber)은 3주 이내에 분석될 때까지 -20°C에서 보관되었다.
6) 단일 근섬유 기능 측정
근초가 제거된 근다발을 이완 용액(pCa 9.0)이 들어있는 특수 실험 장치의 챔버에 옮겨서, 단일 근섬유를 손상되지 않게 분리하였다. 단일 근섬유는 의료용 10-0 봉합사로 티타늄 와이어에 견고하게 고정되었다. 근섬유는 평균 길이 1.37±0.02 mm로, 한쪽은 등척성 근력 변환기(Model 403A, Aurora Scientific, Aurora, Ontario, Canada)에 연결하고, 다른 한쪽은 고속 모터(Model 315C, Aurora Scientific, Ontario, Canada)에 고정되었다. 고정된 근섬유 절편은 이완 용액을 함유하는 챔버에서 활성용액을 담고 있는 챔버로 고속 이동시킬 수 있도록, 특수하게 고안된 실험 장치에 연결되었다. 특수 실험 장치는 현미경 위에 설치되어, 근섬유 절편을 80-400 배율(Olympus IX71)로 실험과정 동안 관찰하였고, 근섬유 이미지는 CDC 카메라와 graphic acquisition board를 이용하여 획득하였다(Fig. 1). 모든 실험과정 동안 근절길이(sarcomere length, SL)는 2.6 μm로 유지되었다. 근절길이는 단일 근섬유를 따라 각기 다른 4곳의 근절길이를 측정하여 확인하였다. 근섬유 길이(fiber length, FL)는 현미경에 설치된 μm를 이용하여 측정했다. 근섬유 횡단 면적은 근섬유 길이를 따라 타원형으로 4쌍의 폭과 깊이를 측정하여 계산하였다. 근섬유 폭은 광학면에서 측정했고, 근섬유 깊이는 근섬유로 향해있는 프리즘으로부터 반사된 이미지를 이용하여 측정하였다. 근섬유 폭과 깊이는 접안(eyepiece) μm로 측정했다. 모든 측정은 15°C에서 실시하였다. Ca2+-활성화 최대 수축력(Po)과 최대 수축속도(Vo)는 선행연구에서와 같이 slack 검사 절차를 통해서 측정하였다[35,36].
요약하면, 근섬유는 활성용액(pCa 4.5)으로 옮겨진 후, 최대 수축력(maximal force)에 도달하게 되면, 근섬유 한쪽에 빠른(1-2 ms 이내) 단축성 길이 변화(근섬유 길이의 약 7-15% 범위)를 유발하였다. 단축성 길이 변화가 가해진 후, 장력이 재발생되기까지의 시간을 측정하였고, 이러한 과정을 각각 다른 단축성 길이 변화로 최소 5회 이상 실시하였다. 이렇게 얻은 결과들은 최소자승회귀법(least-squares regression)을 이용해 ‘시간 vs. 단축성 길이’로 전개했을 때 회귀직선의 기울기는 Vo로 기록되었다. 단 회귀식의 설명력(r2)이 .95 이상일 때에만 유효한 실험수치로 기록되었다. 실험이 실시되는 동안, 외부요인에 의한 기준선 변화(baseline drift)로 인한 수축력 측정의 오류를 제거하기 위해, 최대 근섬유의 수축력은 활성 용액 내에서의 최대 수축력과 이어지는 기저수축력(baseline force) 사이의 차이로 계산되었다.
7) MHC 아형
단일 근섬유의 기능 측정이 완료된 근섬유 절편을 티타늄 와이어에서 제거하여 2-3 mm 정도의 길이로 자른 후, 15 μL의 SDS sample buffer가 들어있는 microtube에 넣어서 MHC 분석 시까지 -20°C에 보관하였다. 근섬유의 MHC조성은 SDS-PAGE (Bio-Rad Mini-PROTEAN Tetra Cell electrophoresis system)를 이용하여 8% separating gel (40% acrylamide, 1.5 M tris pH 8.8, 10% SDS, 60% glycerol, TEMED, 10% APS)과 4% stacking gel (40% acrylamide, 0.5 M tris pH 6.8, 10% SDS, 60% glycerol, TEMED, 10% APS)을 만들어 30 mA에서 5시간 30분 동안 전기영동하였다. 또한 전기영동 시, 기존의 시료에서 얻은 Human MHC의 세 가지 아형에 대한 standard를 같이 전개하여 시료의 아형을 확인하였다.
전기영동이 끝난 gel을 fixing solution (Acetic acid)에 담가 두었다가 distilled water로 2-3번 세척한 후 gel을 glutaldehyde solution (10%)에 45분 동안 담가 흔들리도록 했다. Distilled water로 15분씩 4번 세척한 후 silver staining solution (0.09 M NaOH, 28% NH4OH, 1.14 M AgNO3)에 10분간 흔들면서 염색해준다. 그 후 distilled water로 1분 30초씩 3번 세척하였다. Gel을 developing solution (47.6 mM citric acid, 37% formaldehyde)에 담가 놓은 후 흔들면서 gel의 표면상에서 MHC 아형을 구분 지을 수 있는 밴드가 확인되면 storage solution (5% acetic acid)을 넣은 후에 보관하였다(Fig. 2).
3. 자료처리방법
실험을 통해서 얻어진 모든 결과는 평균과 표준오차(mean ±SE)를 산출하였으며 통계적 자료 처리를 위해 SPSS 18.0 통계 프로그램을 사용하였다. 단일 근섬유 아형 간 차이는 일원변량 분석법(One-way ANOVA)을 실시하였고 사후검증은 Least significant difference (LSD)를 적용하였다. 전신 근력과 근섬유 아형별 수축력에 대한 상관성을 검증하기 위하여 근섬유 215개 각각의 수축력 결과를 대상자별 악력 및 하지근력과 대응하여 피어슨 상관분석(Pearson’s correlation)을 실시하였다. 통계적 유의수준은 p<.05로 설정하였다.
연구결과
1. MHC 아형 분포
Silver stain을 통해 단일 근섬유의 아형을 분석한 결과(Table 2), MHC I 아형인 type I 섬유가 123개(57.2%)로 가장 높은 분포를 나타냈으며 MHC II 아형은 type IIa 섬유 80개(37.2%), IIa/IIx 섬유 5개(2.3%), IIx 섬유 7개(3.3%), 총 92개(42.8%)로 나타냄으로써 MHC I 아형이 MHC II 아형의 분포비율보다 높은 것으로 나타났다.
2. 단일 근섬유 아형별 수축특성
단일 근섬유의 수축 특성은 Table 3과 같다. 외측광근의 단일 근섬유 횡단면적(CSA)은 type IIa 섬유(6,333.42±708.1 μm2)가 모든 아형 중 가장 크게 나타났으며, type I (6,118.04±551.65 μm2), IIa/IIx (5,557.7±2,485.48 μm2), IIx (4,159.43±1,572.12 μm2) 섬유 순으로 나타났으나 통계적인 차이는 없었다(p>.05). 지근 섬유인 MHC I 아형과 속근 섬유인 MHC II 아형의 횡단면적을 비교한 결과, MHC II 아형(6,125.84 ± 638.66 μm2)이 MHC I 아형(6,118.04 ±551.65 μm2)보다 크게 나타났지만 통계적인 차이는 없었다(p>.05).
단일 근섬유의 최대 등척성 수축력(Po)은 type IIa (0.75±0.08 mN) 섬유가 모든 아형 중 가장 높게 나타났으며, type I (0.67±0.06 mN), IIa/IIx (0.672±0.3 mN), IIx (0.62±0.23 mN) 섬유 순으로 나타났으나 통계적인 차이는 없었다(p>.05). 지근 섬유인 MHC I 아형과 속근 섬유인 MHC II 아형의 Po를 비교한 결과, MHC II 아형(0.73±0.08 mN)이 MHC I 아형(0.67±0.06 mN)보다 높게 나타났지만 통계적인 차이는 없었다(p>.05).
단일 근섬유의 횡단면적에 표준화된 수축력(SF)은 type IIa (120.99±13.53 kN/m2)와 type IIx (145.01±54.81 kN/m2) 섬유가 type I (112.7±10.16 kN/m2) 섬유에 비해 각각 6.9%, 5.6% 높았으며(p =.014, p =.001), type IIx 섬유는 type IIa 섬유보다 16.6% 높은 것으로 나타났다(p =.01). 지근 섬유인 MHC I 아형과 속근 섬유인 MHC II 아형의 SF를 비교한 결과, MHC II 아형(122.74 ±12.8 kN/m2)이 MHC I 아형(112.7±10.16 kN/m2)보다 8.2% 높게 나타났다(p =.002).
단일 근섬유의 최대 수축 속도(Vo)는 type I (0.7±0.06 FL/s) 섬유보다 type IIa (2.34±0.26 FL/s) 섬유는 70.1%, type IIa/IIx (2.74±1.23 FL/s)는 74.5%, type IIx (6.74 ±2.55 FL/s) 섬유는 89.6% 빠르게 나타났다(p =.001, p =.001, p =.001). 특히 type IIx 섬유는 type IIa와 type IIa/IIx 섬유보다도 각각 14.6%, 59.3% 빠르게 나타났다(p =.001, p =.001). 지근 섬유인 MHC I 아형과 속근 섬유인 MHC II 아형의 Vo를 비교한 결과, MHC II 아형(2.69±0.28 FL/s)이 MHC I 아형(0.7±0.06 FL/s)보다 74% 빠르게 나타났다(p =.001).
3. 하지 근력과 악력과의 상관관계
하지 근력과 악력과의 상관관계를 분석한 결과, Table 4와 같이 등척성 하지 신전 근력은 절대악력(AGS, r=.777, p =.003)과 신장에 표준화된 악력(GSNH, r=.750, p =.005)과 정적 상관관계를 보여주었다. 또한 등속성 하지 신전 근력도 악력(r=.632, p =.027)과 신장에 표준화된 악력(r=.603, p =.038)과 정적 상관관계를 보여 주었으나, 체중에 표준화된 악력(GSNW)은 등척성 및 등속성 하지 신전 근력과 상관성을 보이지 않았다(p>.05).
4. 하지 근력과 단일 근섬유 아형별 수축력과의 상관관계
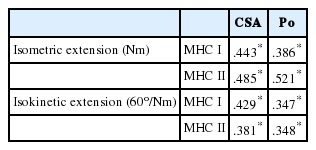
하지 근력과 단일 근섬유 아형별 수축특성과의 상관관계를 분석한 결과, Table 5와 같이 등척성 하지 신전 근력은 MHC I 아형 섬유의 횡단면적(CSA, r =.443, p =.001)과 최대 등척성 수축력(Po, r =.386, p =.001)과 정적 상관관계를 보여 주었으며, MHC II 아형 섬유에서도 CSA (r=.485, p =.001)와 Po (r=.521, p =.001)와의 정적 상관관계를 보여주었다. 또한 등속성 하지 신전 근력도 MHC I 아형 섬유의 CSA (r=.429, p =.001)와 Po (r =.347, p =.001)와 정적 상관관계를 보여 주었으며, MHC II 아형 섬유에서도 CSA (r=.381, p =.001)와 Po (r=.348, p =.001)와의 정적 상관관계를 보여주었다.
5. 악력과 단일 근섬유 아형별 수축력과의 상관관계
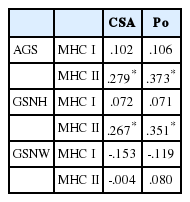
악력과 단일 근섬유 아형별 수축특성과의 상관관계를 분석한 결과, Table 6과 같이 절대악력(AGS)은 MHC I 아형 섬유의 CSA 및 Po와 상관성이 없는 것으로 나타났으나(p >.05), MHC II 아형 섬유의 CSA (r=.279, p =.007)와 Po (r=.373, p =.001)와 정적 상관관계가 있는 것으로 나타났다. 또한 신장에 표준화된 악력(GSNH)도 MHC I 아형 섬유의 CSA 및 Po와 상관성이 없는 것으로 나타났으나(p>.05), MHC II 아형 섬유의 CSA (r=.267, p =.010)와 Po (r=.351, p =.001)와 정적 상관관계가 있는 것으로 나타났다. 반면 체중에 표준화된 악력(GSNW)은 MHC I 및 MHC II 아형 섬유의 수축력과 상관성을 보이지 않았다(p>.05).
논 의
이 연구는 성인의 외측광근에서 단일 근섬유를 추출하여 단일 근섬유의 아형별 수축 특성을 분석하여 절대악력 및 신체계측지표(체중, 신장)에 표준화된 상대악력과 단일 근섬유 아형별 수축특성 및 하지 근력과의 상관성을 제시하고자 하였다.
성인의 외측광근에서 단일 근섬유를 추출하여 silver staining을 통해 분석한 MHC 아형 분포비율은 MHC I 섬유가 57.2%, MHC II 섬유가 42.8%로 지근 섬유 아형이 속근 섬유 아형보다 많은 것으로 나타났다. 단일 근섬유 수축 특성 중 횡단면적(CSA)과 최대 등척성 수축력(Po)은 근섬유 아형별 차이가 없었으나, 횡단면적에 표준화된 수축력(SF)과 최대수축속도(Vo)는 속근 섬유가 지근 섬유보다 높은 것으로 나타났다. 하지 근력과 악력의 상관분석을 실시한 결과, 절대악력과 신장에 표준화된 악력은 모두 하지의 등척성 및 등속성 신전 근력과 상관성이 있는 것으로 나타났으며, 하지의 근력은 MHC I 아형 및MHC II 아형의 CSA, Po와 상관성이 있는 것으로 나타났다. 또한 악력은 지근 섬유인 MHC I 아형의 수축 특성과 상관이 없었으나 속근 섬유인 MHC II 아형의 CSA 및 Po는 절대악력(r=.279, r=.373)뿐만 아니라 신장에 표준화된 상대적인 악력(r=.267, r=.351)과 정적인 상관성이 있는 것으로 나타났다. 따라서 악력은 하지근력 및 단일 근섬유 MHC II 아형의 최대 등척성 수축력과 정적인 상관성을 보이며 속근 섬유의 CSA와 Po는 하지 근력, 악력과 같은 전근의 근력을 대표할 수 있는 요인이 될 것으로 사료된다.
1. MHC 아형분포
사람의 근섬유 유형은 완전한 근섬유 형태(pure fiber)인 지근(type I), 산화성 속근(type IIa), 해당성 속근(type IIx) 섬유로 구분되며, 이외에 복합된 중간 형태(hybrid fiber)인 type I/IIa, IIa/IIx 섬유가 존재하는 것으로 밝혀져 왔다[37,38]. 본 연구에서 성인의 type I 섬유는 57.2%로 가장 높은 분포를 나타냈으며, type IIa 섬유는 37.2%로 두 번째로 높은 분포를 나타냈지만 type IIa/IIx 섬유는 2.3%, type IIx 섬유는 3.3%로 낮은 분포를 보여 지근 섬유 아형인 MHC I (57.2%)섬유가 속근 섬유 아형인 MHC II (42.8%)섬유의 분포 비율보다 높았다. 이 연구와 비슷한 연령대(27.42 ±1.52세)인 성인 남녀(25±1세)를 대상으로 수행한 연구[39]의 결과에서도 MHC I 섬유가 53.6%, MHC II 섬유가 46.4%로 나타나 이 연구의 결과를 뒷받침해주고 있다. 그러나 ATPase를 통한 조직화학분석법으로 MHC 아형분포를 나타낸 선행연구[40,41]와는 상이한 결과를 보여주어 분석방법에 따라 서로 다른 결과가 도출될 가능성도 배제할 수 없다.
MHC I 섬유 아형은 느린 수축 속도, 높은 피로저항의 특성을 가지는 반면에 MHC II 섬유 아형은 빠른 수축 속도, 낮은 피로저항을 가지는 것이 특징이다[30]. Hybrid 섬유의 경우 단일 근섬유 수축 특성을 분석한 연구에서 그 특성이 명확히 제시되지 않았으며, 제시된 결과들도 일치하고 있지 않은 상황이다.
2. 근섬유 아형별 수축특성
이 연구에서는 hybrid 섬유(type IIa/IIx)를 포함하여 단일 근섬유 수준에서의 수축 요인을 근 섬유 아형별로 비교 분석하였다. 분석 결과, type IIa 섬유의 CSA가 모든 아형 중에서 가장 크게 나타났으며, MHC II 섬유 아형이 MHC I 섬유 아형보다 크게 나타났지만 통계적인 차이는 없었다(p >.05). 젊은 성인 남성의 CSA를 분석한 연구[42]에서도 MHC II 섬유 아형의 CSA가 MHC I 섬유 아형보다 크게 나타남으로써 이 연구의 결과와 유사한 양상을 보였다. 반면 일부 연구들은 MHC I 아형의 CSA가 MHC II 아형보다 크게 나타났지만 이 연구들은 노인을 대상으로 분석한 경우가 대부분이다[33,43,44].
단일 근섬유 최대 등척성 수축력(Po)도 CSA와 유사한 양상으로 type IIa > I > IIa/IIx > IIx 섬유 순으로 나타난 경향을 보였으나 단일 근섬유 아형에 따른 유의미한 차이는 없는 것으로 나타났다(p >.05). 비록 이 연구에서 CSA와 Po가 근 섬유 아형별 차이를 보이진 않았지만 CSA가 클수록 Po가 높은 경향을 보여주었다. 근섬유 수준에서 수축력은 근원섬유의 구조 및 기능과도 밀접한 관련이 있으며 단일 근섬유의 CSA가 작을수록 근세사 단백질(myofilament protein)의 양, 근원섬유 영역(myofibrillar fractional area)이 감소됨으로써 Po가 감소된다고 보고된 바 있다[27].
반면, 단일 근섬유의 횡단면적에 표준화된 수축력(SF)은 type IIa와 type IIx 섬유가 type I 섬유에 비해 각각 6.9%, 5.6% 높았으며(p =.014, p =.001), type IIx 섬유는 type IIa 섬유보다 16.6% 높은 것으로 나타났다(p =.01). MHC I 아형과 MHC II 아형의 SF를 비교한 결과에서도 MHC II 아형이 MHC I 아형보다 8.2% 높은 결과를 보여주었다(p =.002). 이러한 결과는 젊은 성인 남녀의 근섬유 아형별 CSA는 차이가 없지만 속근 섬유의 SF가 지근 섬유에 비해 높다고 제시한 연구 결과와 일치한다[27]. 이 연구에서 SF의 결과와 유사한 경향으로 단일 근섬유의 최대 수축 속도(Vo)는 I < IIa < IIa/IIx < IIx 순으로 빠르게 나타났으며 MHC II 아형이 MHC I 아형보다 74% 빠르게 나타났다(p =.001). 이는 MHC 아형에 따라 수축력 및 수축속도가 상이하게 나타남을 의미하며, 빠른 섬유 아형(I < I/IIa < IIa < IIa/IIx < IIx)일수록 수축력이 높은 것으로 사료된다[45-47].
3. 하지 근력과 악력과의 상관관계
각각의 근섬유 아형은 서로 다른 특성을 보유하고 있기 때문에 근섬유 아형의 분포 비율은 전근의 운동수행능력 특성과 기능에 직접적인 영향을 미칠 가능성이 제시된 바 있다[48]. 따라서 서로 다른 특성을 가진 근섬유 아형이 전근에 미치는 영향을 비교 분석하는 것은 근육의 기능을 이해하고 수행능력에 대한 기전을 밝힘에 있어 매우 중요한 과제로 여겨지고 있다[49]. 특히 악력은 전신의 근력을 대표하는 지표로 알려져 왔다[6-9]. 본 연구에서도 남녀 12명을 대상으로 악력과 하지 근력의 상관성을 분석한 결과, 절대악력과 신장으로 표준화된 악력 모두 등척성(r=.777, r=.750) 및 등속성(r=.632, r=.603) 하지 신전 근력에 영향을 미치는 것으로 나타났다. 따라서 악력이 등척성 및 등속성 하지 신전 근력과 정적 상관성을 보이며 전신의 근력을 대표할 수 있는 측정방법으로 여겨진다. 그러나 현재까지 단일 근섬유 수준에서의 수축력과 악력과의 상관관계를 분석한 연구는 국내뿐 아니라 국외에서도 전무하다.
4. 하지 근력과 단일 근섬유 아형별 수축력과의 상관관계
악력과 단일 근섬유의 상관관계를 분석하기에 앞서 하지 근력과 단일 근섬유와의 상관성을 검증해본 결과, 등척성 하지 신전 근력은 MHC I 아형 및 MHC II 아형 섬유의 CSA (r=.443, r=.485), Po (r=.386, r=.521)와 정적 상관성이 있는 것으로 나타났으며 등속성 하지 신전 근력도 MHC I 아형 및 MHC II 아형 CSA (r=.429, r=.381), Po (r=.347, r=.348)와 정적 상관성을 보임으로써 단일 근섬유의 수축 특성이 전신 근력을 대표할 수 있는 악력과도 높은 상관을 보일 것으로 판단되었다.
5. 악력과 단일 근섬유 아형별 수축력과의 상관관계
현재까지 대부분 선행연구에서 상대적인 악력은 체질량지수[23,24] 또는 체중[50,51]으로 나눈 값으로 정의되어 왔고 신장에 표준화된 값은 사용되지 않았다. 그러나 신장에 표준화된 골격근 질량(muscle mass)은 체격을 고려하기 때문에 체중이나 체질량지수에 표준화된 수치보다 근육량과 더 밀접하게 관련되어 있다고 보고된 바 있어[50,51]이 연구에서는 신장에 표준화된 악력 수치도 함께 제시하였다. 이 연구에서 MHC I 아형에서는 악력에 영향을 미치는 단일 근섬유 수축 변인이 없었다. 반면 MHC II 아형의 경우, 절대악력(r2 =.139)과 신장(r2 =.123)에 표준화된 악력이 MHC II 섬유의 CSA, Po와 정적인 상관성을 보였다(p <.05). 그러나 체중에 표준화된 악력은 단일 근섬유의 수축 특성과 상관성을 보이지 않았다. 이러한 결과는 신장은 제지방량(fat-free mass)을 반영하는 반면 체중은 제지방량보다는 체지방량(fat mass)과 관련이 있기 때문에[52] 이 연구에서 체중에 표준화된 악력과는 어떠한 상관관계도 보이지 않은 것으로 판단된다.
이 연구에서 절대, 상대악력 모두 하지 근력과 유의미한 정적 상관관계가 있었다. 이는 악력측정이 전신 근력을 예측함에 있어 간단하고 효과적인 측정방법이 될 수 있음을 암시한다. 가장 흥미로운 부분은 절대, 상대악력(신장)은 하지 MHC II 단일 근섬유의 수축력과 높은 상관성을 보인 반면 MHC I 섬유의 수축 특성과 상관이 없는 것으로 나타났다. 이는 악력은 전신근력을 잘 반영하지만, 근세포수준에서 MHC I, II 모두를 반영하지 못함을 제시한다. 따라서 추후 MHC I 섬유의 수축 특성을 반영할 수 있는 측정도구가 개발된다면 운동 처방 분야에서 유용하게 활용될 것으로 생각된다. 또한 이 연구는 인간을 대상으로 근생검을 실시하여 조직을 분석한 연구로서 침습적인 실험의 특성상 면밀한 분석을 하기에 충분한 대상자 수를 확보하기에 어려움이 있었다. 추후 연구에서는 더 많은 대상자를 확보하여 단일 근섬유 수축특성과 전신근력과의 상호작용에 대한 통합적 분석이 필요할 것으로 사료된다.
결 론
이 연구는 성인의 외측광근에서 단일 근섬유를 추출하여 단일 근섬유의 아형별 수축 특성을 비교하고 단일 근섬유 아형별 수축 특성과 하지 근력 및 악력과의 상관성을 분석하고자 하였다. 특히 절대악력 및 신체계측지표(체중, 신장)에 표준화된 상대악력과의 상관성을 제시하고자 하였다. 이 연구 결과에 따르면 악력은 하지의 최대 등척성 및 등속성 수축력과 높은 상관을 보임으로써 전신의 근력을 대표할 수 있을 것으로 판단되며 특히 속근 섬유인 MHC II 아형의 단일 근섬유 수축특성(CSA, Po)을 반영할 수 있는 측정방법으로 사료된다. 악력은 측정 방법이 간단하기 때문에 주로 노인을 대상으로 체력 및 질병을 예측할 수 있는 도구로 사용되어 오지만 노화될수록 MHC II 섬유의 선택적인 감소가 일어나기 때문에 추후 연구에서는 MHC I 섬유를 잘 반영할 수 있는 측정 도구 개발이 필요할 것으로 사료된다.