12주간의 복합운동이 여대생의 근육-뼈 Crosstalk 인자에 미치는 영향
The Effect of 12-Week Combined Exercise on Muscle-bone Crosstalk Factor in Female College Students
Article information
Trans Abstract
PURPOSE
The purpose of this study was to establish the effect of combined exercise on muscle-bone crosstalk factors, which co-regulatory muscle and bone metabolic interaction.
METHODS
The subjects were 24 female college students and divided into two groups; non-exercise group (Con, n=12) and combined exercise group (Ex, n=12) by random sampling. This study evaluated changes in bone mineral density (BMD), muscle mass, muscle strength, physical fitness index, and muscle-bone crosstalk factors by a randomized controlled trial.
RESULTS
There was no interaction effect between group and time on total body BMD and muscle mass. Combined exercise led to a significant increase of pelvis BMD (p<.01), total exercise time at VO2max (p<.01), back muscle strength (p<.05), standing long jump (p<.05), standing vertical jump (p<.05), trunk flexion (p<.05), isokinetic right knee extension strength (p<.05), and serum osteonectin (p<.05).
CONCLUSIONS
These results suggest that although 12 weeks combined exercise did not improve muscle mass, it increases several basal physical fitness with the increase of serum osteonectin concentration. It’s probably indicate that osteonectin is highly sensitive to exercise among muscle-bone crosstalk factors.
서 론
골다공증과 근감소증은 노화와 관련된 근골격계 질환으로 서로 높은 관련성이 있다[1]. 우리나라 노인의 수명이 증가한다는 점을 고려할 때, 두 질병의 치료에 드는 경제적 비용 증가와 더불어 노인의 삶의 질 향상을 위해서도 보다 효율적인 대처법이 필요한 시점이다. 운동에 대한 효과로서 근육과 골대사 조절 인자들의 독립적 작용 기전에 대해서는 잘 알려져 있지만, 근육과 뼈에 대해서 상호작용하는 인자들에 대한 연구는 부족하다. 예로부터 성장호르몬(Growth Hormone, GH)과 인슐린유사성장인자(Insulin-like growth factor 1, IGF-1), 활성형 비타민D (vitamin D)는 근육과 뼈의 발달과 유지에 동시에 작용하며 중요한 역할을 하고 있는 것이 밝혀지고 있다. GH 결핍은 근육량과 골량의 감소와 함께 지방량을 증가시키는 것으로 알려져 있으며[2], IGF-1도 근육량과 골량의 증가를 촉진시키는 것이 밝혀져 있다[3]. 또한 인간의 골격근에는 비타민D수용체(vitamin D receptor, VDR)가 존재하고 비타민D는 골밀도와 근력에 영향을 미치는 것도 밝혀져 있다[4]. Bonjour et al. [5]도 성인의 근육과 뼈의 건강을 위한 영양소의 상호작용에 대한 연구에서 칼슘과 인, 단백질과 함께 비타민D 섭취의 중요성을 강조하였다. 또한, Tanaka et al. [4]은 비타민D 결핍과 최종당화산물(Advanced Glycation End-Products, AGEs)은 골다공증과 근감소증의 병인임을 밝히면서 활성형 비타민D가 근육과 뼈에 유용한 효과가 있음을 보고하였다.
한편, 최근 연구에 의하면 그중 근육에서 생산되어 뼈의 분화와 성장에 작용하는 오스테오넥틴(osteonectin), 오스테오글리신(osteoglycin)과 뼈에서 생산되어 근육 성장에 영향을 미치는 스클레로스틴(sclerostin)과 오스테오칼신(osteocalcin)에 대한 다각적인 연구가 진행되고 있다. 즉 근육과 뼈의 상호 관련성(근육-뼈 crosstalk) 인자의 작용에 대한 연구가 활발하게 진행되고 있다. Hamrick [6]의 연구에 의하면 근육은 내분비(endocrine)와 주변분비(paracrine) 장기(organ)로, 근육에서 분비되는 일부 성장인자와 사이토카인(cytokine)들과 함께 osteonectin은 골대사에 큰 영향을 미치는 것이 밝혀지고 있으며, Kawao & Kaji [7]의 연구에서도 osteonectin은 마이오스타틴(myostatin)과 IGF-1과 함께 근육에서 생산되어 뼈의 분화와 성장에 작용하는 것이 밝혀져 있으며, 근육에서 유래된 osteoglycin은 체액성의 골형성 인자로서의 작용을 보고하고 있다. Tanaka et al. [4]도 osteoglycin은 근아세포(myoblasts)에서 분비되며 골아세포 분화를 자극하고, 근육-뼈 상호작용에 있어 중요한 역할을 하는 것을 보고하고 있다. 이처럼 osteonectin, osteoglycin은 근육에서 생산되어 뼈의 분화와 성장에 작용하는 것이 밝혀지고 있다. 한편 골세포에서 발현되어 미세중력에 의한 골밀도 감소에 영향을 미치는 물질로 밝혀졌던 sclerostin [8]은 최근의 연구에서 근육과의 관련성이 보고되고 있다. 근위축성 측삭경화증 모델 흰쥐(G93A transgenic mouse model)를 사용하여 근위축과 골대사를 검토한 Zhu et al. [9]의 연구에 의하면 근 위축과 함께 해면골과 피질골에서의 급격한 골밀도의 감소를 발견하였고, 이때 sclerostin과 Receptor Activator of Nuclear factor Kappa-B ligand (RANKL)의 관여를 밝히고 있다. Szulc et al. [8]도 20세에서 87세의 1,134명의 남성을 대상으로 골밀도와 골격근의 유의한 정적 상관관계를 밝힌 연구에서 뼈의 미세구조 형성과 혈청 sclerostin의 관련성이 있음을 밝히고 있다. 이상과 같이 근육-뼈 crosstalk 인자의 기능과 역할이 하나씩 밝혀지고 있지만, 이들에 대한 운동 효과에 대해서는 아직 알려진 바 없으며, 복합운동이 근육-뼈 crosstalk 인자에 미치는 영향에 대해 검토가 필요하다. Avin et al. [10]은 근육-뼈 간의 상호작용에 있어서 유전 및 분자생물학적 접근의 필요성을 언급하면서, 특히 근육-뼈 간의 상호작용을 검토하기 위한 모델로 운동과 같은 기계적인 부하의 중요성을 강조하고 있다.
따라서 본 연구에서는 여대생을 대상으로 12주간의 복합운동을 부하하여 각종 체력 지표 및 부위별 근육량, 골밀도의 변화를 검토하고, 근육 관련 인자와 골대사 인자를 혈액 레벨에서 관찰하는 한편, 근육성장인자의 mRNA 발현 등을 분자생물학적 방법으로 분석하여 운동이 근육-뼈 crosstalk 인자에 미치는 영향을 종합적으로 검토하는 것을 목적으로 하였다.
연구 방법
1. 연구대상
사전 건강검사 및 운동부하 검사를 실시하여 건강하고 자율적으로 실험에 참여를 희망하는 20-24세의 여대생 24명(22.3±1.2 years)을 대상자로 하였다. 각 집단별 최소 필요한 대상자 수는 통계분석소프트인 G*Power calculator (ver. 3.1)에 의해 분석되어 집단별로 12명씩 총 24명을 최종 대상자로 하였다. 최종 선발된 피험자를 대상으로 D대학교의 실험에 대한 규정 및 보건복지부 지정 공용기관생명윤리위원회 규정에 따라, 실험내용 및 피해점, 실험중지의 자유 등에 대하여 자세히 설명하고, 각 피험자로부터 동의를 얻었다(P01-201511-13-001). 집단의 구분은 무선할당 방식을 통해 각각 12명의 대상자를 복합운동집단(Ex, n =12)과 대조집단(Con, n=12)으로 분류하여 Ex집단에 12주 운동프로그램을 부하하고 운동 전후에 측정하는 반복 실험을 실시하였다.
2. 연구절차
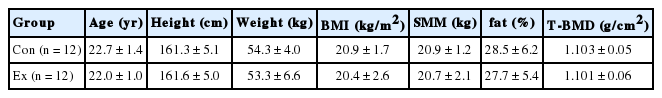
연구대상자들은 실험 시작 1주일 전에 사전검사를 실시하였다. 사전검사 시, 실험실에 도착하여 30분간 안정을 취한 후 전문 의료인을 통해 상완정맥에서 채혈을 하였으며, 체성분 분석 및 골밀도 분석, 최대산소섭취량, 기초체력 등을 측정하였다. 실험 전 두 집단의 신체적 특성은 Table 1과 같다. Con집단은 12주의 연구기간 동안 변인에 영향을 줄 수 있는 약물이나 식이요법 및 정기적인 운동을 금지하였다. Ex집단은 12주 동안 주 3회, 1일 60분의 복합운동 프로그램을 수행하였다. 12주의 연구기간 종료 후 다시 실험실에 방문하여 사전과 동일한 방법으로 사후검사를 실시하였다. 사전과 사후에 채혈한 혈액은 D대학의 실험실에서 근육-뼈 crosstalk 인자 및 골대사 관련 인자들의 혈중 농도와 mRNA 발현량을 확인하기 위한 실험이 진행되었으며, 일부 혈액은 전문 혈액기관(씨젠의료재단, Seoul, Korea)에 의뢰하여 분석하였다.
3. 운동 부하 방법
Ex집단은 1일 각각 유산소운동과 저항운동을 30분씩, 주 3회, 총 12주간 실시하였다(Table 2). 이를 위해 사전에 VO2max와 사용하는 각 기기별 1RM (repetition maximum)을 측정하여 복합운동부하 강도를 결정하는 데 이용하였다. 유산소운동 강도는 트레드밀을 이용하여 사전에 측정한 VO2max를 기준으로 50%VO2max 강도로 시작하여 4주 간격으로 운동강도를 높여 70%VO2max 강도로 운동을 실시하였다. 저항운동은 고정식 웨이트머신을 이용하여 레그 익스텐션(leg extension), 레그 컬(leg curl), 레그 프레스(leg press), 업도미널 컬(abdominal curl), 체스트 프레스(chest press), 숄더 프레스(shoulder press), 렛 풀 다운(lat pull down), 암 컬(arm curl), 트라이셉 익스텐션(triceps extension)의 9종목을 실시하였다. 각 종목은 8-12회 반복을 1세트로 하여 각 2세트씩 실시하며, 사전에 측정한 1RM을 기준으로 60%1RM 강도로 시작하여 4주 간격으로 운동강도를 높여 85%1RM 강도까지 운동을 실시하였다(Fig. 1). 운동실시 전후에 각각 10분씩의 준비운동 및 정리운동을 가벼운 스트레칭 위주로 실시하였다.
4. 체력 요인별 측정
등속성근력은 Isokinetic dynamometer Cybex (Norm system 770, USA)를 이용하여 측정하였다. 측정부위는 팔꿉관절과 무릎관절로 각 속도 60°/sec에서 굴근 및 신근력을 측정하여 최대힘효율(peak torque)을 분석하였다. 기초체력으로 배근력과 악력은 각각 디지털 배근력계(TKK-5402, Takei, Japan)와 디지털 악력기(TKK-5401, Takei, Japan)를 사용하여 측정하였다. 또한, 윗몸 일으키기, 체전굴, 체후굴, 눈감고외발서기, 전신반응, 사이드스텝, 제자리멀리뛰기, 제자리높이뛰기를 측정하였다. VO2max측정은 Bruce 프로토콜을 적용하여 트레드밀 에르고미터(T170 DE, Cosmed, Italy)와 가스분석기(Quark CPET, Cosmed, Italy)를 이용하여 실시하였다.
5. 근육량 및 골밀도 측정
신체전기저항법(BIA)을 이용한 체성분 분석기(In-Body 720, Bio-Space Co., Korea)를 이용하여 근육량 및 체지방량 등을 측정하였으며, 이중에너지 X레이흡수법(Dual energy X-ray apsorptionmetry, DEXA법)에 의한 골밀도측정기(DPX-L, LUNAR, USA)를 사용하여 골밀도와 근육량 등을 측정하였다.
6. 혈액 처리 및 분석
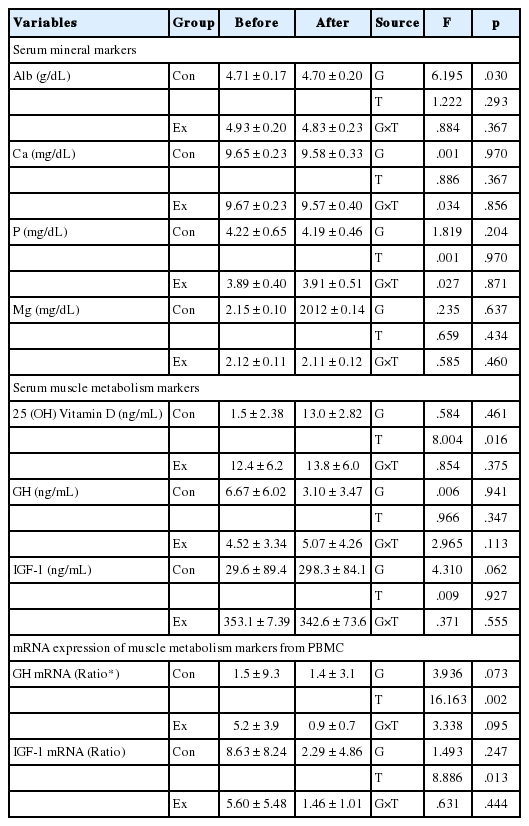
채혈은 운동프로그램을 시작하기 전과 12주간의 운동프로그램 종료 후, 총 2회 실시하였다. 채혈은 식사와 운동에 의한 일시적인 혈액변인의 변화를 방지하기 위하여 채혈 전 24시간 동안 일상생활 이외의 신체활동을 제한하고 일정한 식사패턴을 유지하게 하여 실시하였다. 채혈된 혈액으로부터 일부는 혈청을 분리하여 근육과 뼈 관련 인자의 농도를 분석하고, 혈액 일부는 말초혈단핵구(peripheral blood mononuclear cell, PBMC)를 분리 추출하여 GH와 IGF-1의 mRNA 발현을 검토하였다. 혈청 중 칼슘 대사의 변화를 살피기 위하여 Albumin과 Ca, P, Mg을 전문 혈액 분석회사인 재단법인 씨젠의료재단(검사기관기호 NO: 11370319)에 의뢰하여 분석하였다. 혈청 중 근육 성장인자로서 GH와 IGF-1, vitamin D를, 골흡수 표지자로서는 carboxy-terminal collagen crosslinks (CTX)를 동일하게 의뢰하여 ELISA법으로 분석하였다. 본 연구의 주요 타깃인 osteonectin과 osteocalcin, osteoglycin, sclerostin은 각각의 전용 측정용 ELISA 킷(Human Osteonectin ELISA kit, Fine Test, China; Human Osteocalcin ELISA kit, Fine Test, Human Osteoglycin ELISA kit, Fine Test, China; Human Sclerostin [SOST] ELISA kit, Fine Test, China)을 사용하여 분석하였다.
7. PBMC로부터의 근육성장인자 mRNA 발현량 분석
채혈한 혈액의 약 4 mL는 PBMC에서 총RNA의 추출을 위하여 헤파린 튜브(BD Franklin Lakes NJ, USA)에 처리하여 채혈 직후 3시간 이내에 RNA 추출을 하였으며, NucleoSpin RNA blood kit (machereynagel, Germany)을 이용하여 매뉴얼에 따라 총 RNA를 추출하였다. 추출된 RNA로부터 cDNA의 합성은 AccuPower RocketScriptTM Cycle RT PreMix (Bioneer. KR)를 사용하였으며, 분광광도계(spectrophotometer, ASP-2680, CellTA Gen, KR)를 이용하여 A260/A280비율에서 DNA의 농도를 확인하였다. 근육-뼈 crosstalk 인자 및 근육 성장인자 mRNA의 분석은 실시간 중합효소 연쇄반응(Real-time quantitative polymerase chain reaction, RT-PCR)을 이용하여 cDNA를 증폭시켜 측정하였다. 역전사반응을 통하여 합성된 cDNA와 반응하는 앞쪽 프라이머(forward primer, +) 및 뒤쪽 프라이머(reverse primer, -)는 Primer ExpressTM (Applied Biosystems, Foster, CA, USA)을 이용하여 디자인하였다. 사이버 그린(SYBR Green) 분석은 C1000 Thermal Cycler (CFX96 real-time system, Bio-Rad, US) 기계를 사용하였으며, 정량을 위하여 하우스키핑 유전자(glyceraldehyde 3-phosphate dehydrogenase, GAPDH) mRNA에 대한 상대량을 분석하였다. 각 변인들 mRNA분석에 사용한 프라이머 염기서열(Primer sequences)은 다음과 같다. GH(+) GAA GAA GCC TAT ATC CCA, GH(-) TCG GAA TAG ACT CTG AGA, IGF-1(+) GTG GAT GAG TGC TGC TTC, IGF-1(-) CTT CCT TCT GGG TCT TGG, GAPDH(+) AGA GAT GGC CAC GGC TGC TT, GAPDH(-) ATT TGC GGT GGA CGA TGG AG.
8. 자료분석 및 통계방법
모든 자료는 SPSS 21.0 통계 프로그램을 이용하여 요인별 평균과 표준편차를 산출하였다. 통계처리는 이원변량반복분산분석(2-way repeated measure ANOVA)을 실시하여 집단(2종류: Con 및 Ex집단)에 따른 시기 간(2시기: 운동 전 및 운동 후)의 차이(2 by 2)를 분석하였다. ANOVA 검사 후 유의한 차이가 있을 경우, 사후검사로 시기 간은 paired t-test, 집단 간에는 independent t-test를 실시하였다. 통계적 유의수준은 5% 미만(p<.05) 으로 설정하였다.
결 과
1. 신체조성의 변화
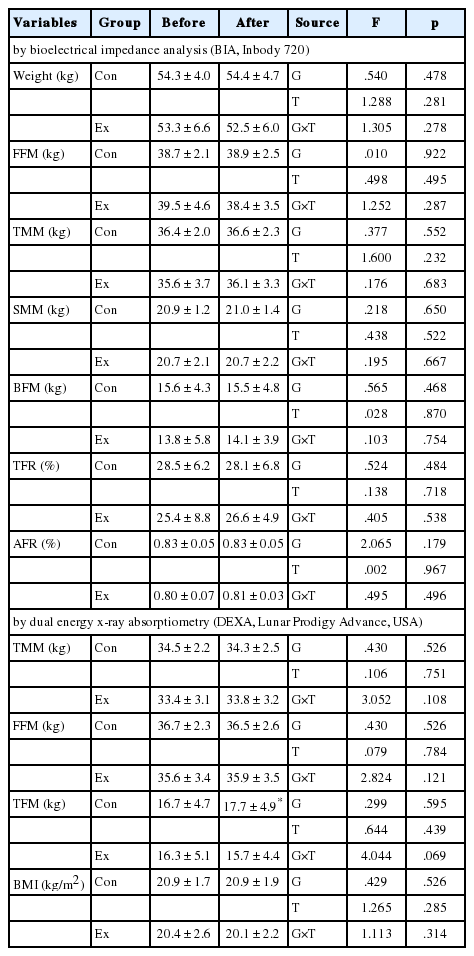
Con 및 Ex집단의 12주간 실험 전후의 신체조성 변화는 Table 3에 나타냈다. 신체조성은 BIA법과 DEXA법을 이용하여 제지방중량 및 근육량, 골격근량, 체지방량, 체지방률 등을 측정했으나 모든 항목에 있어서 유의한 변화는 없었다.
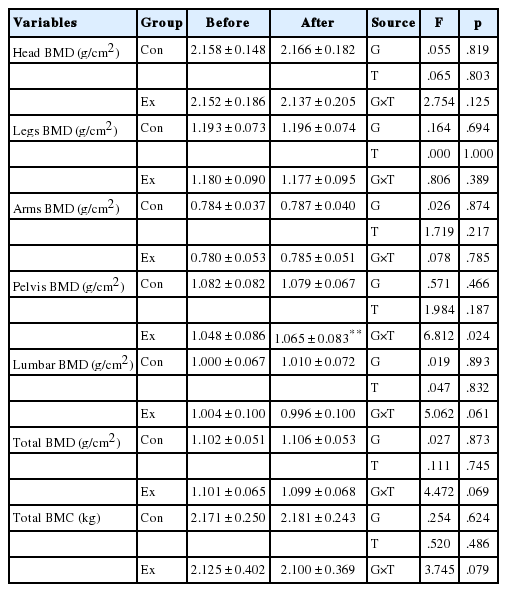
2. 골밀도의 변화
골밀도는 DEXA법을 이용하여 전신 및 머리, 다리, 팔, 골반, 요추 부위를 측정했으며, Ex집단의 골반 골밀도가 운동 후 유의하게 증가하였다(p <.01). 전신골염량을 포함하여 다른 부위에서는 유의미한 변화는 나타나지 않았다(Table 4).
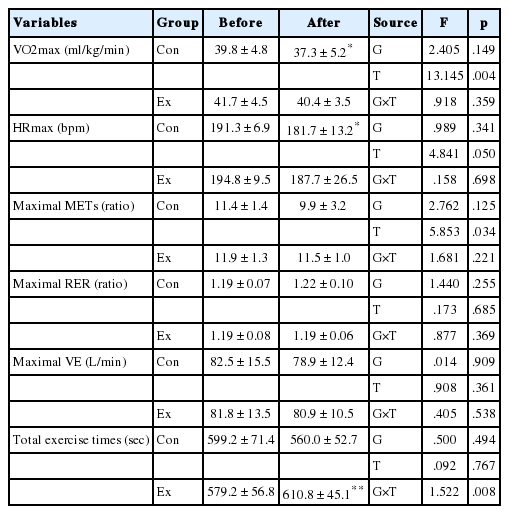
3. 심폐지구력의 변화
심폐지구력 지표에 있어서는 Ex집단의 총운동시간이 운동 후 유의하게 증가하였다(p<.01). 그 외 VO2max 및 HRmax, Maximal METs 등의 지표에 있어서 실험 후 감소하는 경향을 나타냈으나 상호작용효과는 나타나지 않았다(Table 5).
4. 기초체력의 변화
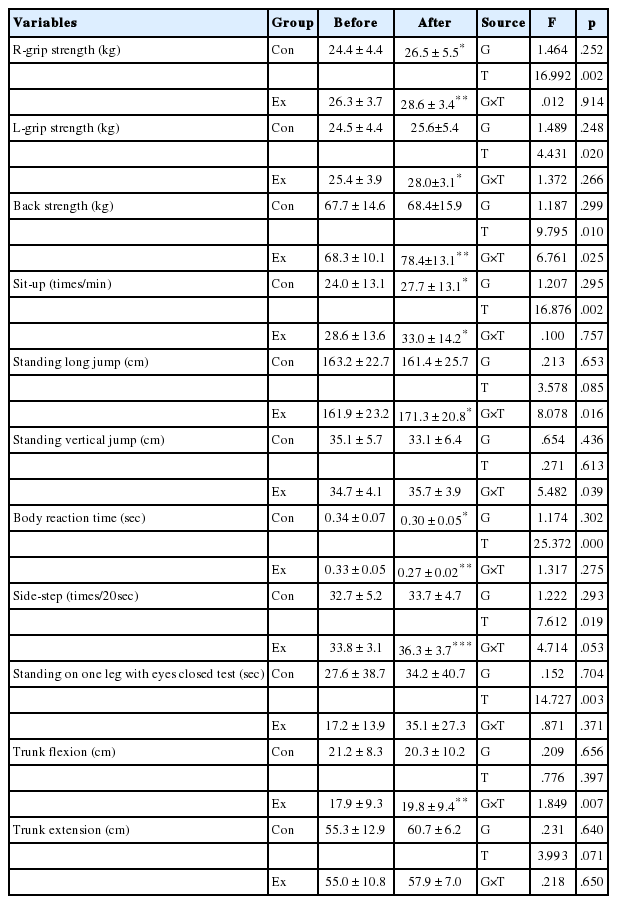
기초체력 지표에 있어서는 Ex집단의 배근력, 제자리멀리뛰기, 제자리높이뛰기, 윗몸앞으로굽히기가 운동 후 유의하게 증가하였다(p<.05, p <.01). 그 외 좌우 악력 및 윗몸일으키기, 전신반응, 사이드스텝, 눈감고외발서기 등의 지표에 있어서 시기 간의 차이를 나타냈으나 상호작용효과는 나타나지 않았다(Table 6).
5. 등속성 근력의 변화
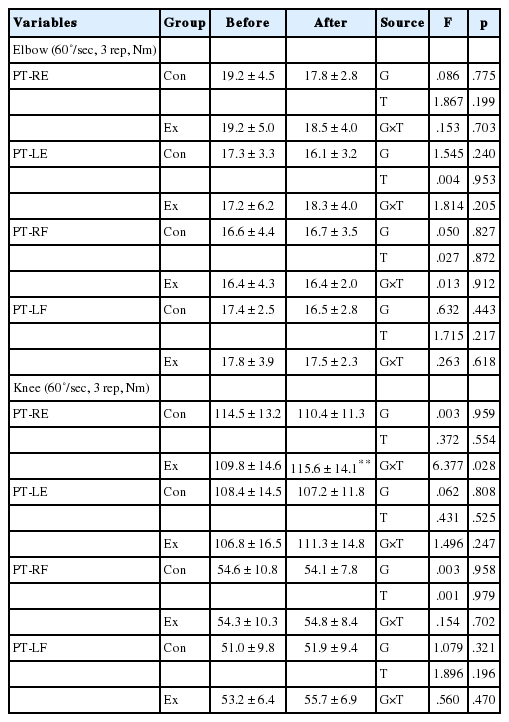
등속성 근력 지표에 있어서는 Ex집단의 오른쪽무릎 신전최대근력이 운동 후 유의하게 증가하였다(p <.01). 그 외 다른 지표에 있어서 유의미한 차이는 나타나지 않았다(Table 7).
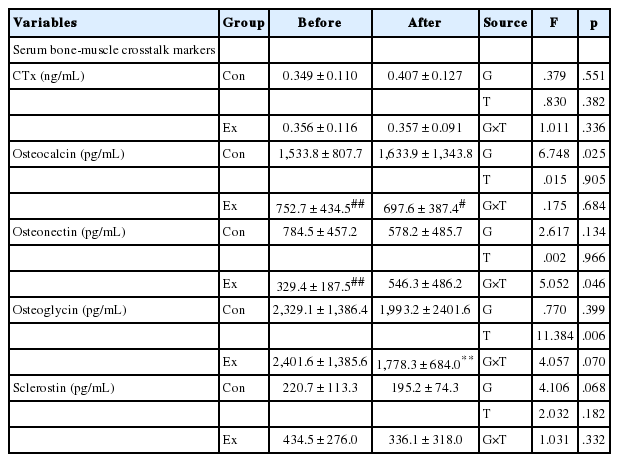
6. 근육-뼈 crosstalk 인자의 변화
근육-뼈 crosstalk 인자에 있어서는 Ex집단의 혈청 osteonectin 농도가 운동 후 증가하는 경향을 보였다. 그 외 혈청 osteocalcin 및 osteoglycin 등의 지표에 있어서 시기 또는 집단 간의 차이를 나타냈으나 상호작용효과는 나타나지 않았다(Table 8).
논 의
운동부족으로 인한 근감소증과 골다공증은 심각하게 건강을 위협하고 있다. 운동부족은 뼈에 있어서는 골형성과 골미네랄화를 억제시키고[11], 골흡수를 촉진하여 골밀도와 골강도를 저하시키는[12] 한편, 근육에 있어서는 근육량과 근력[13], 근신경 기능[14], 근육 밸런스[15]를 저하시키고, 근육제어 능력을 감소시켜 낙상위험을 증가시키고[16] 결국에는 골절위험률을 증가시킨다. 근육은 신체 내에서 움직임이 가능한 모든 부분에 위치하며, 수축에 의한 관절의 움직임을 통하여 운동을 일으킨다[17]. 또한 뼈는 몸을 지탱하여 운동기능을 수행하는 중요한 기관이다[18]. 근육과 뼈는 운동을 일으키고 수행하는 과정에서 동시에 운동에 반응하고 적응한다. 그러나 운동이 근육과 뼈에 각각 미치는 효과에 대한 연구는 많이 진행되고 있으나, 근육과 뼈에 동시에 어느 정도의 영향을 미치고, 어떠한 경로를 통하여 운동의 효과가 나타나는지에 대한 연구는 부족하다. 최근 Abou-Khalil et al. [19]의 골격 재건에 있어서의 근육 stem cell의 역할과 관련된 연구에서 뼈의 재건에 있어서 근육이 직접적으로 기여하고 있음을 밝히고 있다. 성염색체인 X염색체 부족에 의하여 난소 형성 부전과 함께 저신장증을 포함한 다양한 신체 변화가 함께 나타나는 유전 질환인 터너 증후군 환자를 대상으로 한 연구에서도 근육량 감소와 함께 골량감소를 나타낸다고 보고하면서 근육-뼈 crosstalk에 대해서 보고하고 있다[20]. Bonjour et al. [5]도 성인의 근육과 뼈의 건강을 위한 영양소의 상호작용에 대한 연구에서 칼슘과 인, 비타민D와 단백질의 중요성을 강조하였다. 비타민D 결핍과 최종당화산물(AGEs)은 골다공증과 근감소증의 병인으로 추측되며, Tanaka et al. [4]은 활성 vitamin D가 근육-뼈 crosstalk에 유용한 효과가 있음을 보고하고 있다. 이처럼 최근에 근육과 뼈에 대한 상호작용 효과에 대한 연구로서 내분비나 영양 분야에서 조금씩 진행되고 있으나, 운동의 효과에 대한 연구는 양·질적으로 부족한 실정이다. Delecluse et al. [21]은 60세 이상의 건강한 노인들을 대상으로 전신진동운동과 유산소 운동을 통하여 골밀도 및 근육량이 동시에 증가하는 것을 밝히고 있으며, Sung et al. [22]의 배드민턴 동호인의 운동경력을 검토한 연구에 의하면 장기간의 배드민턴 운동이 하지의 골밀도와 근육량을 동시에 증가시킨다고 보고하고 있다. 또한, Ireland et al. [23]의 테니스선수의 주동팔과 비주동팔을 비교한 연구에 의하면 근육활동과 뼈의 적응에 있어 강한 관련성을 보고하면서, 주동팔에 있어서 국소 근육 사이즈와 뼈의 강도 간의 차에 의하여 근육-뼈의 비대칭성이 나타날 가능성에 대하여 보고하고 있다. 이처럼 일부 연구에서 운동에 의한 근육량과 뼈에 있어 동시에 긍정적인 효과를 나타내고 있음을 밝히는 연구가 있으나, 근육과 뼈의 상호작용에 관여하는 crosstalk 인자에 미치는 운동효과를 보고한 연구는 부족하다.
이에 본 연구에서는 무작위대조시험법(randomized controlled trial)으로 건강한 여대생을 대상으로 12주간의 유산소와 저항성으로 구성된 복합운동을 부하하여, 체력 및 부위별 근육량 및 골밀도의 변화를 검토하고, 혈액 레벨에서의 근육 관련 인자와 골대사 인자와 함께 근육-뼈 crosstalk 인자의 변화를 관찰하는 한편, PBMC 레벨에서의 근육성장인자의 mRNA 발현을 분석하여 운동이 근육-뼈 crosstalk 인자에 미치는 영향을 종합적으로 검토하였다. 그 결과 전신골밀도 및 근육량에서는 개선효과는 나타나지 않았지만, 골반 부위 골밀도의 개선과 함께 체력지표에 있어서 VO2max 측정 시의 총 운동시간 및 배근력, 제자리멀리뛰기, 제자리높이뛰기, 윗몸앞으로굽히기 등의 기초체력 지표에 있어서 개선 효과가 나타났다. 또한 등속성 근력 지표에 있어서 오른쪽무릎 신전최대근력의 유의한 증가가 밝혀졌다. 그러나 근육-뼈 crosstalk 인자에서는 Ex집단의 혈청 osteonectin 농도가 증가하는 경향을 보였을 뿐 그 외 인자에 있어서는 변화가 없었고, 근육성장인자에 있어서도 유의미한 변화는 나타나지 않았다. 이러한 근육-뼈 crosstalk 인자의 미비한 변화는 본 실험 결과에서 전신 골밀도와 근육량에 있어서 유의미한 개선 효과가 없었다는 점을 고려하면 어쩌면 당연한 일이라고 생각된다. 한편 Malarkey et al. [24]은 노인들의 PBMC로부터의 GH mRNA의 발현과 만성적 스트레스와의 관련성을 검토하고 있으며, Wu et al. [25]은 알츠하이머 치매 환자의 PBMC로부터의 T-cell과 B-cell을 분리하여 GH mRNA의 발현을 검토하고 있다. 또한, Nakamura et al. [26]은 IgA nephropathy (IgAN) 환자의 PBMC로부터의 IGF-I mRNA의 발현은 IgAN을 가진 환자의 신장 조직에서의 병리학적 발견과 관련이 있다고 보고하고 있다. 이처럼 PBMC로부터의 GH와 IGF-1의 mRNA의 발현 검토는 생리적 변화를 검토하는 차원에서 의미 있다고 판단하여 본 실험에서도 검토하였다. 즉 근육량이나 골밀도처럼 형태적인 변화와 함께 대사적인 차원에서 PBMC로부터의 mRNA 레벨에서의 근육성장인자의 변화가 나타날 수 있다고 판단되어 검토하였으나 혈청 농도와 마찬가지로 운동에 의한 차이는 발견할 수 없었다.
본 연구에서 실시한 운동 방법은 주 3회 각각 30분의 유산소(50-70% VO2max)와 저항성(60-85%1RM) 운동 1시간씩을 12주간 시행하였다. 몇몇 연구와 같이 이 운동은 여대생의 골밀도와 근육량 증가에 효과적일 것이라 생각되었지만[27], 일부 부위 골밀도 증가와 일부 체력 개선 효과에 그치고 말았다. 전문체력이라고 평가되는 등속성 근력에서도 미비했던 개선 효과를 감안하면 결론적으로 본 연구에서 실시한 운동 방법은 일부 기초체력의 개선에는 효과적일 수 있지만, 골밀도를 증가시키고 근육량을 증가시키기에는 불충분했던 것으로 사료된다. 일반적으로 대부분의 장기적인 운동은 여러 신체기능을 개선시키는 것은 주지의 사실이다. 당뇨병[28], 심혈관[29], 고혈압[30]등의 대사성질환자들[31]뿐만 아니라 건강한 대상자들에 있어서 많은 논문들이 이를 뒷받침하고 있다. 그러나 골밀도를 개선시키는 위해서는 운동부하방법을 잘 선택해야 한다. Sanudo et al. [32]의 systematic review에 의하면 폐경 및 폐경 이후 여성의 골밀도 개선을 위한 운동 방법으로는 진동이나 근력 운동과 같은 impact 운동이 효과적이라고 보고하면서, 부하 강도와 빈도의 중요성을 언급하고 있다. 14세에서 18세의 남녀 청소년을 대상으로 각 30분씩 1주일 3회의 유산소운동과 저항성운동을 병행하는 운동을 1년 동안 실시하여도 골염량의 증가는 보였지만 골밀도의 개선 효과는 없었다는 보고[33]도 있는 것처럼, 같은 운동이라 하더라도 운동형태와 강도, 빈도, 기간 등에 따라서 골밀도의 개선 효과는 다르게 나타날 수 있다. 또한, 본 연구에서 대상자들을 건강한 여대생을 대상으로 했던 만큼 위의 질환자들의 경우처럼 그 효과가 드라마틱하게 나타나지 않았을 가능성도 있다. 본 연구의 목적으로 제시한 운동에 대한 근육-뼈 crosstalk의 기전을 밝히기 위해서는 골밀도와 함께 근육량도 변화한 상태에서 각 체력인자와 혈중인자들의 관련성을 밝힐 필요가 있는 것인데 현재로서는 부족한 실정이고, 향후 추가 연구가 필요한 이유이다.
그럼에도 불구하고 본 연구에 있어서 근육-뼈 crosstalk 인자 중 혈청 osteonectin 농도가 증가하는 경향을 보인 점은 주목할 점이라 생각된다. osteonectin은 osteoblasts, endothelial cells에서 생산되는 접착성 당단백질(adhesive glycoprotein)로[34], 최근 근육세포에서도 발현되어 근육 및 뼈의 분화와 성장에 작용하고[7], 미네랄화되는 조직에서 가장 풍부하게 발현되는 비콜라겐성 단백질 중 하나로 알려져 있다[35]. LDL산화(oxidized low-density lipoprotein)가 osteonectin의 발현을 증가시켜 혈관 석회화를 촉진시킨다는 연구[36] 등이 있지만, 운동과 osteonectin의 관련성을 검토한 연구는 찾을 수가 없다. 또한, Amaral et al. [37]의 골수 종양(bone neoplasm)에서의 vimentin, oleonectin 및 oleocalcin의 발현량을 검토한 연구에서 oleocalcin에 비하여 oleonectin의 발현이 더 높다고 보고하고 있다. 또한 osteonectin은 osteopontin과 focal adhesion kinase의 활동을 촉진시킨다는 논문[38]과 같이, 운동에 의한 반응으로써 osteonectin이 다른 인자에 비하여 빠르게 반응하여 초기 골대사에 촉진제 역할을 가능성이 시사된다. 근육-뼈 crosstalk 인자에 있어서 osteonectin은 민감하게 운동에 반응하는 인자일 가능성이 있다.
결 론
건강한 여대생을 대상으로 12주간의 복합운동을 부하하여 근육-뼈 crosstalk 인자의 변화를 검토한 결과, 골반 골밀도 및 총 운동시간, 배근력, 제자리멀리뛰기, 제자리높이뛰기, 윗몸앞으로굽히기, 오른쪽무릎 신전최대근력의 증가와 함께 혈청 osteonectin의 유의한 증가가 밝혀졌다. 이 결과로부터 osteonectin은 근육-뼈 crosstalk 인자 중에서 운동에 대한 민감도가 높을 가능성이 시사되었다.
Notes
이 논문 작성에 있어서 어떠한 조직으로부터 재정을 포함한 일체의 지원을 받지 않았으며, 논문에 영향을 미칠 수 있는 어떠한 관계도 없음을 밝힌다.