12주간의 지구성 운동이 비만 흰쥐 해마의 도파민 수용체 단백질 발현에 미치는 영향
Effects of 12-week Endurance Exercise on Dopamine Receptor Protein Expression in Hippocampus of Obese Rat
Article information
Trans Abstract
PURPOSE
The purpose of this study was to investigate changes of body composition, D1 dopamine receptors (D1DR), and D2 dopamine receptors (D2DR) protein expression after 12 weeks of moderate-intensity treadmill exercise in hippocampus of high fat diet-induced obese rats.
METHODS
Subjects were consisted of 40 male 10 weeks aged Sprague-Dawley rats, and were randomly divided into four experimental groups: chow, HFD, chow+exercise, and HFD+exercise. The exercise groups underwent aerobic training using treadmill running exercise with 3 days/week for a total of 12 weeks. Body composition, D1DR, D2DR, ERK1/2, and Akt protein expression in hippocampus were measured for the comparison among groups.
RESULTS
High fat diet-induced obesity decreased the expression of D1DR and D2DR in hippocampus. 12 week of moderate-intensity treadmill exercise increased D1DR expression in hippocampus. 12 weeks of moderate-intensity treadmill exercise does not affect the improvement of the D1DR and D2DR receptors in obese rats. 12 weeks of moderate-intensity treadmill exercise had a positive effect on improvement of endurance capacity and insulin sensitivity.
CONCLUSIONS
These results suggest that moderate-intensity treadmill exercise has a positive effect on the expression of dopamine receptors in hippocampal tissues, whereas high-fat diet intake is negative factor in the expression of dopamine receptors. However, based on the results of this study, it is somewhat lacking to clearly define the expression of dopamine receptors by high-fat diet and endurance exercise. Dopamine receptors are known to be expressed not only in hippocampus but also in all parts of the brain. Therefore, additional studies should be conducted to understand the correlation between various dopamine receptors expressed in other tissues as well as exercise methods and various factors.
서 론
비만은 대사성 질환과 관련요인들의 불균형과 자아의식 및 정신적 혼란을 발생시킬 가능성을 증가시킨다[1,2]. 비만인은 정신적 스트레스와 우울증지수가 높고 외부자극에 민감하거나 감정표현의 저하현상을 나타낼 가능성이 상대적으로 높다[3]. 이러한 현상들은 비만 발생 과정의 체성분 변화에 의한 신경전달물질 및 대사성호르몬 분비의 불균형이 주된 원인으로 간주되고 있다[4].
뇌의 활성화와 관련된 호르몬 중 도파민(Dopamine)은 중요한 신경전달물질로서 뇌의 사고와 보상에 영향을 미치며[5,6], 특히 비만환자[7] 또는 뇌 질환자[8] 등은 정상그룹에 비해 도파민의 활성이 현저하게 낮게 나타나며, 약물 또는 강한 자극에 취약한 특성을 나타내면서 음식물 섭취를 포함한 중독행동을 나타낼 가능성이 높다. 특히 뇌의 해마(hippocampus)는 스트레스의 부정적인 영향을 받는 대표적 부위로서 스트레스로 인해 해마 관련 과제수행능력이 심각하게 저하되는 행동적 손상을 일으킨다고 보고하였다[9]. 아동 및 청소년에서 비만으로 발생되는 스트레스는 세포사멸과 활동성 등의 생리적인 불균형과 다양한 질병의 원인으로 작용하며, 부정적인 신체상, 자아존중감 및 자신감 저하로 인한 대인관계 기피현상을 비롯한 심리적인 부작용을 가져올 수 있다고 보고하였다[10,11]. 체중의 증가와 뇌에서 일어나는 질환 및 증상에 대한 연구는 최근 들어 정신과 환자에서의 높은 비만 유병율 및 항정신병약물이 체중 증가를 일으키는 현상, 그리고 비만이 약물치료에 있어 비순응(non-compliance)의 원인이 된다는 연구결과가 알려지면서 관심이 이어지고 있다[12,13]. 이는 도파민, 세로토닌, 아세틸 콜린, 히스타민 등과 같은 수용체가 체중 증가와 연관된 것으로 보고되었으며, 이 중 도파민은 강력한 카테콜라민의 하나로써 주목 받고 있다[14]. 도파민 수용체는 체내 섭식조절과 관련된 신경경로의 활성화에 중요한 영향을 미치며 특히 렙틴 및 그레린의 활성도를 조절하여 식이섭취 항상성 조절에 의한 비만발생여부에 중요한 영향을 미치는데[15], 특히 도파민 수용체의 세부아형인 D1DR과 D2DR은 상호 길항적 경로를 통해서 cAMP-protein kinase A 하위경로의 항상성 조절에 영향을 미치는 것으로 알려져 있다[16].
Hamdi와 Prasadac [7]은 체중이 정상인 집단에 비해 비만집단의 도파민 수용체(Dopamine receptors) 발현이 유의하게 감소하는 것으로 보고하였다. 또한 도파민 수용체와 그 활성화에 대한 분석에서도 D2DR (D2 Dopamine receptors) 길항제(Antagonist)를 흰쥐에게 처치한 결과 활성화 수준이 유의하게 저하되었으며[17], D2DR의 길항제 처치와 관련하여 길항제로 인한 보상적 식욕증가를 유도하여 체중을 증가시키며, D2DR 수용체가 완전히 결핍된 생쥐는 파킨슨병(Parkinson’s disease) 환자와 비슷한 비정상적 움직임의 형태를 나타내면서 움직임이 저하되는 특성이 나타나는 것으로 보고하였다[18]. 이는 뇌에서 발현되는 도파민의 활성 및 저하로 인해서 그 하위요인인 cAMP의 활성을 촉진 및 억제하여 뇌에서부터 시작되는 다양한 신호(움직임, 보상, 섭식 행동, 동기, 호르몬 합성 및 분비 조절) 제어에 도파민 수용체가 관여하는 것을 알 수 있다[19]. 이와 같이 선행연구를 통해서 과다한 음식섭취에 따른 비만상태에서는 신경전달물질회로의 불안정성을 유발하고 이로 인한 보상회로의 활성을 통해 정신적, 신체적 질병을 유발한다는 것을 알 수 있었다.
가장 대표적인 비만처치방법으로는 식이조절과 운동프로그램의 복합적 방법을 들 수 있는데, 규칙적인 식습관 및 올바른 영양섭취와 더불어 지구성 운동의 참여는 체중유지 및 뇌에서 발현되는 신경전달물질의 불균형을 개선시키는데 효과가 있음을 확인하였다[20]. 그러나 그 효과를 분석하는 과정에서 다른 요인의 영향 또는 환경요인의 변화 등으로 인한 제한이 따른다고 주장하였다[21]. 신체활동은 체중뿐만아니라 신경전달물질의 항상성 유지에 중요한 요인으로 작용한다[22]. 규칙적인 운동은 비만처치효과와 더불어 신경계의 건강과 기능 및 뇌손상의 회복에 긍정적인 영향을 미쳤으며, 뇌의 내인성 항산화시스템의 활성화[23]와 흥분독성(excitotoxicity)과 연관된 글루타메이트 수용기를 하향 조절하는 것으로 알려져 있다[24]. 12주간 중강도 혹은 다양한 강도의 유산소운동을 실시한 결과 체지방감소에 유의한 효과를 나타냈다[25,26]. 또한 고지방식이로 비만을 유도한 생쥐에 운동트레이닝을 실시하였을 때 체중감량효과를 얻은 것으로 보고하였다[27]. 그러나 운동강도의 차이에 따른 운동참여와 관련된 연구에서 저강도 운동이 체지방량을 유의하게 감소시켰지만, 단시간 고강도 운동 시에는 체지방감소가 나타나지 않는 것으로 보고하였다[28]. 이와 같이 운동 강도와 참여시간에 따라서 체중 및 지방의 감소가 다르게 나타남으로서 적절한 운동강도로 실시하는 장기간 유산소운동이 체중을 감소시키는데 중요한 요인이 되는 것으로 주장하였다[20,28]. 규칙적인 운동은 파킨슨 질병과 같이 뇌 질환자의 뇌 신경기능과 관련된 요인의 긍정적인 효과가 보고[29]된 바 있으며, 최근에는 심지어 외상에 의한 뇌손상 시 운동수행 효과는 도파민 수용체 활성화를 통해서 인지기능개선에 도움을 준다[30]고 보고된 바 있다. 그러나 고지방식이에 의한 비만유도 시 혹은 비만처치를 위한 유산소운동 시 중추신경계의 중요한 신경자극전달요인에 해당하는 도파민 수용체의 활성화와 관련된 세부적인 기전에 대한 분석은 여전히 미흡한 상태이며, Beeler et al. [31]은 비만상태 개선을 위한 운동처치과정에서 도파민 수용체의 세부아형 활성화 변화의 영향에 대한 연구가 계속적으로 요구된다고 하였다.
이에 본 연구는 10주령의 흰쥐를 대상으로 12주간의 일반식이 및 고지방식이와 중강도의 지구성 운동이 신체구성과 해마에서 발현되는 도파민 수용체(D1DR, D2DR)의 활성화에 어떤 영향을 미치는지 분석하고, 아울러 도파민 수용체 발현과 관련된 하위변인(ERK, mTOR, Akt)에도 어떤 영향을 미치는지 분석하였다.
연구 방법
1. 연구대상
본 연구의 대상은 10주령의 수컷 Sprague Dawley (SD) 흰쥐 40마리를 대상으로 1주간의 환경적응 후 일반식이(Chow diet+Sedentary), 고지방식이(High-fat diet+Sedentary), 일반식이+운동(Chow diet+Exercise), 고지방식이+운동(High-fat diet+Exercise) 등의 4그룹으로 무선배정 하여 12주간 처치를 실시하였다. 한 케이지(20.7×35×17 cm)에 2마리씩 사육하고, 사육실의 온도는 21℃로 유지하며, 명기와 암기를 각각 12시간으로 조절하였다. 체중은 전자저울(Mettler PJ6, German)로 매일 측정하고, 일반식이 및 고지방식이 섭취량은 매일 측정하여 기록하였다. 본 연구는 (재)대구테크노파크 바이오헬스융합센터 동물실험윤리위원회의 승인(BHCC-IACUC-2016-01)을 얻어 실시하였다. 식이 및 운동 처치 후 나타난 그룹별 신체구성은 다음과 같다(Table 1).
2. 식이구성
일반식이와 고지방식이의 식이구성내용은 Table 2에 나타난 바와 같이, 일반식이(Chow Diet)는 총 열량에 대해 탄수화물(68.8%, 지방12.4%, 단백질 18.8%가 되도록 구성하고, 비타민(10 g/kg Teklad vitamins mix no. 40077), 미네랄(minerals) (35 g/kg Teklad mineral mix no. 170915), 메티오닌(3 g/kg, Teklad Premier no. 10850), 첨과물(2 g/kg)을 혼합하여 사용하였다[30]. 고지방식이(Hight fat Diet)는 총 열량에 대해 탄수화물 36.2%, 지방 44.8%, 단백질 19.0%가 되도록 구성하였으며, 비타민(19 g/kg Teklad vitamins mix no. 94047), 미네랄(43 g/kg Teklad mineral mix no. 94046), 첨가물(3.0 g/kg)을 혼합하여 사용하였다[32]. 식수와 사료의 섭취는 시간과 양의 제한을 주지 않고 자유롭게 섭취할 수 있도록 하였다.
3. 운동프로그램
운동그룹은 Holloszy의 방법[33]을 부분 수정하여 적용하였는데, 전동식 실험동물용 트레드밀(Quinton Instrument, Seattle, WA)을 이용하여 주 5회, 12주간 중강도의 지구성 운동을 실시하였다. 초기 1주간은 운동프로그램의 적응을 위해 10 m/min 속도, 경사도 0°로 5분간 실시한 후 점증적으로 트레드밀 속도와 경사도, 시간을 증가시켜 2주부터는 20 m/min, 경사도 8°로 30분간 달릴 수 있도록 하였으며, 오전 9:00-12:00시 사이에 운동을 실시하였다.
4. 경구당부하검사
경구당부하검사(Oral Glucose Tolerance Test)는 정해진 양의 포도당을 체내에 주입시켜 신체의 적응능력을 측정하는 검사로서, 실험종료 3일전에 12시간 절식시킨 다음 꼬리정맥에서 채혈하여 공복 시 혈당수준을 측정한 후 75% glucose 용액(0.15 g glucose/100 g BW)을 삽관 튜브(intubation tube)로 경구 투여하고 15, 30, 60분에 채혈하여 혈당농도 변화를 확인하였다[28].
5. 조직 적출 및 혈액 채취
모든 실험동물은 12주간의 운동에 맞추어 운동이 종료되도록 하였으며, 운동처치가 종료된 시점으로부터 24시간 경과 후 지구성 운동능력 테스트를 실시하였으며, 다시 12시간 동안 휴식한 후 pentobarbital sodium (5 mg/100 g of body mass)으로 마취하여 뇌 조직 및 골격근(plantaris muscle)을 적출하였다. 적출된 뇌 조직들은 대뇌, 소뇌, 해마등의 각 부위별로 분류하였다. 조직은 분류 즉시 수술용 물림집게(clamp)를 이용하여 액화 질소를 통해 금속 냉동하여 분석 전까지 -80℃에서 보관하였다.
6. 지구성 운동능력 평가
12주간의 운동프로그램 종료 후 24시간 경과된 후 지구성 운동능력 평가를 실시하였다. 5분간 적응을 위해 10 m/min의 속도로써 실시하였으며, 이후 15 m/min, 경사도 0°에서 실시하였다. 트레드밀의 속도를 따라가지 못하는 시점에서 3회 이상 자극을 주어 반응을 하지 않거나 밖으로 나오려는 행동을 취하는 즉시 운동을 종료하였으며, 그 시간을 운동종료시점으로 기록하였다.
7. Western Blotting
RIPA 완충액(bpV 4 μL/mL, Glycerol 2-phosphate disodium salt hydrate 2 mg/mL, NaF 24 μL/mL, Protease inhibitor 404 μL/mL)을 미리 준비하고, 균질화용 튜브에 적출된 조직샘플 수만큼 RIPA 완충액을 500 μL씩 미리 분주해 두고, 미리 분자 해 둔 튜브에 조직을 넣고 얼음에 담근 채로 분쇄를 15초, 얼음에 10초, 3회 반복하여 균질화하였다. 균질화한 족저근 및 해마조직을 4℃의 온도에서 15,000 rpm로 10분간 원심분리 후 pallet은 버리고, 상층액을 Bradford (Bio-Rad)의 방법으로 단백질을 정량화 하였다. 준비된 시료는 Laemmli 완충액으로 용해시켜 SDS-polyacrylamide gel에 분주한 다음 전기영동을 실시하였고, 니트로셀룰로스 멤브레인(nitrocellulose membrane)을 이용하여 전이(transfer)하였다. 멤브레인은 5% nonfat dry milk (TBS+0.1% Tween 10; TBST, pH 7.5)로 60분간 차단(block)하였고, TBST로 세척한 다음 1차 항체 처리하여 4℃에서 overnight-incubation하였다. 1차 항체는 D1DR (SG2-D1a, Santacruz, USA), D2DR (B-10, Santa cruz, USA), Akt(361021, Novus Biologicals, USA), mTOR (H-266, Santa cruz, USA), ERK1/2 (H-266, Santa cruz, USA)로서 4% BSA와 항체를 1:200 또는 1:1,000으로 섞어서 사용하고 membrane을 1차 항체에 담궈 12-24시간 처치 후 TBST를 이용하여 10분간 3회에 걸쳐 처리하였다. 4% BSA와 2차 항체를 1:5,000으로 섞어서 60분간 2차 항체에 노출 후 배양이 끝나면 TBST로 10분간 3회 처리하였다. 멤브레인에 묻어있는 TBST를 3M paper 위에 말리고, ECL kit A와 B를 1:1로 희석하여 멤브레인 위에 골고루 뿌린 후 1분 동안 방치하여 시각화 하였다. 3M paper 위에서 다시 말리고 멤브레인을 랩(wrap)으로 싸서 카세트(cassette)에 넣고 빛에 노출되지 않도록 암실에서 작업하였다. 필름을 멤브레인 위에 놓고 카세트를 닫은 후 1분 동안 노출시킨 후 developer, dH2O, Fix, dH2O 순서대로 30초간 처리를 한 후 현상된 필름을 말려 밴드를 확인하였다.
8. 자료처리
본 연구를 위한 자료처리는 통계프로그램 SPSS 18.0을 이용하였으며, 각 그룹별 측정항목에 대한 평균 및 표준편차를 산출하고, 측정항목(신체구성, D1DR, D2DR, ERK, mTOR, Akt, 지구성 운동능력평가 등)의 결과에 대한 그룹 간의 차이를 분석하기 위하여 일원배치 분산방법(one-way ANOVA)을 실시한 후 Tukey법을 이용하여 사후검정을 실시하였으며, 모든 통계적 유의수준은 5%를 기준으로 하였다.
연구결과
1. 체중 및 신체구성
12주간의 식이 및 운동처치 후 그룹 간 체중 비교에서 고지방식이 좌업 그룹(FD)이 일반식이 좌업그룹(CD)에 비해 유의하게(p <.05) 증가하였으며, 고지방식이 운동그룹(FE)이 일반식이 운동그룹(CE)에 비해 유의하게(p <.05) 증가하였다. 그러나 식이에 따라서는 현저한 차이를 나타냈으나 동일한 식이구성그룹에서 운동실시 여부 간에는 체중 변화의 유의한 차이가 나타나지 않았다(Fig. 1).
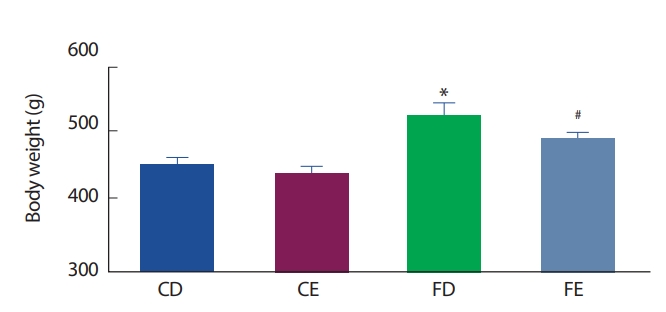
Comparisons of body weight. *Significantly different from CD (p<.05); # Significantly different from CE (p<.05).
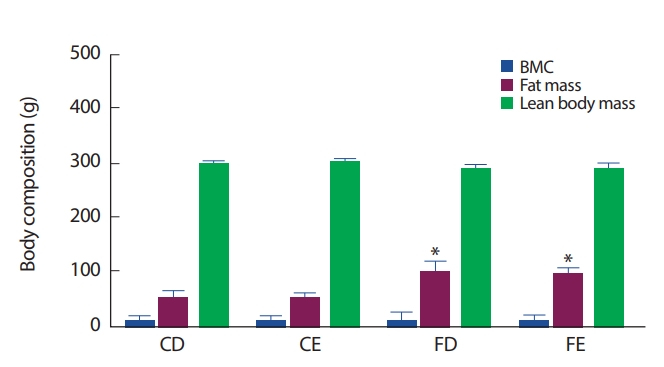
12주간 각 처치의 따른 신체구성의 변화는 FD, FE그룹이 CD그룹에 비해 총 지방 질량이 유의하게(p<.0.05) 증가하였다. 그러나 골 미네랄 함량(bone mineral contents, BMC) 및 제지방 체중(lean body mass)은 식이 및 그룹 간에는 유의한 차이를 나타내지 않았다(Fig. 2).
2. 해마의 단백질 발현
12주간의 고지방식이 및 지구성 운동처치에 따른 해마 뇌 조직에서의 D1DR 수용체의 발현은 Fig. 3과 같다. CD그룹에 비해 CE그룹이 유의하게(p <.05) 높게 나타났으며, FD그룹이 유의하게(p <.05) 낮게 나타났다. 운동을 실시한 그룹 간 비교에서는 CE그룹이 FE그룹보다(p<.05)높게 나타났으나 고지방식이 그룹 간의 비교에서는 FD그룹과 FE그룹이 유의한 차이는 나타나지 않았다. 즉 일반식이그룹에서는 운동효과가 나타났으나 고지방식이 그룹에서는 운동효과가 분명하지 않았다.
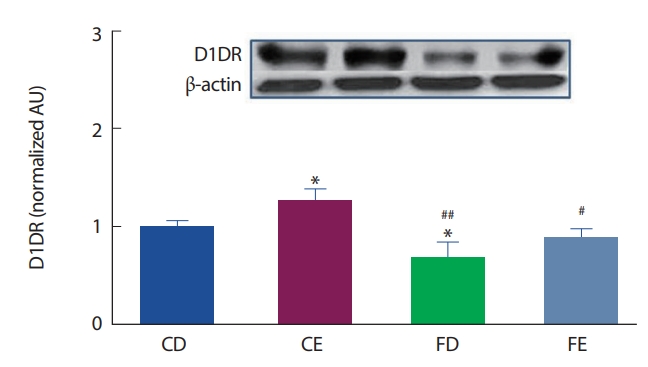
D1DR protein expression of hippocampus. *Significantly different from CD (p<.05); # Significantly different from CE (p<.05); ##Significantly different from CE (p<.01).
12주간의 고지방식이 및 지구성 운동처치에 따른 해마 뇌 조직에서의 도파민 D2DR 수용체의 발현은 Fig. 4와 같이 나타났는데, CD그룹에 비해 FD그룹에서 유의하게(p<.05) 감소되었으며, CE그룹과의 비교에서 또한 FD그룹이 유의하게(p <.05) 감소하였다. 고지방식이 그룹 간의 비교에서는 FD그룹과 FE그룹 간의 유의한 차이는 나타나지 않았다.
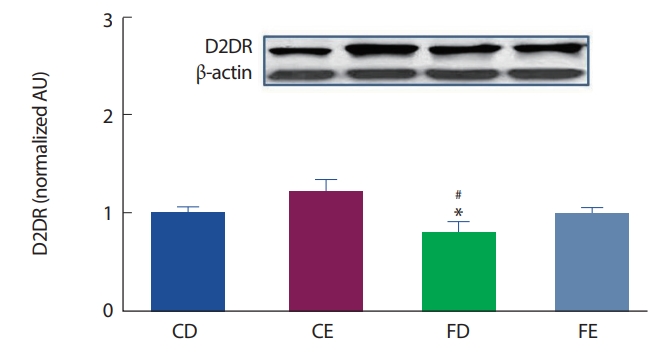
D2DR protein expression of hippocampus. *Significantly different from CD (p<.05); # Significantly different from CE (p<.05).
12주간의 고지방식이 및 지구성 운동처치에 따른 해마 뇌 조직에서의 ERK 1/2 발현은 Fig. 5와 같이, CD그룹에 비해 FD그룹에서 유의하게(p<.05) 감소한 것으로 나타났으며, CE그룹과의 비교에서는 FD그룹에서 유의하게(p<.05) 감소한 것으로 나타났다.
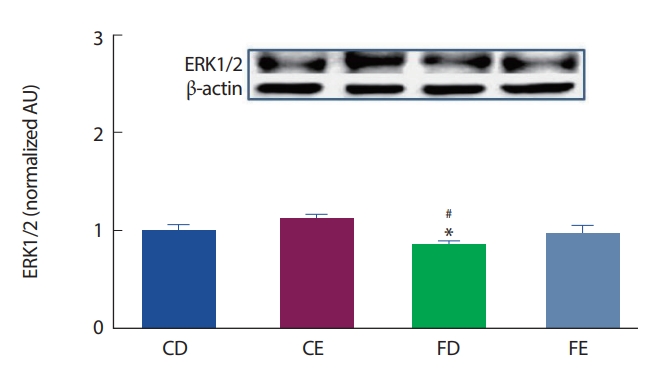
ERK1/2 protein expression of hippocampus. *Significantly different from CD (p<.05). # Significantly different from CE (p<.05).
12주간의 고지방식이 및 지구성 운동처치에 따른 해마 뇌 조직에서의 Akt 발현은 Fig. 6과 같이 CD그룹에 비해 CE그룹이 유의하게(p <.05) 높게 나타났으며, FD그룹이 CE그룹에 비해 유의하게(p <.01)낮게 나타났다.
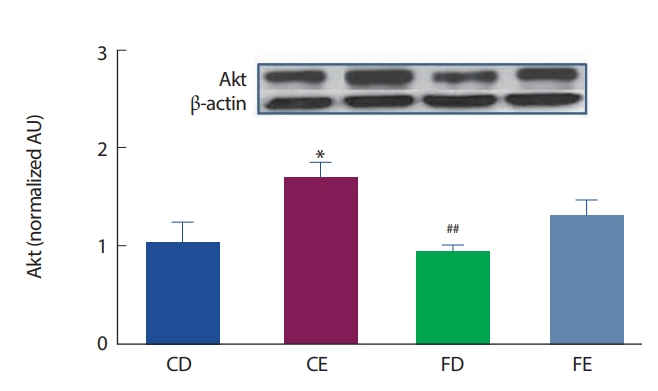
Akt protein expression of hippocampus. *Significantly different from CD (p<.05). ##Significantly different from CE (p<.01).
12주간의 고지방식이 및 지구성 운동처치에 따른 해마 뇌 조직에서의 mTOR 발현은 Fig 7과 같이 CD그룹에 비해 CE그룹에서 유의하게(p<.05) 높게 나타났으며, FD그룹에서 CE그룹보다 유의하게(p<.01) 감소하였다. 그러나 FE그룹은 CD그룹과 유의한 차이는 나타나지 않았다.
3. 지구성 운동능력의 변화
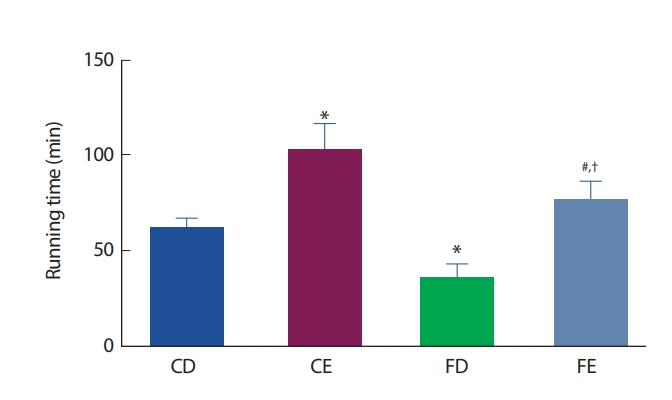
12주간의 처치 후 그룹 간 지구성 운동능력의 비교에서 CD그룹에 비해 CE그룹은 유의하게(p <.05) 증가한 반면, FD그룹에서는 감소한 것으로 나타났다(p<.05). 운동그룹 간 비교에서는 FE그룹이 CE그룹보다 유의하게(p <.05) 낮게 나타났으며, FD그룹보다는 유의하게(p <.05)높게 나타났다(Fig. 8).
논 의
뇌에서 발현되는 도파민은 뇌 신경회로 신경전달물질로서 매우 중요한 위치를 차지하며 정신적, 심리적 측면과 인지 및 운동기능에 있어 다양하게 관여하는 것으로 알려져 있다. 이에 연구는 10주령의 흰쥐를 대상으로 12주간 고지방식이를 이용한 비만유도와 함께 규칙적인 지구성 운동을 처치하여 신체 구성의 변화 및 흰쥐의 해마에서 발현되는 도파민 D1DR, D2DR 수용체의 변화를 확인하였으며, 또한 도파민 수용체와 관련 있는 하위 요인들의 변화를 분석하였다.
본 연구에서 고지방식이를 섭취한 그룹은 좌업그룹과 운동을 실시한 그룹의 두 그룹 모두에서 체중과 체지방의 증가를 나타냈다. 고지방식이 섭취에 의한 체중과 체지방 증가는 인슐린저항성에 부정적인 영향을 미치면서 비만의 가장 중요한 원인으로 간주되고 있다[32]. 이러한 비만처치를 위한 효과적인 운동프로그램은 걷기, 달리기와 같은 유산소운동을 통해서 체지방 감소 및 지방대사의 개선효과와 더불어 수축기 혈압의 감소, 최대산소섭취량(VO2max)의 증가 등 심혈관계요인을 개선시키는 대표적인 방법에 해당한다[34]. 또한 장기간의 유산소 운동은 체중 및 혈중 지질농도의 감소, HDL-C 농도의 현저한 증가뿐만 아니라, 대사적 특성을 정상인 수준으로 회복시킬 수 있으며 부교감신경계의 활성화 및 교감신경계의 억제 영향을 미치는 것으로 알려져 있다[35,36]. 체중변화의 경우 운동을 실시한 그룹에서 체중이 감소하는 경향을 나타냈으나 유의한 영향을 미치지 못하면서 고지방식이 섭취가 체중증가에 더욱 크게 영향을 미치는 것으로 나타났다. 이러한 결과는 운동수행에 의한 유의한 체중감소를 나타낸 선행연구들[37,38]과 상반된 결과에 해당하는데, 본 연구에서 실시한 식이처치는 12주간 지속적인 고지방식이 및 운동을 병행하여 처치하였으며 또한 식이섭취량을 제한하지 않으면서 운동에 의한 에너지소비의 효과가 상대적으로 크게 나타나지 않은 것으로 생각된다. 이는 비만은 고열량의 섭취를 통해 유발되며[32] 일반식이와 비교하여 지방이 35% 많이 포함된 고지방식이를 같은 열량으로 섭취하도록 처치한 결과에서 중강도의 지구성 운동(4주, 주 5회, 2 hr, 23 m/min)에도 불구하고 체중과 체지방량에 영향을 주지 않을 수 있다[39]는 관점에서 본 연구를 통해서 고지방식이를 통해 비만을 유도하며 중강도의 운동을 실시하였더라도 일반식이 그룹과 비교하여 보다 많은 열량을 섭취하였을 경우 운동그룹에서 체중 및 체지방량의 감소에 영향을 미치지 못한 것으로 생각할 수 있다. 저강도의 유산소운동은 체중감소에 다소 미흡할 수 있다는 Bedford, Tipton, Wilson, Oppliger와 Gisolfi [40]의 결과를 살펴보면, 비만그룹을 대상으로 운동강도에 따른 체중변화를 확인한 연구에서 고강도운동(26.8 m/min)을 처치한 그룹에서만 체중에 대해 유의한 감소가 나타났으며, 저강도(15.2 m/min) 및 중강도(19.3 m/min) 운동에서는 운동에 따른 체중감소는 나타나지 않았다고 보고하였다[41]. 즉 비만에 따른 체중감소 효과를 확인하기 위한 지구성 운동의 강도 설정 시 중강도 이상 고강도의 운동강도가 적절한 방법이 될 것이다.
뇌에서 발현되는 도파민은 도파민 수용체와 결합하여 표적활동을 통해 뇌의 각 역할에 맞는 기능을 수행할 수 있도록 신호를 전달한다. D1DR 수용체는 흰쥐의 뇌에서 가장 많이 발현되는 도파민 수용체로 알려져 있다[42]. 본 연구에서 12주간의 고지방식이에 따른 비만은 CD그룹에 비해 FD그룹에서 D1DR 수용체의 발현이 유의하게 감소하였으며(p <.05), 운동그룹 간의 비교에서도 FE그룹이 CE그룹에 비해 유의하게(p <.05) 감소한 것으로 나타났다. 이러한 결과는 비만이 D1DR 수용체의 결핍과 관련이 있으며, 비만발생 및 처치과정에서 나타나는 활성화의 저하와 비자발적인 운동수행에 의한 영향이 D1DR 수용체의 발현저하와 관련성이 있다고 볼 수 있다[43]. 또한 FD그룹에서 CD그룹에 비해 D1DR 수용체의 하위인자인 ERK (p <.05)의 감소가 나타났다. 이는 비만에 따른 D1DR 수용체의 저하로 인하여 Adenylyl Cyclase(AC)-cAMP 활성을 차단시켜 여러 작용기 및 활성전사인자인 PKA의 비활성을 유도하고 하위신호체계의 DARPP-32, ERK1/2에 이르는 연결을 차단하여 나타난 결과로 간주된다[44].
D2DR 수용체는 D1DR 수용체와 상반된 작용을 하여 D2DR수용체가 활성화되면 cAMP가 줄어들게 되며, D2DR 수용체는 자가수용체(autoreceptor) 기능을 하여 뉴런의 활동을 억제(tonic down regulation)하는 역할을 주로 담당한다[45]. 그러나 본 연구 결과, D2DR 수용체는 CD그룹에 비해 FD그룹이 유의하게 낮게 나타났다(p<.05). 도파민 활동성증가는 식욕, 술, 담배 등과 같은 중독성 매개체와 정적 연관성을 갖고 있으며[46,47], 또한 칼로리 섭취에 따른 급격한 혈당의 증가는 도파민 D2DR 수용체를 30-40% 감소시켰으며[48,49], 지방조직과 상호작용을 통해 에너지섭취에 대한 욕구(보상)를 강화하는 작용이 발생한다고 하였다[50,51]. 임상연구에서 Wang et al. [52]은 비만인을 대상으로 D2DR 수용체의 밀도를 확인한 결과 일반인에 비해 비만인 그룹에서 D2DR 수용체의 밀도가 유의하게 감소하는 것을 보고하였다. 어떤 자극으로 인해 도파민의 활동성이 증가되면 보상욕구로 인한 중독 행동에 의해서 D2DR의 감소를 나타낸다고 볼 수 있다. 즉 초기자극에 의한 D2DR은 cAMP의 발현을 차단하며 에너지 시스템 및 신경전달 회로에 있어 불안정성을 유도할 뿐만 아니라, 세포성장 및 사멸에 부정적 영향을 주어 비만, 불안, 주의력 부족, 인지능력 감소 등이 증상들을 유발한다[53]. 이에 본 연구에서 고지방식이로 유발된 비만으로 인해 해마의 신경세포 말단 및 세포 내 D2DR의 발현이 감소한 것으로 생각되며, 고지방식이 처치에 따른 도파민 수용체와 cAMP-Akt-mTOR의 신호 경로에서 확인하고자 하였던 Akt, mTOR의 변화는 나타나지 않았다.
장시간의 지구성 운동은 체중감소와 도파민 활성을 유도하여 운동을 오랫동안 지속하고자 하는 심리적 각성상태를 유지함과 동시에 정신적 심리적 안정을 유도한다고 하였다[23]. 본 연구에서도 12주간의 지구성 운동의 결과 D1DR 수용체는 CD그룹에 비해 CE그룹에서 증가하였다(p<.05). 그러나 비만그룹에서는 운동에 따른 유의한 변화는 나타나지 않았다. 운동 후 CE그룹에서의 D1DR의 증가는 지구성 운동에 따른 인슐린 감수성의 증가로 단백질 합성이 활성화됨에 따라 시냅스 가소성 및 세포 활동에 영향을 주는 mTOR 및 Akt 인자의 발현에 영향을 주었을 것으로 생각된다. Gong et al. [54]은 지구성 운동이 도파민 생합성 속도조절 효소인 tyrosine hydroxylase (TH)의 증가와 밀접한 관련이 있음을 주장하였으며, 이로 인한 세포의 신경학적 변화를 지연 및 완화시키는데 지구성 운동의 긍정적인 효과에 대해서도 보고된 바 있다[55]. 즉, 규칙적인 운동이 해마의 중요한 학습 및 인지기능과 관련된 역할을 수행함에 있어 반드시 동원되어야 하는 신경세포의 발생과 발달에 직접적인 영향을 주는 도파민 D1DR 및 mTOR 및 Akt인자의 향상을 확인하였으며, 이를 통해 세포사멸과 신경가소성의 증가를 유도할 것으로 생각한다. 그러나 D2DR 수용체는 CD그룹과 CE그룹과의 비교에서 유의한 차이가 나타나지 않았으며, 식이 및 운동그룹의 비교에서도 차이가 나타나지 않았다. 이러한 결과는 D2DR 수용체의 발현의 특성과 관련지어 볼 수 있는데, D2DR의 감소가 신체활동의 유무와는 현저한 관련성이 없으나 비만상태에서는 신경세포 내 D2DR 수용체의 감소로 이어지며 신체활동성의 억제에 영향을 미칠 수 있을 것으로 간주된다. 따라서 비만상태에서의 D2DR 수용체 억제 현상은 의도적인 활동성 강화와 운동자극에도 불구하고 비만처치의 어려움이 발생하는 중요한 원인이 될 수 있을 것이다[56]. 비만은 D1DR 및 D2DR의 상대적 활성도가 평형상태 유지가 깨지면서 발생할 가능성이 높으며, 특히 D2DR의 활성도가 저하될수록 비만의 발생 가능성인 높고 약물 혹은 알코올 등에 대한 욕구가 높아질 수 있는데[57], 운동은 상대적으로 저하된 D2DR의 활성도를 높여주면서 약물 섭취 욕구를 조절할 수 있다고 주장하였다[58]. 따라서 비만처치와 관련하여 운동프로그램의 적용이 D1DR 및 D2DR의 상대적 활성도를 평형상태로 유지하는데 도움을 줄 수 있을 것으로 기대된다[58]는 관점에서 본 연구에서 D1DR 및 D2DR의 상대적 활성도가 운동 효과를 명확하게 확인하지 못한 것은 아쉬운 결과이며, 운동프로그램을 포함한 전체적인 연구방법 상의 세부적인 보완을 통한 계속적인 연구가 요구된다.
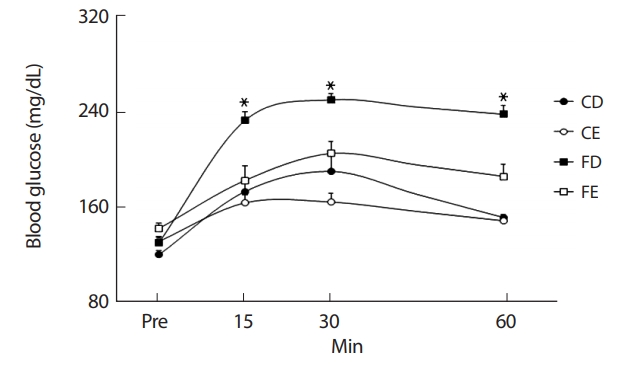
비만상태에서 흔히 발생하는 글루코스 및 지질대사의 정상적인 반응이 저하된 상태를 일컫는 인슐린저항성은 근육이나 간에 지방축적이 발생하여 대사성질환의 유병률을 현저히 증가시키게 된다[59]. 특히 아동비만에 의한 인슐린저항성 증가는 2형 당뇨병이나 심혈관질환의 유병률을 증가시키는 위험요소로서 비만해소를 위한 해결책이 절실하다. 많은 연구자들이 아동비만을 해소하기 위한 가장 효과적인 방법으로 규칙적인 운동프로그램의 적용을 제시하였다[60,61]. 또한 Pollock et al. [62]은 당대사 및 인슐린 감수성의 개선에 유산소성운동이 가장 적절하다 보고하였다. 또 다른 연구에서는 비만아동에게 유산소 운동과 무산소운동을 복합적으로 적용한 후 신체구성 및 인슐린감수성에 대한의 긍정적인 효과와 더불어 심폐지구력을 비롯한 체력향상을 나타냄으로서 운동프로그램의 중요성을 강조하였다[63]. 본 연구에서 12주간의 지구성 운동을 처치한 후 CE그룹이 운동을 실시하지 않은 CD, FD그룹보다 지구성 운동 수행능력이 유의한(p<.05) 증가를 나타냈다. 또한 경구당부하검사를 통해 혈당농도를 비교한 결과 비만그룹(FD)에 비해 운동그룹(CE, FE)에서 글루코스의 양이 유의하게(p <.05) 감소하였다. 이는 지구성 운동에 의해 혈당의 근세포 투과성이 증가되어 근육 내 글루코스의 이용이 활성화됨으로서 유산소성운동을 통한 인슐린의 기능이 향상되었음을 나타낸다[63]. 본 연구에서 신체구성의 제지방량의 비교에서는 그룹 간 차이는 나타나지 않았으나 운동능력 비교와 혈중 글루코스 농도의 비교를 통해 지구성 운동을 통한 지구성 운동능력의 향상이 비만으로 인한 세포 내 글루코스 및 지질대사의 반응을 긍정적으로 유도하였을 것으로 생각한다.
이상의 결과를 종합하면 본 연구의 고지방식이는 10주령의 흰쥐의 비만을 유발시킴으로써 해마에서 발현되는 D1DR, D2DR 단백질의 농도를 감소시켰으나, 12주간의 중강도 지구성 운동은 일반식이 그룹에서 D1DR 단백질 발현에는 긍정적인 영향을 미쳤다. 더불어 지구성 운동능력의 향상과 함께 인슐린감수성에 긍정적인 영향을 미치는 것으로 나타났다. 그러나 고지방식이 그룹에서는 지구성 운동이 D1DR, D2DR 단백질 발현에는 현저한 영향을 미치지 못하는 것으로 나타났다. 이는 식습관 및 생활방식에 의한 신경전달물질의 기능장애로 인한 비만상태에서는 중강도의 지구성 운동은 체중감소 및 D1DR, D2DR 단백질에 대한 긍정적인 효과를 나타낼 가능성이 낮다는 것을 알 수 있으며, 보다 높은 운동강도와 많은 운동량의 적용이 요구된다고 생각된다. Skleryk et al. [64]은 비만인의 체중감소를 포함한 신체구성의 효과가 명확하지 않을 경우 대사기능의 변화가 분명하지 못할 수 있다는 지적을 고려할 때 특히 본 연구에서 고지방식이를 실시하여 비만을 유도한 상태에서 운동을 적용한 경우 신체구성을 포함한 도파민 수용체 및 그 하위변인에서 운동효과가 명확하게 차이를 나타내지 않음으로서 운동량을 더욱 증가시켜서 보다 분명한 신체구성의 변화가 나타날 경우에 대한 추가적인 분석이 요구되며, 운동수행방법 및 동물실험과정의 오류에 대한 명확한 검토가 요구된다고 생각된다.
결 론
12주간 실시한 고지방식이에 의해서 비만이 유도된 10주령의 흰쥐는 해마의 D1DR, D2DR 발현이 감소하는 것으로 나타났으며, 12주간의 중강도 지구성 운동 후 해마의 D1DR, D2DR 수용체의 저하를 개선하는데 영향을 미치지 못했다 그러나 일반식이를 섭취한 경우에는 지구성 운동 후 해마의 D1DR 수용체의 증가를 나타냈다. 또한 12주간 중강도 지구성 운동은 지구성 운동능력 향상과 글루코스 반응성에 대해 긍정적인 영향을 나타냈다. 즉 비만하지 않은 경우의 중강도 지구성 운동은 해마에서 D1DR와 Akt, mTOR 단백질의 발현을 증가시켜 신경세포의 증식과 생존에 긍정적인 영향을 미친다고 볼 수 있다.
이상의 결과를 통해서 장기간의 지구성 운동은 뇌 해마 조직의 도파민 수용체의 발현에 긍정적인 역할을 하는 반면, 고지방식이 섭취는 도파민 수용체의 발현에 부정적 요인으로서 작용 할 것으로 생각된다. 그러나 고지방식이섭취에 의한 비만 발생 후의 중강도 지구성 운동은 도파민 수용체의 발현에 유의한 영향을 미치지 못하는 것으로 나타남으로서 운동강도 및 운동량에 대한 세부적인 검토가 요구된다고 생각된다.
Notes
이 논문 작성에 있어서 어떠한 조직으로부터 재정을 포함한 일체의 지원을 받지 않았으며, 논문에 영향을 미칠 수 있는 어떠한 관계도 없음을 밝힌다.
AUTHOR CONTRIBUTION
Conceptualization: K Kim, Data curation: S Kim, Formal analysis: S Kim, K Kim, Funding acquisition: K Kim, Methodology: S Kim, Project administration: K Kim, Visualization: S Kim, Writing - original draft: S Kim, Writing - review & editing: K Kim.