지구성 운동과 MitoQ 섭취가 Alcl3로 유도된 알츠하이머 질환 동물 모델의 Tau 과인산화, 산화스트레스, 항산화 조절 요인, 미토콘드리아 기능 및 인지기능에 미치는 영향
Effect of Endurance Exercise and MitoQ Intake on Tau Hyperphosphorylation, Oxidative Stress, Antioxidant Modulating Factors, Mitochondrial Function, and Cognitive Function in Alcl3-Induced Alzheimer's Disease Animal Model
Article information
Abstract
PURPOSE
This study aimed to investigate the effect of 8 weeks of endurance exercise and MitoQ intake on tau hyperphosphorylation, oxidative stress, antioxidant modulating factors, mitochondrial function, and cognitive function in an AlCl3-induced Alzheimer's disease animal model.
METHODS
For the experimental animals, 40 mg/kg of aluminum chloride (AlCl3) was diluted with physiological saline for 60 days and intraperitoneally injected to create an Alzheimer's disease animal model. In addition, endurance exercise was performed at a speed of 12 m/min using a treadmill for laboratory animals for 8 weeks, and MitoQ was applied with a 100 μm concentration of negative water. The rats were randomly divided into five groups: a saline control group (NC, n=6), an AlCl3 injection group (AC, n=6), an AlCl3 injection and treadmill exercise group (AE, n=6), an AlCl3 injection and MitoQ group (AM, n=6), and an AlCl3 injection and treadmill exercise and MitoQ intake group (AEM, n=6). The SPSS program was used for statistical analyses. Differences between the groups in each variable were analyzed using the one-way ANOVA.
RESULTS
Endurance exercise and MitoQ intake for 8 weeks showed positive results in cognitive function and decreased tau hyper-phosphorylation in the animal model with Alzheimer's disease. In addition, they reduced oxidative stress (4-HNE, MDA) and had a positive effect on antioxidant indicators (catalase, SOD-1, SOD-2). Finally, they exhibited a positive effect on factors related to mitochondrial function (PGC-1, Tfam).
CONCLUSIONS
Eight weeks of endurance exercise and MitoQ intake are thought to have a positive effect in alleviating Alzheimer's disease in terms of improving cognitive function through AlCl3 accumulation, tau hyperphosphorylation, oxidative stress, antioxidant modulating factors, and mitochondrial function.
서 론
알츠하이머 질환(Alzheimer's disease)은 65세 이상 노년층 인구 중 10.16%의 높은 유병률을 나타내고 있으며, 발병 원인이 명확히 밝혀지지 않았지만, 유전적 요인, 연령, 두부외상, 알루미늄 노출 등이 있다[1,2]. 알루미늄은 최근 환경 문제로 증가한 미세먼지 등에 섞여 있는 금속 이온으로 인체 내 과도한 축적이 알츠하이머 질환을 포함한 신경퇴행성 질환과 밀접한 연관성을 보고하고 있다[3].
알루미늄은 알츠하이머 질환의 주요 병변이 발생하는 대뇌피질(Cortex)과 해마(Hippocampus)에 축적되며, 이는 인지기능 손상을 유발하고 아밀로이드 단백질(Amyloid-β, Aβ)의 생성 및 응집을 촉진시켜 노인성 반점 형성을 증가시킨다[4–6]. 또한, 미토콘드리아의 기능 손상을 야기하며[7], 산화적 불균형의 원인이 되는 활성산소종(Reactive Oxygen species, ROS)을 증가시키고, 조직에 산화스트레스를 유발하여 에너지대사 결함, 염증반응과 같은 뇌신경계 항상성 조절 시스템에 장애를 유발한다[8]. 또한, 뇌 조직의 활성산소종 및 산화스트레스의 증가는 뇌세포에서 미세소관(Microtubule)을 이루고 있는 타우(Tau) 단백질의 인산화(Phosphorus)를 야기하고, 미세소관의 구조는 깨지게 되며, 깨진 미세소관의 축적은 알츠하이머 질환의 주 병리학적 특징 중 하나인 타우의 과인산화를 야기한다[9].
정상적인 상태에서의 타우 단백질은 인산화와 탈 인산화의 평형을 유지하는 반면, 비정상적인 상태에서는 미세소관에서 분리되고 잘못된 구조의 이중 나선 섬유(paired helical filaments, PHFs)를 형성하여 세포내 신경섬유원 형태로 축적된다[10,11]. 타우의 과인산화는 미토콘드리아(Mitochondria)의 아데노신삼인산(adenosine triphosphate, ATP) 생성을 저하시키고, 신경세포의 보호에 악영향을 끼친다[12]. 또한, 미토콘드리아 기능 장애 또한 알츠하이머에서 타우의 과인산화를 촉진하는데 관여함을 보고하였다[13]. 미토콘드리아 기능 악화는 아데노신삼인산 부족으로 인한 인지기능 감소를 유발시킨다고 보고하고 있지만[14], 아직까지 타우 과인산화가 미토콘드리아 기능에 어떻게 악영향을 끼치는지에 대한 기전들은 밝혀지지 않았고, 이를 해결하기 위한 연구가 미흡한 실정이다.
지구성 운동(Endurance exercise)은 알츠하이머와 같은 퇴행성 질환의 치료에 있어서 긍정적인 피드백을 주며, 산화스트레스 감소에도 효과가 있다[15–17]. 알츠하이머 질환의 특징을 나타내는 뇌에 대한 유산소성 운동의 효과를 증명한 선행 연구에 따르면 지구성 운동은 신경세포의 생존과 신경가소성 조절에 긍정적인 피드백을 통해 아밀로이드 단백질의 축적과 타우 단백질의 인산화와 같은 주요 병변의 완화 및 인지기능 개선을 유도한다고 보고하였다[18]. 또한 적절한 강도의 지구성 운동은 항산화 기능을 개선하고, 체내 활성산소종과 산화스트레스를 줄이는데 효과적인 것으로 보고되고 있다[18,19].
항산화제 섭취로 인한 항산화 기능 개선은 산화적 불균형을 나타내는 알츠하이머 병변의 진전을 완하하여 뇌 신경계의 퇴행적 변화에 중요한 역할을 한다[20]. 하지만 많은 항산화제가 실질적으로 활성산소종의 주 생성기관인 미토콘드리아에 직접적으로 작용하지 못하며, 수용성제의 경우 대부분 뇨(Urine)으로 배출되어 효율성이 떨어지기 때문에 더 효과적인 항산화제의 규명과 도입이 요구된다[20].
다양한 항산화제 중 미토콘드리아에 직접적으로 관여하는 항산화제인 Mitoquinone mesylate (MitoQ)는 Coenzyme Q10 (CoQ10)의 유비퀴논(Ubiquinone) 부분과 양의 트리페닐포스포늄(Triphenylphos-phoniumL, TPP)가 공유 결합한 상태로 미토콘드리아 표적항산화제로 혈액-뇌 장벽(Blood-drain barrier, BBB)과 신경 세포막을 지나고 미토콘드리아 막을 통과하여 다른 항산화 물질보다 효율적으로 미토콘드리아를 보호하게 된다[21]. 그러므로 MitoQ의 섭취는 산화 불균형의 개선에 도움을 주고 알츠하이머 질환의 뇌 신경계 퇴행적 변화를 완화시키는 신경보호 효과를 유도하며 인지기능을 개선시키는데 있어서 좋은 대안점이 될 수 있다.
하지만 아직까지 타우의 과인산화에 대한 MitoQ의 적용이 어떠한 기전으로 작용하는지 밝혀진 것이 없고, 지구성 운동이 어떤 기전으로 작용하는지 또한 명확하게 알려진 것이 없다. 그러므로 본 연구는 염화 알루미늄(Aluminum Chloride, AlCl3)으로 유도된 알츠하이머 질환동물을 대상으로 하여 지구성 운동과 MitoQ의 적용이 타우의 과인산화, 산화스트레스, 항산화조절요인, 미토콘드리아 기능 관련 요인 및 인지기능을 규명하는데 목적이 있다.
연구 방법
1. 실험동물
K대학교 동물실험윤리위원회의 승인(KNSU-IACUC-2020-2)을 거쳐 반입된 C57BL/6N 7주령 모델(n=30)을 구입하여 실시하였으며, 동물시설 환경기준에 따라 명암주기를 12시간(light-dark cycle)으로 설정했고, 온도는 22±2°C, 습도는 50±5%의 환경 유지 조건을 갖춘 K대학교 동물 시험실에서 사육했다. 초기 실험 환경 적응을 위해 예비 사육기간을 거친 후 실험동물을 그룹화를 실시했으며, 식이의 경우 먹이는 제한을 두지 않지만, 식수는 50 mL Falcon tube를 이용하여 이틀에 한번씩 교체하였다.
2. 알츠하이머 질환 마우스 모델
본 연구는 염화 알루미늄(AlCl3)을 복강주사(Intraperitoneal injection, I.p.)하여 알츠하이머 질환을 유도하였다. 실험동물 집단은 무작위 표본 추출에 의해 설정하였으며, 처치 전 실험동물의 무게를 측정했을 때 체중이 평균에서 과도하게 벗어날 경우 실험동물에서 제외하였다. AlCl3처치는 Saba et al. [22]과 Shati et al. [23]이 제시한 방법을 참고하여 8주간 40 mg/kg의 농도로 Normal Saline (NS)에 희석된 용액을 복강 주사하였으며, 4일에 한 번씩 제조하여 투여하였다. 실험동물은 총 30마리로 Saline conrtol group (NC, n=6), AlCl3 intraperitoneal injection group (AC, n=6), AlCl3 intraperitoneal injection+MitoQ ingestion group (AM, n=6), AlCl3 intraperitoneal injection+Exercise group (AE, n=6), AlCl3 intraperitoneal injection+Exercise+MitoQ ingestion group (AEM, n=6)으로 분류하였다.
3. 운동방법
본 연구는 염화 알루미늄을 복강주사를 통해 알츠하이머 질환을 유도한 C57BL/6 마우스 모델을 대상으로 Rodent 트레드밀(8Lanes, Daemyung Scientific Co., Ltd, Korea)을 사용하여 1주간 사전 적응훈련을 실시하였다. 사전적응 훈련이 마친 후, 본 운동은 Okamoto et al. [24] 과 Koo et al. [17]이 제시한 운동방법을 참고 및 수정하여 8주간 50 min/day로 주 5일을 실시했다. 운동은 오후 6시 이후에 실시했으며, 운동 수행중의 스트레스를 줄이기 위해 전기적 자극 등 가학적인 자극은 주지 않았다. 적용한 운동 프로그램은 다음과 같다(Table 1).
4. MitoQ 섭취 방법
MitoQ는 『 MRC Mitochondria Biology Unit, Cambridge, UK』 프로그램 리더인 Dr. Mike Murphy를 통해 제공받은 제품을 사용했으며, MitoQ group과 Complex group의 섭취방법 및 농도설정은 Rodriguez-Cuenca et al. [25]의 연구를 참고하여 8주간 농도가 100 μm인 음수를 적용하였다.
5. Water maze test (WMT)
AlCl3 처치로 유발된 알츠하이머 질환 마우스 모델에서 나타나는 인지적 능력 변화를 확인하기 위해 수중미로검사(WMT)를 실시하였다. 수중미로검사는 원형수조(지름 1.5 m×높이 50 cm)를 사분면으로 나눴을 때 표적(target, 지름 12 cm)의 한 분면의 수면 1 cm 아래 지점에 위치하도록 수조바닥에 설치하며, 동서남북 각 지점별로 90°씩 나눠서 다른 모양의 마크를 설치하였다. 22-25°C의 물을 받아 넣은 후 전지분유를 물에 용해시켜 표적이 보이지 않도록 했으며, 촬영은 수조 위 천장에 부착된 카메라를 통해 실험동물이 1분 동안 표적을 지나간 횟수, South-West 지점에 머무는 시간(sec)을 1분간 측정하여 컴퓨터와 연결하여 연동된 프로그램인 SMART 3.0 (Panlab, spain)을 이용하여 집단 간 차이를 분석하였다. 검사는 각 2회씩 실시했다. C57BL/6 모델은 모두 같은 지점에서 출발하여 목표에 도착할 수 있게끔 하였으며, 1분간 동물모델이 표적에 도달하지 못한다면 목표로 유도하여 위치를 인식을 시켜줬다. 마지막 5일째에 실시하는 본 테스트의 경우, 표적을 제거한 후 동일한 출발지점에서 시작해서 1분 동안 표적을 지나간 횟수의 결과 값을 실험데이터로 적용하였다.
6. Nest building test
Nest building test는 Orat-Salazar et al. [26], Deacon [27]이 제시한 방법을 근거로 하여 실시하였다. 검사 방법은 정사각형 모양의 Nestlet (5×5 cm, Ancare, USA)을 각 개별 케이지에 넣고 12시간 후에 결과를 분석했으며, Nestlet은 모두 동일하게 4.0 g씩, 어두운 단계 1시간 전에 각 케이지로 배분했다. 다음날 아침 8시에 모든 마우스의 Nestling을 평가했으며, 평가기준은 둥지 형성정도에 따라 1점부터 5점까지의 주관적 점수 평가와 형성된 Nest의 무게(g)을 측정하는 객관적 평가를 같이 진행하였다. 주관적 Nest rating scale은 다음과 같다(Table 2).
7. 조직 적출 및 고정
8주간의 실험이 모두 종료되고 Ketamine50 (Yuhan, Korea)과 Rum-pun (Bayer, Korea)이 7:3 비율로 혼합된 마취약을 마우스의 복강에 주사하여 뇌 조직을 적출하여 뇌 조직의 반은 western blot 분석을 위해 해마(Hippocampal)를 분리하여 액화질소에 동결시켜 분석 전까지 –80°C 초저온냉동기(Deep freezer, SANYO, Japan)에 냉동 보관하였다. 또한, 뇌 조직의 반은 4% paraformaldehyde (PFA) 혼합액에 보관하여 고정시켰다. 고정된 조직은 5일 동안 30% sucrose 용액에 침전시킨 후동결용 박절기(Freezing micortome, Leica, Nussloch, Germany)를 이용하여 35 µm 두께로 절편하여 저장 용액에 저장했다.
8. Western blot analysis (WB)
적출된 해마(Hippocampal) 조직을 정량하여 균일화시킨 뒤, 원심분리기를 통해 상층부의 액을 따로 처리하여 실험에 사용할 sample을 준비하였다. 분자량에 따라 10%와 12%의 SDS-PAGE에 동량 분주하여 60 volt에서 전기영동을 실시하였고, 90분 동안 단백질을 MeOH에 적신 0.45 PVDF membrane으로 전사시켰다. 이후 rocket platform 위에서 60분 동안 membrane을 3% BSA (TBS-T: 10 mM tris-base; pH 8.0, 150 mM NaCl, 0.05% Tween-20)로 Blocking을 시키고 1차 항체를 반응시키고 상온에서 2시간 동안 2차 항체와 반응시킨 뒤 Luminate Forte West-etn HRP Substrate (Milipore, USA)에 2분간 발색시켜 나온 membrane 을 이미지 분석 시스템(Molecular Imager ChemiDoc XRS System, Bio-Rad, USA)을 이용하여 분석했다. 본 실험에서 사용한 1차 항체는 Table 3과 같다.
9. Immunohistochemistry (IHC)
자유 부유법을 이용했으며 집단별 10장씩 조직을 선택 한 후, PBS에 세척을 3회 실시했다. 세척된 조직들은 0.01 M Sodium Citrate 적셔 30분간 37°C에서 Incubating을 적용한 뒤, 60분 동안 10% Normal Don-key Serum (0.3X triton Base)으로 Blocking을 실시하였다. 이 후 1차 항체를 24시간 동안 4°C에서 반응시키고 실온에서 2시간 동안 Biotinyl-ated secondary antibody에 반응 시킨 뒤, 이후 30분 동안 Vectastain-Elite ABC kit 용액으로 상온에서 incubating을 실시한 뒤 DAB Peroxi-dase Substrate kit를 사용하여 3분 동안 발색시켰으며 PBS로 세척 후 발색되어 염색된 뇌 조직을 광학현미경(DM-2500, Leica Microsystems, Germany)을 이용하여 분석했다.
10. Enzyme-linked immunosorbent assay (ELISA)
지질산화를 측정하기 위해서 Lipd Peroxidation (MDA) Assay Kit (MAK085, SIGMA-ALDRICH)를 이용했으며, 집단 당, 1 mL의 혈장 샘플을 사용했다. 각 혈장에 TBA-soultiond을 600 μm 분주하고, CO2 Chamber에 1시간 동안 발현 시킨 뒤, TBA-soultiond와 혼합된 혈장을 Pipet을 이용하여 상층 부분만 따로 분리했다. 분리한 용액을 0.2 μm의 필터를 이용하여 걸러냈고 분리된 용액에 1-butanol 300 μL와 5 M NaCl 100 μL를 vortex를 이용하여 혼합한 뒤, 실온에서 3분 동안 16,000×g 속도로 원심 분리하였다. 이후 상층 용액을 다시 Pipet을 이용하여 분리하고 남아있는 1-butanol을 제거하기 위해 55°C로 용액을 가열했다. 가열된 용액을 충분히 식힌 뒤, 200 μL의 용액과 200 μL의 D.W를 혼합하고 96 well cell plate에 분주하여 HIDEX를 통해 지질 산화도를 측정하였다.
11. 자료처리방법
연구와 실험을 통해서 나온 모든 자료는 Window용 SPSS (ver.25) 통계프로그램을 통해 기술 통계치(mean±SD)를 산출했다. 일원변량분석(one way ANOVA)을 이용하여 각 변인에 대한 집단 간 차이를 분석했으며, 집단 간 유의한 차이가 있을 경우 Bonferroni 방법을 사용하여 사후 검증을 실시하였다. 이때 통계적 유의수준은 α=.05로 설정했다.
연구 결과
1. 집단 간 행동기능의 변화
AlCl3 처치로 유도한 알츠하이머 실험동물을 대상으로 8주간 지구성 운동 및 MitoQ 적용 후 인지 및 행동 기능의 결과는 다음과 같다(Fig. 1). 먼저 수중미로검사를 실시한 결과(Fig. 1A), Target을 지난 횟수에서 유의한 차이(F(4,29) =3.727, p =.016)가 나타나 사후 검증을 실시한 결과 NC 집단에 비해 AC 집단에서 통계적으로 유의하게 감소하였다(p =.027). 둘째로, Nest building test를 실시한 결과(Fig. 1B–D), 둥지의 점수(F(4,29) =4.16, p =.010)와 둥지의 무게(F(4,29) =5.531, p =.002)가 유의한 차이가 나타났다. 따라서 사후검증을 실시한 결과 둥지의 점수는 NC 집단에 비해 AC 집단에서 통계적으로 유의하게 감소하였고(p =.012), AC 집단과 비교하여 AEM 집단에서 통계적으로 유의한 차이가 났다(p =.025). 둥지의 무게는 NC 집단과 비교하여 AC 집단에서 유의적인 차이가 났으며(p =.002), AC 집단과 비교하여 NE (p =.039), AM (p =.022), AEM (p =.021) 집단 모두 둥지 무게에서 통계적으로 유의하게 차이가 나타났다.
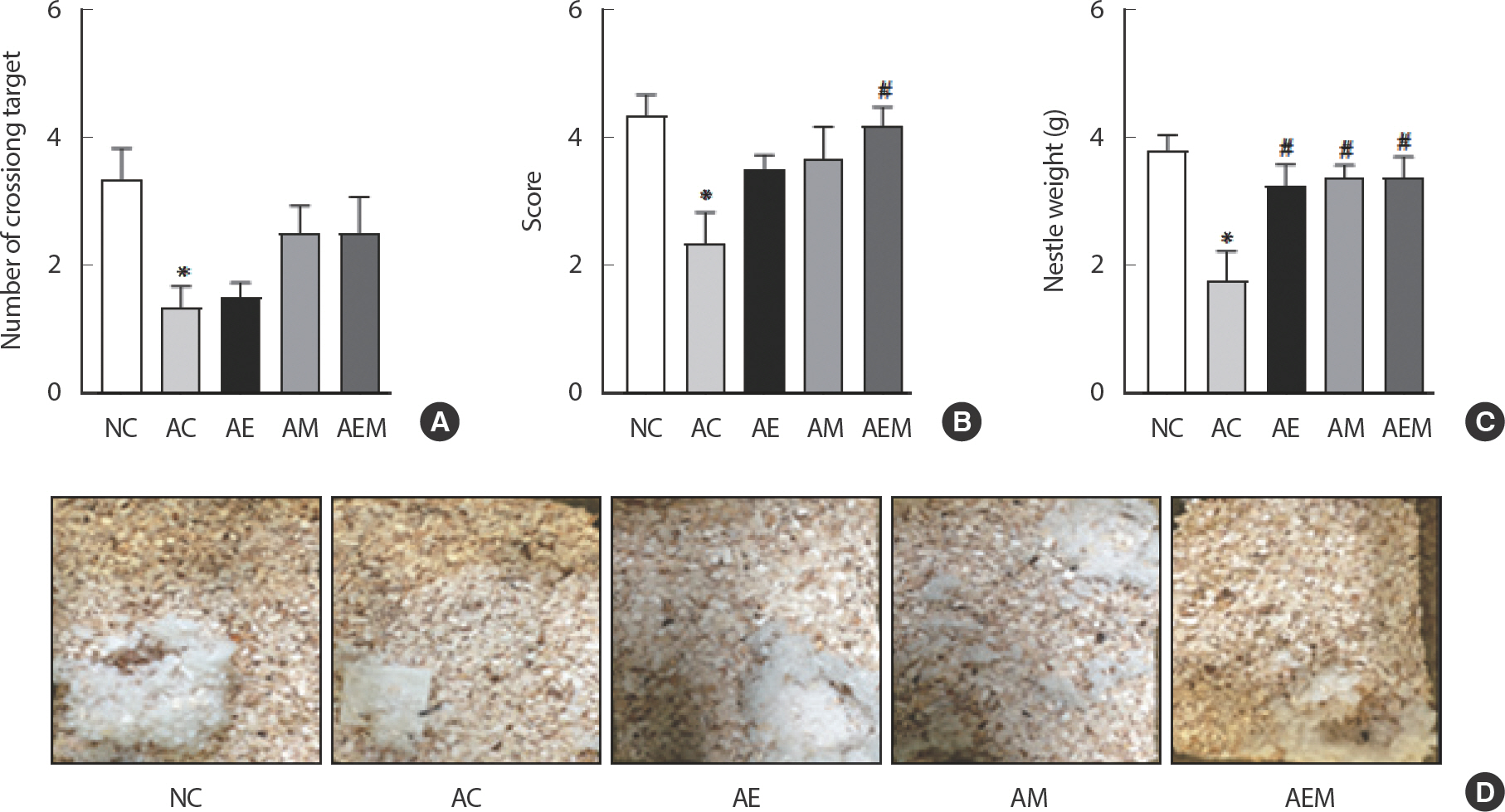
The Effect of 8 weeks Treadmill exercise and MitoQ on behavioral function in AlCl3-induced mice. (A) Number of targets crossing in the probe trail. (B) The score of the nest made by the mice. (C) The weight of the nest made by the mice. (D) Nest shape according to groups. Bonferroni post hoc test after ANOVA. Values are mean±SD. ∗ p<.05 vs. NC;# p<.05 vs. AC. NC: conrtol, AC: AlCl3, AM: AlCl3+MitoQ, AE: AlCl3+Exercise, AEM: AlCl3+Exercise+MitoQ.
2. 집단 간 Total Tau 및 p-Tau의 수준 변화
AlCl3 처치로 유도한 알츠하이머 실험동물을 대상으로 8주간 지구성 운동 및 MitoQ 적용 후 해마조직 내 Total Tau와 p-Tau를 western blot로 분석한 결과(Fig. 2A, B), p-Tau (s396)이 집단 간 유의적 차이가나타나지 않았지만(F(4,29) =2.037, p =.120), Total Tau와 p-Tau (s202)에서 통계적으로 유의한 차이가 나타났다(Total Tau: F(4,29) =11.381, p =.001; p-Tau(s202): F(4,29) =12.157, p =.001). 따라서 사후검증을 실시한 결과 Total Tau는 NC 집단에 비해 AC (p =.001), AE (p =.004), AM (p =.038) 집단에서 유의하게 증가하였다. 반면에 AC 집단에 비해 AM (p =.042), AEM (p =.001) 집단에서 유의하게 감소하였다. 둘째로, p-Tau (s202)는 NC 집단과 비교하여 AC (p =.001), AM (p =.011) 집단에서 유의적으로 차이가 있었다. 또한, AC 집단과 비교하여 AE (p =.007), AEM (p =.001) 집단에서는 유의적으로 감소하였다. 마지막으로 면역조직화학염색 방법을 이용하여 p-Tau (s396)을 분석한 결과(Fig. 2C, D), 집단간 유의한 차이가 나타났다(F(4,29) =82.176, p =.001). 사후검증을 실시한 결과 NC 집단과 비교하여 AC (p =.001), AE (p =.001), AM (p =.003) 집단에서 유의한 차이가 있었다. AC 집단과 비교하여 AE (p =.001), AM (p = .001), AEM (p =.001) 집단에서는 유의적으로 감소하였다. 또한, AE 집단과 비교하여 AEM (p =.012) 집단에서 유의하게 감소하였다.
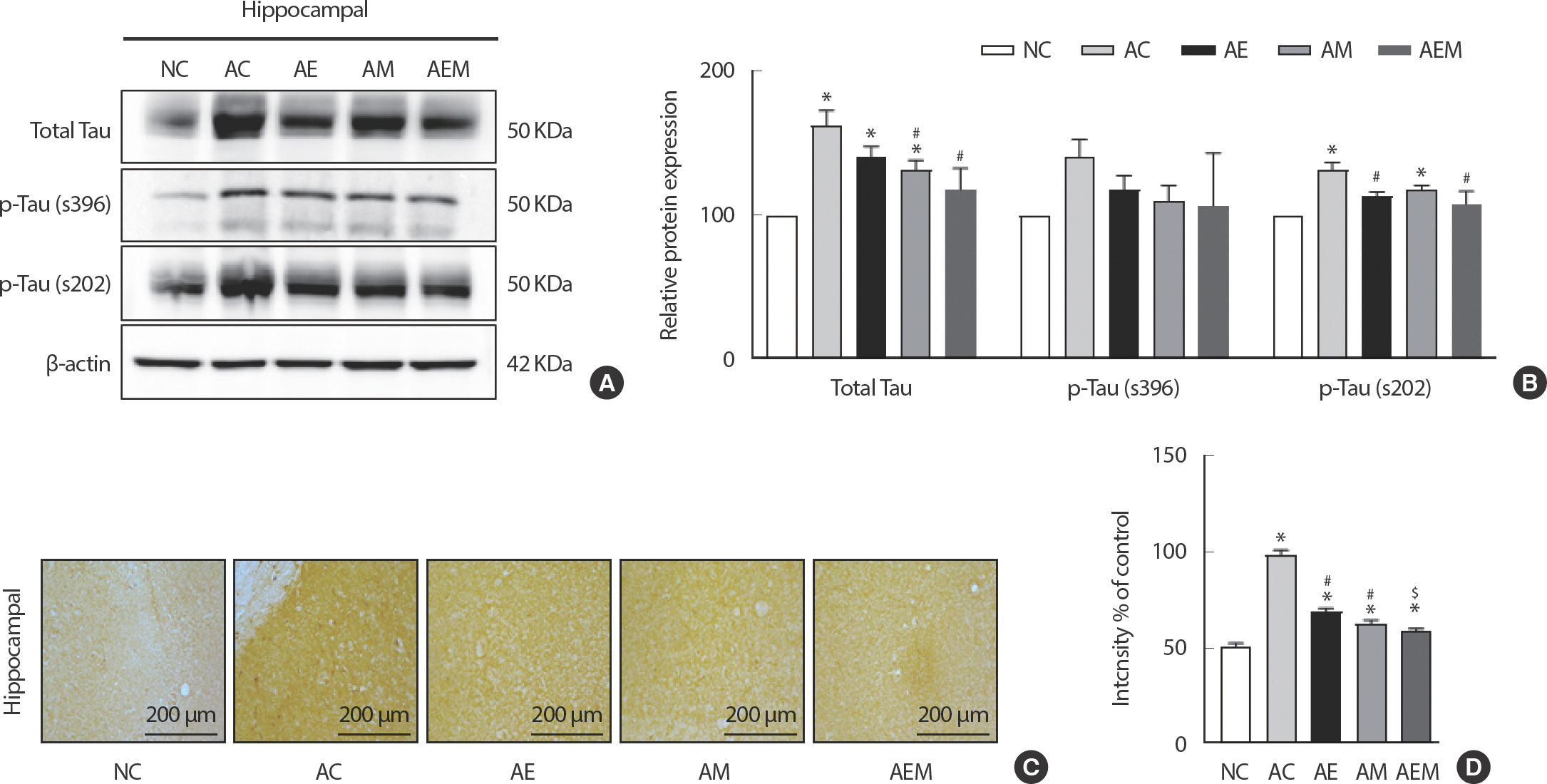
The Effect of 8 weeks Treadmill exercise and MitoQ on Total Tau, p-Tau (s202, s396) in AlCl3-induced mice. (A) Representative western blot image of Total Tau, p-Tau (s202), and p-Tau (s396) (n=six per group). (B) Quantification of Total Tau, p-Tau (s202), and p-Tau (s396) levels. β-actin was probed as an internal control. (C) Photomicrographs showing p-tau (s396) immunoreactivity in the hippocampal CA2 of AlCl3-induced in each group. (D) The values in the bar graph are presented as relative densitometric units (RU) of p-tau(s396) immunoreactivity in the CA2 area. Bonferroni post hoc test after ANOVA. Values are mean±SD. ∗ p<.05 vs. NC;# p<.05 vs. AC;$ p<.05 vs. AE. NC: conrtol, AC: AlCl3, AM: AlCl3+MitoQ, AE: AlCl3+Exercise, AEM: AlCl3+Exercise+MitoQ.
3. 집단 간 산화스트레스 수준 변화
AlCl3 처치로 유도한 알츠하이머 실험동물을 대상으로 8주간 지구성 운동 및 MitoQ 적용 후 산화스트레스의 지표인 4-HNE, 지질과산화물(3,4-Methylenedioxyamphetamine, MDA) 수치를 확인한 결과(Fig. 3), 4-HNE (F(4,29) =22.65, p =.001)와 MDA (F(4,29) =27.376, p =.001)에서 통계적으로 유의한 차이가 나타났다. 따라서 사후검증을 실시한 결과 4-HNE는 NC 집단에 비교하여 AC (p =.001) 집단과 AM (p =.001) 집단에서 통계적으로 유의하게 증가했다. 또한, AC 집단과 비교하여 AE 집단(p =0.036)과 AEM 집단(p =0.010)에서 유의적으로 감소하였다. 산화 스트레스를 나타내는 간접적인 지표인 MDA는 NC 집단과 비교하여 AC (p =.001) 집단에서 유의적으로 증가하였다. 반면, AC 집단에 비교하여 AE (p =.001), AM (p =.001), AEM (p =.001) 집단은 유의적으로 감소하였다.
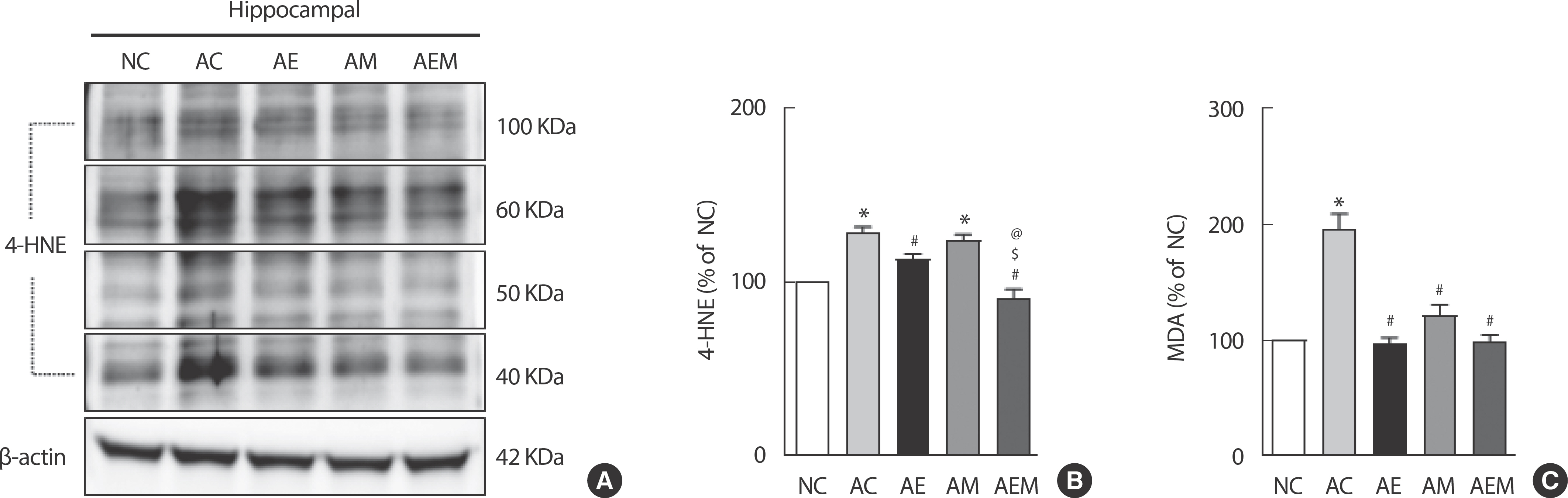
The Effect of 8 weeks Treadmill exercise and MitoQ on oxidative stress in AlCl3-induced mice. (A) Representative western blot image of 4-HNE (n=six per group). (B) Quantification of 4-HNE levels. β-actin was probed as an internal control. (C) MDA levels by ELISA analysis (n=six per group). Bonferroni post hoc test after ANOVA. Values are mean±SD. ∗ p<.05 vs. NC;# p<.05 vs. AC;$ p<.05 vs. AE;@ p<.05 vs. AE. NC: conrtol, AC: AlCl3, AM: AlCl3+MitoQ, AE: AlCl3+Exercise, AEM: AlCl3+Exercise+MitoQ.
4. 집단 간 Catalase, SOD-1, SOD-2 수준 변화
AlCl3 처치로 유도한 알츠하이머 실험동물을 대상으로 8주간 지구성 운동 및 MitoQ 적용 후 항산화 효소 단백질인 Catalase, SOD-1, SOD-2의 결과(Fig. 4), Catalase (F(4,29) =36.384, p =.001), SOD-1 (F(4,29) = 52.273, p =.001) 및 SOD-2 (F(4,29) =35.837, p =.001)에서 통계적으로 유의한 차이가 나타났다. 따라서 사후검증을 실시한 결과 Catalase는 NC 집단에 비교하여 AC 집단에서 유의하게 감소하였으며(p =.001), AC 집단과 비교하여 AE (p =.001), AM (p =.001), AEM (p =.001) 집단 모두에서 통계적으로 유의하게 증가된 것을 확인할 수 있다. SOD-1의 경우 NC 집단과 비교하여 AC (p =.001), AE (p =.001), AM (p =.001), AEM (p =.001) 집단 모두 통계적으로 유의한 차이가 있으며, AC 집단과 비교하여 AE (p =.004), AM (p =.001), AEM (p =.001) 집단에서 유의하게 증가하였다. 또한, AE 집단 대비 AM (p =.023), AEM (p =.020) 집단에서도 유의하게 증가하였다. 마지막으로, SOD-2는 NC집단과 비교하여 AC (p =.001), AE (p =.001), AM (p =.001), AEM (p =.001) 집단 모두 유의적으로 차이가 나타났다.

The Effect of 8 weeks Treadmill exercise and MitoQ on antioxidants in AlCl3-induced mice. (A) Representative western blot image of antioxidant en-zymes (n=six per group). (B) Quantification of SOD1, SOD2 and catalase levels. β-actin was probed as an internal control. Bonferroni post hoc test after ANOVA. Values are mean±SD. ∗ p<.05 vs. NC;# p<.05 vs. AC. NC: conrtol, AC: AlCl3, AM: AlCl3+MitoQ, AE: AlCl3+Exercise, AEM: AlCl3+Exercise+MitoQ.
5. 집단 간 PGC1α, Tfam 수준 변화
AlCl3 처치로 유도한 알츠하이머 실험동물을 대상으로 8주간 지구성 운동 및 MitoQ 적용 후 미토콘드리아 생합성 조절인자인 PGC1α와 Tfam 단백질 발현을 분석한 결과(Fig. 5), PGC1α (F(4,29) =14.608, p =.001)와 Tfam (F(4,29) =26.615, p =.001)에서 통계적으로 유의한 차이가 나타났다. 따라서 사후검증을 실시한 결과 PGC-1α는 NC 집단과 비교하여 AC (p =.001), AM (p =.046), AE (p =.001) 집단에서 유의하게 감소되었으며, AC 집단과 비교하여 AE (p =.008), AEM (p =.001) 집단에서 발현이 유의하게 감소하였다. 또 다른 생합성 조절인자인 Tfam은 NC 집단과 비교하여 AC (p =.001), AE (p =.001), AM (p =.001), AEM (p =.013) 집단에서 유의한 차이가 있으며. AC 집단과 비교하여 AE (p =.021), AEM (p =.001) 집단에서 유의한 차이가 나타났고, AM 집단에 비교하여 AEM 집단(p =.035)이 유의하게 증가하였다.
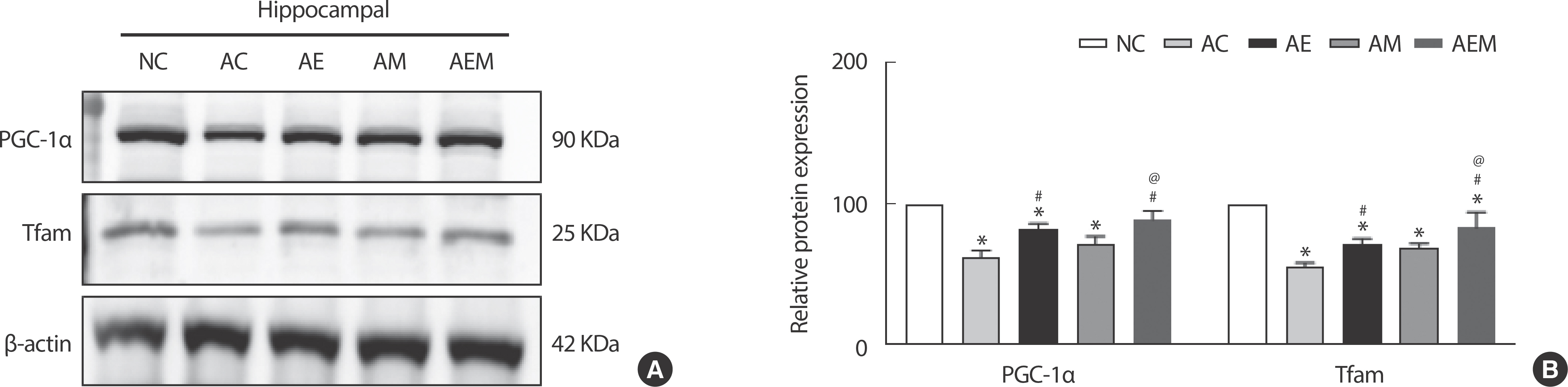
The Effect of 8 weeks Treadmill exercise and MitoQ on mitochondrial biogenesis-related factors in AlCl3-induced mice. (A) Representative western blot image of PGC-1α and Tfam (n=six per group). (B) Quantification of PGC-1α and Tfam levels. β-actin was probed as an internal control. Bonferroni post hoc test after ANOVA. Values are mean±SD. ∗ p<.05 vs. NC;# p<.05 vs. AC;@ p<.05 vs. AE. NC: conrtol, AC: AlCl3, AM: AlCl3+MitoQ, AE: AlCl3+Exercise, AEM: AlCl3+Exercise+MitoQ.
논 의
본 연구는 염화 알루미늄(AlCl3) 처치로 알츠하이머를 유도한 실험동물을 대상으로 8주간 지구성 운동 및 Mitoquinone mesylate (Mi-toQ) 적용이 타우 단백질의 과인산화에 어떤 영향을 주는지 알아보고자 하였으며, 이에 따른 산화스트레스 및 미토콘드리아 기능 활성화에 미치는 영향을 규명하였다.
먼저, 인지기능 및 공간 기억능력을 분석하기 위해 수중 미로 검사(Water mazr test)와 둥지 건설 검사(Nest building test)를 실시하였다. 타겟을 가장 많이 지나친 횟수를 기록한 NC 집단과 비교하여 AC 집단에서 유의하게 감소하였다. 이는 염화 알루미늄의 축적이 인지기능 및 공간 기억능력을 감소시킨다는 것을 의미하며[8], 지속적인 염화 알루미늄 노출을 통해 인지기능의 결손을 보고한 선행연구와 일치하였다[28,29]. 하지만, 본 연구에서는 AC 집단과 비교하여 AE, AM, AEM 유의한 차이가 나타나지 않았으나 증가한 경향이 나타났다. 트레드밀 운동 집단에서 긍적적인 효과가 낮게 나타난 이유를 생각해보면 자발적 운동의 형태가 다소 결함된 트레드밀 운동을 실시하였기 때문에 운동으로 인한 스트레스가 원인이 되어 불안감을 조성하였기 때문에 이러한 결과가 나타났다고 생각된다[30].
동물이 둥지 짓는 행위인 Nesting은 해마의 영향을 받으며 알츠하이머에 의한 신경적 병변은 동물에게 있어서 Nesting 행동에 장애를 유발한다고 보고하고 있다[26,27,31]. 둥지 건설 검사를 실시한 결과 AC 집단의 둥지 형성 점수와 둥지 무게가 다른 집단에 비해 유의하게 낮았다. 이는 염화 알루미늄이 해마에 축적되면서 생긴 해마부분의 손상이 둥지 형성에 악영향을 끼친다는 Deacon et al. [32]의 연구와 일치하며, 운동과 항산화제의 적용은 동물의 Nesting 활동 개선에 도움을 주고, 알츠하이머 질환을 완화시킨다는 Walker et al. [33]의 연구와 일치하는 결과가 나타났다.
알루미늄의 축적으로 인한 타우 단백질의 과인산화는 신경독성을 유발하며, 산화적 불균형의 원인이 되는 활성산소종을 증가시켜 신경계 항상성 조절에 악영향을 증명했다[34]. 본 연구에서 염화 알루미늄을 처치한 집단들과 NC 집단을 비교하여 알루미늄의 축적이 해마 내 조직에 T-Tau의 과인산화 수치가 증가시킨다는 것을 확인할 수 있었다. 반면, 지구성 운동과 MitoQ를 적용한 집단들의 수치는 비교적 낮다는 것을 확인할 수 있는데, 이는 지구성 운동과 MitoQ의 적용이 T-Tau의 과인산화를 완화시킨다는 근거가 되고 규칙적인 운동이 산화적 불균형을 완화시켜 신경가소성 조절에 관여하며 T-Tau의 과인산화와 같은 알츠하이머의 병변과 인지기능에 긍정적인 영향이 있을 것으로 생각한다[15,17,35-37]. Mc-Manus et al. [38]와 Ma et al. [39]의 선행 연구에 근거하여 MitoQ의 적용은 미토콘드리아를 표적하여 작용하며 운동과 같이 산화적 불균형을 개선하고 신경보호 효과를 유도한다. 그러므로 규칙적인 운동 및 항산화제의 섭취가 T-Tau 및 p-Tau의 수치를 감소시키는데 효과가 있었을 것이라고 생각한다.
알루미늄에 대한 노출은 활성산소종(ROS)을 증가시키며, 미토콘드리아 기능을 악화시키고, 신경계 항상성 조절인자에 영향을 끼친다고 보고하였다[8]. 이러한 산화스트레스로 인한 ROS의 증가는 알츠하이머 질환의 원인으로 볼 수 있다[40]. 본 연구에서 산화스트레스를 확인하기 위해 4-Hydroxynonenal and cholesterol oxidation products (4-HNE) 및 지질 과한화물(MDA)를 측정하였다. 불포화지방산에 산소가 첨가된 4-HNE는 지질과산화(lipid peroxidation)의 증가에 영향을 주며, 인슐린 저항성을 증가시키는 요인이 된다. 인슐린 저항성의 증가는 해마의 신경세포의 에너지 대사 신호전달계의 감소에 영향을 끼치고 미토콘드리아의 기능에 있어 부정적인 영향을 끼치며 T-Tau의 과인산화를 야기해 알츠하이머를 유발한다[41]. 본 연구 결과 결과에서는 AC 집단의 4-HNE와 MDA 수치가 가장 높은 것으로 확인되었다. 이는 해마조직 내 산화 스트레스의 증가가 지질산화에 영향을 끼친다는 근거가 된다[42]. 반면, 운동을 적용한 집단과 MitoQ를 적용한 집단에게서 4-HNE와 MDA의 감소를 확인할 수 있었다. 이는, 운동과 MitoQ 의 처치가 산화적 불균형 완화에 효과가 있다는 근거가 된다[15].
미토콘드리아의 기능 이상 및 산화스트레스의 감소는 알츠하이머 질환의 예방 및 완화에 있어서 중요한 요인이다. Qin et al. [43]의 연구에 따르면 알츠하이머 질환의 특징으로 미토콘드리아 생합성에 필수적인 유전자인 Peroxisome proliferator-activited receptor γ coactivator-1α(PGC-1α)의 감소는 미토콘드리아의 기능 이상을 야기하며 알츠하이머 질환 발병에 기여하는 근본적 원인이 된다. 본 연구에서 AlCl3을 처치한 집단과 비교하여 운동을 적용한 집단에서 PGC-1α의 수치가 유의적으로 높게 나타났다. Wang et al. [44]의 연구에 따르면 운동이 PGC-1α 발현을 증가시켜 뉴런의 및 미토콘드리아 기능의 활성화에 도움을 주며, Mc-Manus et al. [38]은 MitoQ의 섭취가 항산화 기능을 포함하여 미토콘드리아 기능개선에 효과가 있음을 증명하였다. Mitochondrial transcription factor A (TFAM)은 주로 DNA를 합성시켜 미토콘드리아를 복제하는 주요 인자로 보고되고 있다[17]. Thomas et al. [45]의 연구에 따르면 Tfam의 발현은 근육과 심장조직에서 미토콘드리아의 기능을 활성화시키고, 미토콘드리아의 활성화는 알츠하이머병변 기능 악화에 있어서 중요한 방어수단이 된다. 본 연구에서의 Tfam 결과를 살펴보면, NC집단 대비 AlCl3을 처치한 집단에서 통계적으로 유의하게 감소된 것을 확인할 수 있었다. 이는 알츠하이머 질환이 Tfam의 활성화를 저해한다는 의미이다[17]. 하지만 AlCl3을 처치한 집단과 지구성 운동을 적용한 집단들을 비교하면, 통계적으로 유의한 차이가 있다는 것을 확인할 수 있었고, 이는 지구성 운동에 의한 Tfam 발현이 PGC-1α 활성화와 미토콘드리아 기능 활성화에 영향을 준다는 근거가 된다[17].
Park et al. [46]의 연구에 따르면 항산화 효소인 cu/zn-SOD (SOD-2), Mn-SOD (SOD-1)의 발현은 체내 산소 독성을 물과 산소로 변화시키며, 지구성 운동은 이를 촉진시켜 세포 내 항상성을 유지한다고 증명했다. AC 집단과 비교하여 운동 및 MitoQ를 적용한 집단에서 Catalase, SOD-2, SOD-1의 발현이 유의하게 높음을 확인할 수 있는데, Park et al. [46]의 연구를 근거로 운동과 항산화제의 적용이 항산화 효소의 작용에 있어서 영향을 끼친다고 생각할 수 있다.
결론적으로 AlCl3을 8주간 처치하였을 때, 행동분석 검사에서 인지기능의 저하가 확인되었으며, 알루미늄의 축적이 T-Tau 및 p-Tau의 발현을 증가시킨다는 것을 확인하였다. 반면, 지구성 운동 및 MitoQ의 적용이 T-Tau, p-Tau의 발현을 감소시켰을 뿐만 아니라, 지질산화수치를 낮추는데 도움을 주고 항산화 효소를 증가시켰다. 즉, 지구성 운동 및 MitoQ의 적용이 알츠하이머 질환 개선에 효과가 있다는 것을 의미하며, 지구성 운동 및 MitoQ의 적용은 T-Tau의 과인산화에 대한 감소 효과가 있는 것으로 볼 수 있다. 추후 MitoQ와 운동의 대한 자세한 접근이 필요할 것으로 보여지며, 이를 확인하기 위해 MitoQ의 농도와 양, 운동의 강도에 따라 연구의 기간을 다르게 설계하여 분석함으로써 알츠하이머 질환을 포함한 신경퇴행성 질환에서의 역할을 규명할 필요성이 있다.
결 론
본 연구는 염화 알루미늄(AlCl3)으로 유도된 알츠하이머 질환 동물모델을 대상으로 8주간의 지구성 운동과 MitoQ의 섭취가 Tau의 과인산화, 산화스트레스, 항산화조절요인, 미토콘드리아 기능 및 인지기능을 분석한 결과는 다음과 같다. 첫째, 8주간 지구성 운동 및 MitoQ의섭취는 알츠하이머 질환 동물모델에서 둥지건설검사에서 유의하게 증가하였으며, 수중미로검사에서는 유의한 차이는 나지 않았지만 긍정적인 경향이 나타났다. 둘째, 8주간 지구성 운동 및 MitoQ의 섭취는 Tau의 과인산화를 감소한 것으로 나타났다. 셋째, 8주간 지구성 운동 및 MitoQ의 섭취는 산화스트레스를 감소시켰으며 항산화 관련 요인에 긍정적인 영향을 나타냈다. 넷째, 8주간 지구성 운동 및 MitoQ의 섭취는 미토콘드리아 기능과 관련된 요인은 긍정적인 결과가 나타났다. 따라서 8주간의 지구성 운동 및 MitoQ의 섭취는 알츠하이머 질환을 완화시킨다는 것에 효과적인 방법으로 볼 수 있다.
Notes
이 논문 작성에 있어서 어떠한 조직으로부터 재정을 포함한 일체의 지원을 받지 않았으며, 논문에 영향을 미칠 수 있는 어떠한 관계도 없음을 밝힌다.
AUTHOR CONTRIBUTION
Conceptualization; Data curation; Formal analysis; Funding acquisition; Methodology; Project administration; Visualization: J Lee; Writing-original draft: J Jeong; Writing-review & editing: D Choi.



