트레드밀 운동이 고지방식으로 유도된 알츠하이머 치매 마우스에서 인슐린 수용체, 산화 스트레스 및 시냅스 가소성 장애에 미치는 효과
Abstract
PURPOSE
This study investigated the effect of treadmill running on obesity-related brain insulin receptor, oxidative stress, and impaired synaptic plasticity in 3xTg-AD mice (APPSWE, PS1M146V and tauP301L).
METHODS
At 4 months of age, thirty 3xTg-AD mice were assigned to standard chow (SC, n=10) or high-fat-diet (HFD, n=10) or HFD plus exercise training (HFD+EX, n=10). HFD+EX mice were subjected to treadmill running at a moderate intensity with duration of 30 minutes per day and frequency of 5 days per week for 20 weeks. HFD mice were fed a 60% fat HFD for the same period. Mice were sacrificed and histological and western blot analysis was performed.
RESULTS
Compared with the SC mice, the HFD mice had significantly lower levels of p-IRβ/IRβ (p<.05) in conjunction with APP (p<.05), Aβ oligomer (p<.05), HNE/NEUN (p<.05), PSD95 (p<.05), DCX/NeuN (p<.05) in the hippocampus. On the other hand, we found that treadmill running attenuated HFD-induced exacerbations of APP (p<.05), Aβ oligomer (p<.05), PSD95 (p<.05), DCX/NeuN (p<.05) in the hippocampus.
CONCLUSIONS
The current findings suggest that treadmill running protects against AD-like disease progression and impaired synaptic plasticity, cell proliferation caused by a HFD in the 3xTg-AD mice.
색인어: 알츠하이머 치매, 운동 트레이닝
Keywords: Exercise training, Alzheimer disease, High fat diet, 3xTg-AD mice
서 론
알츠하이머 질환(Alzheimer’s disease, AD)은 치매의 가장 일반적인 형태로서 점증적으로 인지기능 장애를 나타나는 대표적인 퇴행성 뇌 질환(degenerative disease)이며, 결과적으로 행동장애로 인한 독립생활 능력의 상실로 이어지는 심각한 질병이다[ 1]. 대규모의 역학조사에 따르면 AD의 발병원인은 특정 유전자 돌연변이와 다른 위험 요인들 사이의 복잡한 상호작용의 결과로 발생한다고 보고되고 있지만 현대의학 기술이 비약적으로 발달함에도 불구하고 아직까지 정확한 발병 기전이나 치료책은 명확하게 규명되어 있지 않다[ 2]. 그럼에도 불구하고 현재까지 가장 잘 알려진 AD의 병리학적 특징으로는 뇌의 인지능력을 담당하는 해마(hippocampus)와 대뇌피질(cerebral cortex)에서 아밀로이드 전구 단백질(Amyloid precursor protein, APP)이 비정상적인 경로로부터 분해되어 형성된 A β(1-42) 단백질[ 3]과 Tau 단백질의 과인산화로 형성된 신경섬유 다발(Neurofibrillary tangle)이 축적되어 뇌 신경세포에 독성을 유발하는 것으로 보고되고 있으며[ 4] 이는 산화스트레스(oxidative stress)[ 5], 시냅스 기능장애(synaptic dysfunction)[ 6]를 유발하며 신경세포 손상(neuronal damage)으로 인해 세포들이 사멸(cell death)[ 7]을 일으키는 일련의 연쇄반응들로 이어져 인지기능이 서서히 감퇴되는 AD가 발병하는 것으로 보고되고 있다. 최근 연구를 통해 밝혀진 사실은 비만과 2형 당뇨병의 핵심인자인 인슐린 저항성이 AD의 위험을 증가시킨다는 선행연구[ 8]를 비롯하여 일반인에 비해 2형 당뇨환자에서 AD에 노출될 수 있는 위험이 상대적으로 더 높다는 새로운 사실이 밝혀지고 있다[ 9]. 인슐린은 일반적으로 말초 포도당 대사 및 에너지 항상성 조절에 주요한 역할을 한다고 잘 알려져 있을 뿐만 아니라 뇌의 주요 영역인 해마(hippocampus), 대뇌피질(cerebral cortex), 시상하부(hypothalamus), 후각신경(olfactory bulb) 등에 분포되어 있는 인슐린 수용체(insulin receptor)와 결합하여 인슐린 신호전달을 활성화시킴으로써 세포성장(cell growth), 세포생존(cell survival), 시냅스 가소성(synaptic plasticity), 학습(learning)과 기억력 형성(memory formation)[ 10]을 자극하고, amyloid beta (A β) 침착과 tau 단백질의 인산화를 억제시키는 것으로 보고되고 있다[ 11]. 한편 유산소 및 저항성 운동의 형태는 비만 및 당뇨와 같은 대사질환뿐만 아니라 뇌 손상 및 퇴행성 뇌질환의 예방과 치료를 위해 비약물적인 수단으로 처방되고 있다. 예를 들어 유전자 변형 동물실험에서 규칙적인 운동은 amyloid plaque와 soluble A β 및 p-tau 감소 등을 통하여 AD의 신경병변으로 인한 신경세포의 독성을 최소화하고 활성산소(reactive oxygen species, ROS)의 항상성 유지[ 12]와 신경성장인자(nerve growth factor, NGF) 및 시냅스 가소성(synapse plasticity)[ 13]을 증가시켜 신경세포 성장과 생존에 자극함으로 인지기능 향상에 기여하는 것으로 보고되고 있다. 또한, 신경 생성을 촉진시키고 신경 퇴화를 예방하며, 결과적으로 뇌의 학습능력과 기억력을 향상시키는 BDNF의 생성을 자극시키는 IGF-1의 합성 및 생체 내 활성(bioacailability)을 증가시키는 것으로 보고되고 있다[ 14, 15]. 따라서 본 연구에서는 비만의 표현형(phenotype)의 전체적인 형태가 나타난다는 이전의 Speakman et al. [ 16]과 Inui [ 17]의 선행연구를 바탕으로 20주간 고지방식으로 유도된 AD 마우스의 인슐린 수용체 발현을 비롯한 AD의 병리학적 특징과 산화스트레스(oxidative stress) 및 시냅스 가소성(synaptic plasticity)에서 트레드밀 운동의 효과를 규명하는 것을 목적으로 하였다.
연구 방법
1. 연구 대상
본 연구에서는 사용된 실험동물은 AD에 가장 적합한 동물 모델로서 알려지고 있는 4개월된 수컷 3xTg-AD 마우스 30마리를 사용하였다. 동물 사육실 온도는 21±1˚C로 유지하였고, 명기와 암기는 각각 12시간으로 조절하였다. 본 연구는 AAALAC International (Association for Assessment and Accreditation of Laboratory Animal Care International) 인증기관인 S 대학교 동물관리사용위원회(IACUC)의 검토와 승인을 거쳤으며, 실험동물의 관리와 사용에 관한 지침을 준수하며 시행하였다.
2. 연구절차
무작위로 총 30마리를 추출하여 정상식이를 섭취하는 집단(standard chow, SC=10), 60% 지방이 함유된 고지방식이(high-fat diet, HFD; D12492, research Diet)를 섭취하는 집단(high-fat diet, HFD)과 고지방식이 섭취와 운동을 병행하는 집단(high-fat diet plus exercise training, HFD-EXE =10)으로 구분하였다. 식이와 운동은 동일하게 20주간 처치하도록 하였다( Fig. 1).
1) 운동처치
운동 처치는 이전의 Cho et al. [ 18]의 방법을 수정 보완하여 이용하였다. 마우스 트레드밀(Columbus Instruments, Inc., Columbus, OH)을 이용하여 총 20주간 주당 5회 총 30분간 중강도 운동 트레이닝을 실시하였으며, 사전 1주일 동안 적응을 위해 10 m/min 속도로 15분간 훈련을 실시하였다. 본 운동 시작 전과 후에는 각각 5 m/min 속도로 5분간 준비운동과 정리운동을 실시하였으며 본 운동은 13 m/min 속도로 20분간 실시하였다.
2) 뇌 적출 및 조직처리
실험동물들은 Zoletil 50Ⓡ (10 mg/kg)을 복강 내 주사를 통하여 마취시킨 후 흉강을 열고 좌심실을 통하여 50 mM 인산염 완충식염수(phosphate buffer saline, PBS)를 주입하였다. 이 후 100 mM 인산 완충액에 녹인 4% paraformaldehyde (PFA) 고정액을 관류하였다. 관류 고정 후 두개골을 제거한 뒤 뇌를 적출한 다음 고정액에 담아서 4˚C에서 12시간 후 고정을 실시하였다. 고정된 뇌 조직은 30% sucrose 용액에서 3일간 침적시킨 후 Cryostat (Leica, Nussloch,Germany)를 이용하여 40 μm 두께로 절편 제작하였다.
3) Immunofluorescence
실험방법은 이전의 Ziebell et al. [ 19]이 기술한 바와 같이 수행하였다. 먼저 절편된 뇌 조직을 3% normal goat serum (Gibco, Grand Island, NY)으로 blocking시킨 후에 1차 항체 mouse anti-NeuN (1:200, Millipore, Temecula, CA), rabbit anti-HNE (1:200, Millipore, Temecula, CA), rabbit anti-DCX (1:200, Millipore, Temecula, CA), rabbit anti-APP (1:200, Millipore, Temecula, CA), rabbit anti-A β oligomer (1:200, Millipore, Temecula, CA), rabbit anti-PSD95 (1:200, cell signaling, Beverly, MA), mouse anti-Synaptophysin (1:200, Millipore, Temecula, CA)을 상온에서 2시간 동안 반응시켰다. 그 다음 2차 항체 Alexa Fluor-488과 Alexa Fluor-594에 상온에서 1시간 반응시킨 후 DAPI (Santa cruz biotechnology, Paso Robles, CA)를 이용하여 핵을 염색한 후 유리 슬라이드에 옮긴 후 커버를 덮은 후 confocal microscope (Olympus, Tokyo, Japan)를 이용하여 분석하였다.
4) Western blot
실험방법은 이전의 Shin et al. [ 20]이 기술한 바와 같이 수행하였다. 먼저 뇌 조직에서 추출한 단백질 총량 10-15 μg을 이용하여 SDS-polyacrylamide gel에서 70 volt로 전기영동을 한 후 nitrocellulose membrane으로 120 volt로 90분간 전이시켰다. 전이가 끝난 Membrane을 5% skim milk용액으로 1시간 blocking시킨 후에 1차 항체인 anti-insulin receptor β (1:1,000, cell signaling, Beverly, MA)와 anti-phospho-insulin receptor β (cell applications)을 5% skim milk 용액에 각각 희석시켜 24시간 반응시켰다. 그 다음 TBS-T 용액으로 10분씩 3번 washing 후 2차 항체 horseradish peroxidase conjugated secondary antibodies를 이용하여 실온에서 90분간 반응시킨 후에 다시 Membrane을 TBST 용액에 넣고 10분씩 3번 washing 후 ECL로 1분간 발색시킨 뒤 얻어진 membrane을 이미지 분석 시스템 Image J (National Institutes of Health, Bethesda, MD)를 이용하여 단백질량을 분석하였다.
3. 자료처리방법
통계적 자료 분석을 위해서 SPSS version 18을 사용하였다. 세 집단 간의 차이는 일원분산분석법(One-way ANOVA)을 이용하였으며, 사후 검정은 LSD법을 이용하였으며 통계적 유의수준은 α=.05로 설정하였다.
연구 결과
1. 운동 트레이닝이 인슐린 수용체(insulin receptor) 변화에 미치는 영향
총 20주간의 실험 처치에 따른 뇌의 인슐린 수용체 변화를 관찰하기 위해 Western blot 분석을실시한 결과이다( Fig. 2A). 총 20주간 고지방식이는 정상식이에 비해 인슐린 수용체의 β-subnit 인 p-IR β/IR β이 비율이 유의하게 감소하는 것으로 나타났다( p<.05)( Fig. 2B).
2. 운동 트레이닝이 APP와 Aβ oligomer 발현에 미치는 영향
총 20주간의 실험처치에 따른 뇌의 APP와 A β oligomer 변화를 관찰하기 위해 Immunofluorescence 분석을 실시한 결과이다( Fig. 3A). 총 20주간 고지방식이는 정상식이에 비해 아밀로이드 전구 단밸직인 APP의 발현이 유의하게 증가하는 것으로 나타난 반면 운동 트레이닝은 APP 발현을 유의하게 감소시키는 것으로 나타났다( p<.05)( Fig. 3B). 그뿐만 아니라 아밀로이드 중합체인 A β oligomer의 발현이 증가하는 것으로 나타났으며, 운동트레이닝은 A β oligomer의 발현을 유의하게 억제시키는 것으로 나타났다( p<.05)( Fig. 3C).
3. 운동 트레이닝이 HNE/NeuN 발현에 미치는 영향
총 20주간의 실험처치에 따른 뇌의 oxidative stress 변화를 관찰하기 위해 Immunofluorescence 분석을 실시한 결과이다( Fig. 4A). 총 20주간 고지방식이는 정상식이에 비해 신경세포의 oxidative stress 지표인 HNE/NeuN 발현을 증가시키는 것으로 나타났다( p<.05)( Fig. 4B).
4. 운동 트레이닝이 PSD95와 synaptophysin 발현에 미치는 영향
총 20주간의 실험처치에 따른 뇌의 synaptic plasticity 변화를 관찰하기 위해 Immunofluorescence 분석을 실시한 결과이다( Fig. 5A). 총 20주간 운동트레이닝은 post-synapse 지표인 PSD95 발현을 유의하게 증가시키는 것으로 나타났다( p<.05)( Fig. 5B, C).
5. 운동 트레이닝이 DCX/NeuN 발현에 미치는 영향
총 20주간의 실험처치에 따른 뇌의 cell proliferation 변화를 관찰하기 위해 Immunofluorescence 분석을 실시한 결과이다( Fig. 6A). 총 20주간 고지방식이는 정상식이에 비해 신경세포의 cell proliferation 지표인 DCX/NeuN 발현이 감소하는 것으로 나타난 반면 운동 트레이닝은 DCX/NeuN의 발현을 유의하게 개선시키는 것으로 나타났다( p<.05)( Fig. 6B).
논 의
본 연구는 AD가 전 세계적으로 증가하는 시점에서 AD의 위험인자를 알아보기 위해 Bo et al. [ 21]과 Kim et al. [ 22]의 선행연구를 기반으로 고지방식으로 인한 AD 위험에 대한 운동 중재의 효과를 분자적 수준에서 검증하고자 한다. AD는 선천적인 유전 요인과 후천적인 환경 요인이 복합적으로 작용하여 발병한다고 보고되고 있다. 그 중 유전적 요인으로 amyloid precursor protein (APP), presenilin 1, 2 (PS1, 2) APOE4 등의 유전자 돌연변이로 생성되는 물질들이 가장 강력한 위험인자로 보고되고 있지만 이러한 유전자를 보유하더라도 모두 AD가 발병되지 않은 것으로 보아 다른 요인들과 복잡한 상호작용으로 발병이 조절되는 것으로 보고되고 있다[ 23, 24]. 여러 연구를 통해 밝혀진 사실 중 하나는 AD를 유발하는 환경적 요인 중 부각되고 있는 하나는 고지방식으로 인한 비만 혹은 이로 인한 2차적 위험인자인 인슐린 저항성이 유전적 위험요인과 무관하게 위험인자인 것으로 밝혀지고 있다[ 25]. 이에 대한 근거로는 비만으로 인해 말초기관의 고인슐린혈증은 중추신경계 인슐린의 양을 일시적으로 증가시키는데 이는 뇌 조직에서 A β를 제거시키는 역할을 하는 인슐린 분해효소(insulin degrading enzyme) 농도를 낮추어[ 26] A β oligomers를 증가시킴과 동시에 tau 단백질의 과인산화를 유도시키며[ 27], 또한 신경세포에서의 인슐린 신호전달 장애를 발생시켜 산화스트레스(oxidative stress)[ 28]와 시냅스 기능장애(synaptic dysfunction)[ 29]를 증가시키며 세포성장 및 분화(cell growth and proliferation)[ 30]의 감소를 유발시키는 것으로 보고되고 있다. 따라서 본 연구에서는 인간에서 나타나는 AD의 병리학적 특징과 가장 유사한 3xTg-AD mice를 대상으로 고지방식이 섭취를 유도하여 운동 트레이닝의 효과를 분석하였다. 그 결과, 20주간 고지방식을 섭취한 3xTg-AD 마우스는 p-IR β/IR β의 발현이 감소하는 것으로 나타났다. 반면 운동 트레이닝은 고지방식으로 감소된 p-IR β/IR β를 완화시키는 것으로 나타났다. 특히 대뇌피질에서의 발현의 그 효과가 명확하게 증가하는 것으로 나타났다. 이전의 동물 및 임상실험연구에서는 AD의 병리학적 특징으로 인슐린 수용체의 발현이 해마(hippocampus)와 대뇌피질(cerebral cortex) 등의 뇌 주요 부위에서 감소한 것으로 나타났으며[ 31- 34] 중증 치매일수록 인슐린 수용체의 양이 많이 감소하는 것으로 나타났다. 게다가 Mi et al. [ 35]의 연구에 의하면 고지방식으로 유도된 비만 마우스의 뇌 조직에서 인슐린 수용체의 발현이 감소되는 것을 확인하였으며, 반면 insulin을 마우스에 주입했을 때 고지방식이로 유도했음에도 불구하고 뇌의 인슐린 수용체의 감소가 억제되는 것으로 나타났다. 이와 유사하게, Dutheil et al. [ 36]의 보고에 따르면 고지방식으로 인한 인슐린 신호전달 체계의 장애는 염증성 사이토카인(pro-inflammation) 중 IL-6, IL1 β, TNFα의 발현을 증가시킬 뿐만 아니라 AD를 유발하는 데 중요한 역할을 하는 BACE1 활성[ 37]과 인지기능을 담당하는 주요 뇌 부위에서 APP, amyloid oligomer의 발현을 비정상적으로 증가시키는 것으로 보고되고 있다[ 38]. 또한 과 발현된 APP와 A β는 뇌 혈관 변화를 일으키는 산화스트레스(oxidative stress)를 유발하는 것으로 보고되고 있으며[ 39], 이는 노화와 AD를 포함한 여러 가지 신경 퇴행성 질환의 진행에 기여하는 것으로 간주되고 있다[ 40]. 본 연구 결과 20주간 고지방식이는 해마와 대뇌 피질에서 APP, amyloid oligomer 발현을 증가시켰으며, 이와 함께 대표적인 oxidative stress 생화학지표인 HNE를 증가시키는 것으로 나타나 선행연구와 유사한 결과를 나타냈다. 최근까지 규칙적인 운동을 포함한 신체활동은 AD의 병리학적 특징에 긍정적인 효과는 다양한 연구들에서 입증되었다[ 41, 42]. Maesako et al. [ 43]의 연구에 따르면 알츠하이머 형질변환 마우스를 20주간 고지방식이를 유도했을 때 자발적인 휠 운동을 했던 집단에서는 비만 및 이로 인한 대사장애를 완화시킴과 동시에 APP의 비정상적인 절단을 촉진하는 β-secretase 활성을 억제시킴으로써 A β의 생산을 감소시키는 것으로 나타났다. 이러한 운동에 의해 감소된 β-secretase 활성은 amyloid oligomer의 응축을 감소시키고 산화스트레스로 인한 신경손상을 예방 혹은 완화시키는 것으로 나타났다[ 44]. 본 연구 결과에서도 앞서 언급한 선행연구와 유사하게 해마에서 고지방식이 인해 비정상적으로 증가된 APP와 amyloid oligomer의 발현이 운동을 통해 억제 혹은 완화되는 것을 확인하였고 이와 더불어 oxidative stress 또한 운동에 의해 감소하는 것으로 나타났다. 한편, AD pathology와 시냅스 변형 및 소실과의 연관성에 대한 연구는 in vivo와 in vitro실험을 통해 현재까지도 많은 연구가 진행되고 있다. 특히 배양한 세포에서 수용성 A β가 수상 돌기에 손상을 일으킨다는 연구 결과[ 45]와 A β oligomer 형태가 인지 기능을 떨어뜨리고 뇌 조직 절편에서 장기 강화 현상(Long-term potentiation, LTP)을 억제하여 시냅스의 기능에 악영향을 끼치는 것으로 보고하였다[ 46]. 그뿐만 아니라, 응집된 plaque와 주변부에서 부분적으로 gliosis와 그에 관련하여 oxidative stress가 일어나 뇌 조직에서 synaptic dysfunction과 synaptic loss를 일으켜 신호가 통합되는 것을 방해한다고 보고하였다[ 47]. 본 연구에서도 고지방식이를 유도한 집단에서는 정상식이 집단과 PSD95와 synaptophysin의 발현의 차이는 나타나지 않았지만 세포의 성장과 관련된 DCX 발현이 유의하게 감소하는 것으로 나타났다. 반면 운동 트레이닝은 시냅스 가소성 및 세포의 성장을 유의하게 증가시키는 것으로 나타났다. 이러한 시냅스 가소성은 신경세포와 신경세포 사이의 신호전달에 중요한 영향을 미치는 것으로 보고되며, 또한 이러한 시냅스 분자의 활성은 신경세포의 axon과 dendrite의 길이를 변화시켜 신경세포의 생성 및 재생에 영향을 미치는 것으로 알려지고 있다[ 48]. 운동과 시냅스 가소성 및 세포증식에 관련된 선행연구를 살펴보면 운동은 뇌 주요 부위에서 시냅스 효능과 학습에 관여하는 단백질 발현 및 anti-apopotisis 지표인 Bcl-2의 발현을 증가시키는 것으로 나타났다. 이에 반해 pro-apoptotic pathway downstream으로서 세포사멸에 주요한 촉진인자인 Bax, caspase family의 발현을 억제시켜 인지기능 장애를 완화시키는 것으로 나타났다. 이와 같이 규칙적인 운동은 synaptic plasticity 및 BDNF의 동시발현 증가는 AD 병리학적 단계에 나타나는 독성물질에 대한 신경보호를 촉진시켜 결과적으로 AD 임상정 특징인 인지기능에 대한 긍정적인 효과를 나타내는 것으로 보고되고 있다[ 49]. 본 연구팀의 연구결과를 종합하여 판단할 때, 운동 트레이닝은 고지방식에 의한 AD의 신경병변의 악화 현상을 억제시켜 인지기능 감소에 대한 예방/완화시키는 효과가 있을 것으로 사료된다. 이러한 사실에 착안하여 본 연구는 운동 트레이닝이 고지방식으로 유도된 비만 및 이로 인해 동반되는 인슐린 저항성에 의해 가속화되는 인지기능 및 신경병변을 완화시키는 효과가 있을 것으로 사료된다. 단, 본 연구에서는 인지 행동실험과 인슐린 신호전달 기전연구가 미흡한 실정이며, 추후 연구에서는 본 연구결과를 바탕으로 다양한 측면에서 연구가 추가되어야 할 것으로 사료된다.
결 론
본 연구에서 20주간 고지방식이 섭취는 AD 마우스의 신경병리학적 특징 중 인슐린 수용체, 시냅스 가소성의 감소와 AD 병리학적 특징, 산화스트레스를 증가시켜 AD의 병리학적 진행을 악화시키는 것으로 나타났다. 반면 운동 트레이닝은 고지방식으로 악화된 신경병리학적 특징을 전반적으로 완화시키는 것으로 나타났다. 따라서 규칙적인 운동은 AD의 유전적 요인 및 환경적 요인에서 악화되는 신경병리학적 특징들을 완화시킬 수 있을 것으로 사료된다.
Fig. 1.
Fig. 1.

Fig. 2.
Fig. 2.Effects of treadmill running on p-IRβ, IRβ in the hippocampus of HFD-induced 3xTg-AD mice. (A) Representative western blots of p-IRβ, IRβ, and β-actin of hippocampus and cerebral cortex. (B) Densitometric analysis of the western blot bands normalized to β-actin. Values are presented as mean±SD; *p<.05 for SC vs. HFD, #p<.05 for HFD vs. HFD+EXE. 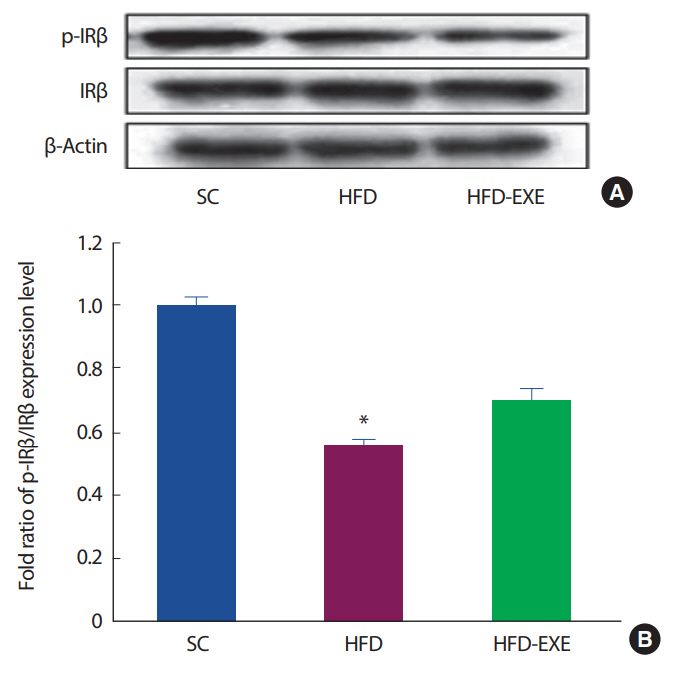
Fig. 3.
Fig. 3. Effects of treadmill running on amyloid pathology in the hippocampus of HFD-induced 3xTg-AD mice. (A) Representative microscopy of hippocampus for analysis of the presence of APP and Aβ oligomer. Quantification of APP (B) and Aβ oligomer (C) stained cells. Values are presented as mean±SD; *p<.05 for SC vs. HFD, #p<.05 for HFD vs. HFD+EXE. 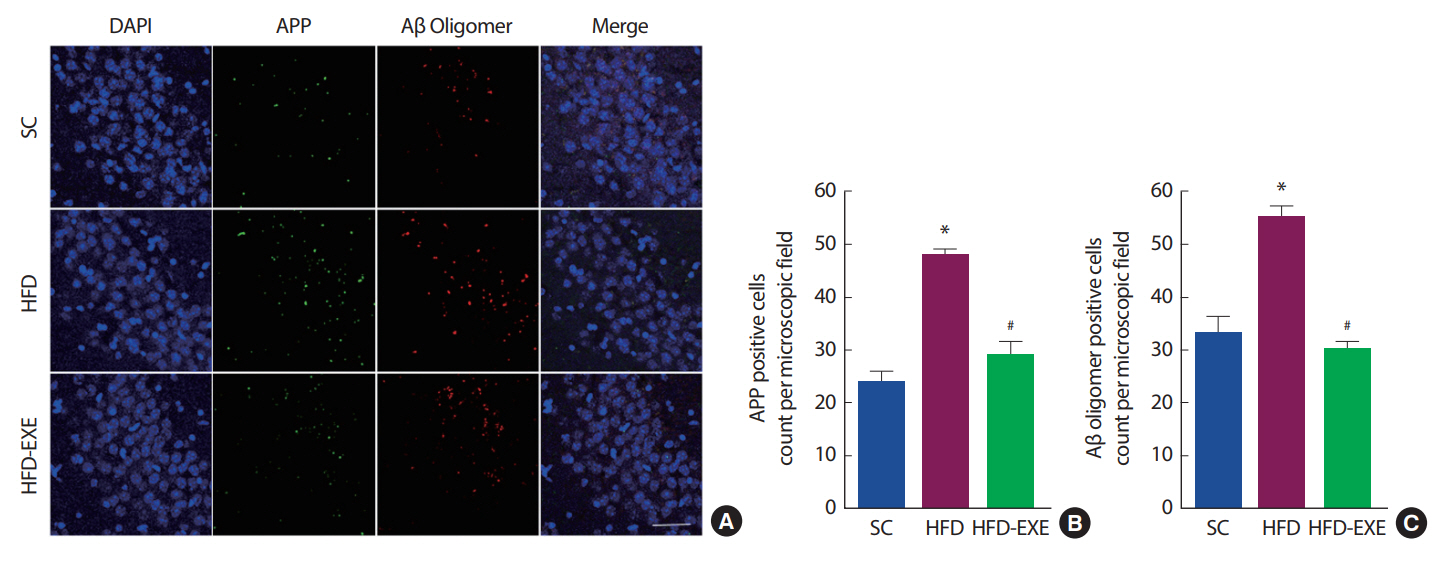
Fig. 4.
Fig. 4.Effects of treadmill running on oxidative stress in the hippocampus of HFD-induced 3xTg-AD mice. (A) Representative microscopy of hippocampus for analysis of the presence of NeuN and HNE. (B) Quantification of HNE/NeuN stained cells. Values are presented as mean±SD; *p<.05 for SC vs. HFD, #p<.05 for HFD vs. HFD+EXE. 
Fig. 5.
Fig. 5.Effects of treadmill running on synaptic plasticity in the hippocampus of HFD-induced 3xTg-AD mice. (A) Representative microscopy of hippocampus for analysis of the presence of Synaptophysin and PSD95. Quantification of Synaptophysin (B) and PSD95 (C) stained cells. Values are presented as mean±SD; *p<.05 for SC vs. HFD, #p<.05 for HFD vs. HFD+EXE. 
Fig. 6.
Fig. 6.Effects of treadmill running on cell proliferation in the hippocampus of HFD-induced 3xTg-AD mice. (A) Representative microscopy of hippocampus for analysis of the presence of NeuN and DCX. (B) Quantification of DCX/NeuN stained cells. Values are presented as mean±SD; *p<.05 for SC vs. HFD, #p<.05 for HFD vs. HFD+EXE. 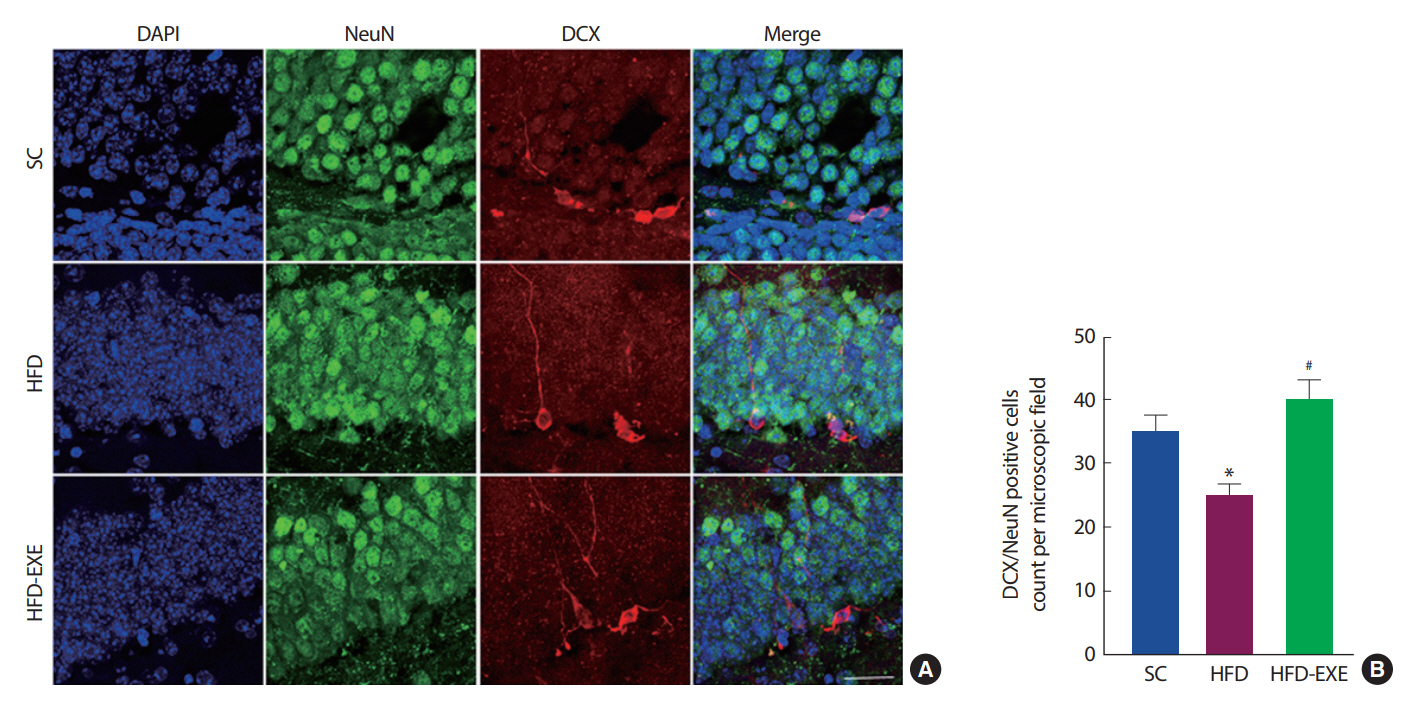
REFERENCES
1. Scheltens P, Blennow K, Breteler MM, de Strooper B, Frisoni GB, et al. Alzheimer’s disease. Lancet. 2016;388(10043):505-17.   2. Darweesh SKL, Wolters FJ, Ikram MA, de Wolf F, Bos D, et al. Inflammatory markers and the risk of dementia and Alzheimer’s disease: a meta-analysis. Alzheimers Dement. 2018;1-10.
3. Lim YY, Kalinowski P, Pietrzak RH, Laws SM, Burnham SC, et al. Association of β-amyloid and apolipoprotein E ε4 with memory decline in preclinical Alzheimer disease. JAMA Neurol. 2018;75(4):488-94.   4. Walsh DM, Selkoe DJ. A beta oligomers-a decade of discovery. J Neuroche. 2007;101(5):1172-84.  5. Hou TT, Yang HY, Wang W, Wu QQ, Tian YR, et al. Sulforaphane inhibits the generation of Amyloid-β oligomer and promotes spatial learning and memory in Alzheimer’s disease (PS1V97L) transgenic mice. J Alzheimers Dis. 2018;62(4):1803-13.   7. Wang M, Li Y, Ni C, Song G. Honokiol attenuates oligomeric Amyloid β1-42-induced Alzheimer’s disease in mice through attenuating mitochondrial apoptosis and inhibiting the nuclear factor Kappa-B signaling pathway. Cell Physiol Biochem. 2017;43(1):69-81.   9. Alford S, Patel D, Perakakis N, Mantzoros CS. Obesity as a risk factor for Alzheimer’s disease: weighing the evidence. Obes Rev. 2018;19(2):269-80.   12. Iofrida C, Daniele S, Pietrobono D, Fusi J, Galetta F, et al. Influence of physical exercise on β-amyloid, α-synuclein and tau accumulation: an in vitro model of oxidative stress in human red blood cells. Arch Ital Biol. 2017;155(1-2):33-42.  13. Birch AM, McGarry NB, Kelly AM. Short-term environmental enrichment, in the absence of exercise, improves memory, and increases NGF concentration, early neuronal survival, and synaptogenesis in the dentate gyrus in a time-dependent manner. Hippocampus. 2013;23(6):437-50.   14. Cassilhas RC, Viana VA, Grassmann V, Santos RT, Santos RF, et al. The impact of resistance exercise on the cognitive function of the elderly. Med Sci Sports Exerc. 2007;39(8):1401-7.   15. Parkhouse WS, Coupland DC, Li C, Vanderhoek KJ. IGF-1 bioavailability is increased by resistance training in older women with low bone mineral density. Mech Ageing Dev. 2000;113(2):75-83.   16. Speakman J, Hambly C, Mitchell S, Krol E. Animal models of obesity. Obes Rev. 2007;8(Suppl 1):55-61.   17. Inui A. Obesity - a chronic health problem in cloned mice? Trends Pharmacol Sci. 2003;24:77-80.   18. Cho J, Shin MK, Kim D, Lee I, Kim S, et al. Treadmill running reverses cognitive declines due to Alzheimer disease. Med Sci Sports Exerc. 2015;47(9):1814-24.   20. Shin MS, Ko IG, Kim SE, Kim BK, Kim TS, et al. Treadmill exercise ameliorates symptoms of methimazole-induced hypothyroidism through enhancing neurogenesis and suppressing apoptosis in the hippocampus of rat pups. Int J Dev Neurosci. 2013;31(3):214-23.   21. Bo H, Kang W, Jiang N, Wang X, Zhang Y, et al. Exercise-induced neuroprotection of hippocampus in APP/PS1 transgenic mice via upregulation of mitochondrial 8-oxoguanine DNA glycosylase. Oxid Med Cell Longev. 2014;834502.
24. Maesako M, Uemura K, Kubota M, Kuzuya A, Sasaki K, et al. Environmental enrichment ameliorated high-fat diet-induced Aβ deposition and memory deficit in APP transgenic mice. Neurobiol Aging. 2012;33(5):1011 e11-23.  25. Chartier-Harlin MC, Araria-Goumidi L, Lambert JC. Genetic complexity of Alzheimer’s disease. Rev Neurol. 2004;60(2):251-5.  26. Moreira RO, Campos SC, Soldera AL. Type 2 diabetes mellitus and Alzheimer’s disease: from physiopathology to treatment implications. Diabetes Metab Res Rev. 2013.
28. França MB, Lima KC, Eleutherio EC. Oxidative stress and Amyloid toxicity: insights from yeast. J Cell Biochem. 2017;118(6):1442-52.   30. Kim HJ, Kim DJ, Shin EJ, Lee BH, Choi SH, et al. Effects of gintoninenriched fraction on hippocampal cell proliferation in wild-type mice and an APPswe/PSEN-1 double Tg mouse model of Alzheimer’s disease. Neurochem Int. 2016;101:56-65.   31. Tai J, Liu W, Li Y, Li L, Hölscher C. Neuroprotective effects of a triple GLP-1/GIP/glucagon receptor agonist in the APP/PS1 transgenic mouse model of Alzheimer’s disease. Brain Res. 2018;1678:64-74.   34. Bilotta F, Lauretta MP, Tewari A, Haque M, Hara N, et al. Insulin and the brain: a sweet relationship with intensive care. J Intensive Care Med. 2017;32(1):48-58.   35. Mi Y, Qi G, Fan R, Qiao Q, Sun Y, et al. EGCG ameliorates high-fatand high-fructose-induced cognitive defects by regulating the IRS/AKT and ERK/CREB/BDNF signaling pathways in the CNS. FASEB J. 2017;31(11):4998-5011.   39. Paris D, Townsend KP, Humphrey J, Obregon DF, Yokota K, et al. Statins inhibit A beta-neurotoxicity in vitro and A beta-induced vasoconstriction and inflammation in rat aortae. Atherosclerosis. 2002;161(2):293-9.   41. Ebrahimi K, Majdi A, Baghaiee B, Hosseini SH, Sadigh-Eteghad S. Physical activity and beta-amyloid pathology in Alzheimer’s disease: A sound mind in a sound body. EXCLI J. 2017;16:959-72.   42. Gratuze M, Julien J, Morin F, Marette A, Planel E. Differential effects of voluntary treadmill exercise and caloric restriction on tau pathogenesis in a mouse model of Alzheimer’s disease-like tau pathology fed with Western diet. Prog Neuropsychopharmacol Biol Psychiatry. 2017;79:452-61.   45. Krishna K, Behnisch T, Sajikumar S. Inhibition of histone deacetylase 3 restores amyloid-β oligomer-induced plasticity deficit in hippocampal CA1 pyramidal neurons. J Alzheimers Dis. 2016;51(3):783-91.   48. Blanchard J, Bolognin S, Chohan MO, Rabe A, Iqbal K, et al. Rescue of synaptic failure and alleviation of learning and memory impairments in a trisomic mouse model of down syndrome. J Neuropathol Exp Neurol. 2011;70(12):1070-9.   49. Kim D, Cho J, Lee I, Jin Y, Kang H. Exercise attenuates high-fat dietinduced disease progression in 3xTg-AD Mice. Med Sci Sports Exerc. 2017;49(4):676-86.  
|
|











