AbstractPURPOSEThe mechanisms underlying the protective effects of exercise training against cognitive decline are not fully understood. This study aimed to investigate the effects of treadmill running on oxidative stress and heat shock protein levels in a mouse model of early stage triple transgenic Alzheimer’s disease (3xTg-AD).
METHODSWe divided 5-month old 3xTg-AD mice (N=20) into the control (AD+CON, n=10) and exercise training (AD+EX, n=10) groups. Background strain mice were included as wild-type controls (WT, n=10). AD+EX mice were subjected to treadmill running at a speed of 15 m/min, 50 min/day, 5 days/week for 12 weeks.
RESULTSTreadmill running protected 3xTg-AD mice from cognitive decline and significantly suppressed the increase in soluble Aβ1-42 protein levels (AD+CON vs AD+EX, p=0.015) and the progression of oxidative damage. This was evidenced by significant increase in anti-oxidative protein levels such as superoxide dismutase-1 (SOD-1), heme oxygenase (HO-1) and heat shock protein 70 (HSP70) in the hippocampus of AD+EX mice compared to AD+CON mice. Moreover, the brain-derived neurotrophic factor (BDNF) and synaptic proteins such as PSD95 and synaptophysin were upregulated in AD+EX mice compared to AD+CON mice.
서 론노인에서 가장 흔한 치매 형태인 알츠하이머 질환(Alzheimer’s disease, AD)은 해마(hippocampus)와 대뇌 피질(cerebral cortex)의 시냅스와 신경 손상으로 인한 기억력 감퇴와 인지 기능 저하를 특징으로 갖는 대표적인 신경퇴행성 질환이다[1-3]. 우리나라의 치매 유병률은 65세 이상 노인의 약 9.5-13%인 것으로 보고되고 있으며, 노인 인구 증가로 인한 인구의 고령화를 고려할 때 향후 알츠하이머 질환을 포함한 치매 유병률은 급증할 것으로 예견된다[4]. 그러나 현재까지 알츠하이머 질환의 정확한 발병 기전이나 효과적인 치료 약물이 명확하게 규명되어 있지 않기 때문에 독립적인 생활이 가능한 알츠하이머 질환의 초기 단계인 경도인지장애 단계에서 병리학적인 진행이 악화되는 것을 최소화하여 질병을 완화시키는 것이 최선책인 것으로 간주된다.
현재까지 알려진 알츠하이머 질환의 병리학적인 가장 큰 특징은 해마와 대뇌피질의 신경세포 밖에 아밀로이드 베타(amyloid beta) 단백질로 구성된 노인판(senile plaque)의 축적[5]과 신경세포 안쪽으로는 타우 단백질의 과인산화(hyperphosphorylated Tau)로 인한 신경섬유농 축제(neurofibrillary tangles) 축적으로 인해 뇌 신경세포에 독성을 유발하는 것으로 보고되며[6], 이는 신경세포의 기능 부전과 신경세포 사멸을 유도하고 결과적으로 인지 기능을 감퇴시켜 알츠하이머 질환이 발병하는 것으로 알려진다. 최근 연구에 의하면 아밀로이드 베타 단백질의 비정상적인 접힘(misfolding)과 단백질의 응축은 시냅스 손실과 신경세포의 사멸에 원인이 되어 신경 퇴행성 질환과 연관성이 있는 것으로 보고한다[7].
열 쇼크 단백질(heat shock protein; HSP)은 C 말단 도메인을 통해 단백질들이 부적절한 변성, 접힘 및 접합을 방지하고 적절한 3차 구조를 갖도록 도와주는 샤페론(cheparones)의 기능을 통해 세포가 받는 다양한 스트레스 상황으로부터 이를 보호하기 위해 증가되는 단백질이다[8,9]. HSP 70은 대부분의 세포 종류에서 존재하며 HSP 70단백질의 과발현은 세포사멸 억제와 면역반응을 유도하는 것으로 보고된다[10]. 최근 선행연구에 의하면 APPsw 마우스 모델에 HSP70유전자를 과발현 시켰을 때, 아밀로이드 베타 degradation 효소를 증가시켜 아밀로이드 베타 플라크의 응축을 억제하면서 신경세포를 보호하는 효과를 내는 것으로 보고했다[11].
한편, 산화스트레스(oxidative stress)는 미토콘드리아 기능 장애와 더불어 신경세포 사멸에 중요한 메커니즘으로 보고된다[12,13]. 선행 연구에 의하면 경도인지장애 환자의 뇌와 혈액 및 적혈구에서 산화 스트레스 마커들이 증가되는 것을 확인하였고 알츠하이머 형 동물 모델에서도 아밀로이드 베타 축적 이전에 산화 스트레스가 증가하는 것으로 보고했다[14,15]. 즉, 산화 스트레스는 알츠하이머의 병리학적인 초기 단계에서 발생하며 산화스트레스로 인한 항산화 방어 기작의 고갈은 질병의 진행을 가속화 시키는 것과 관련 있는 것으로 추측된다.
운동을 포함한 건강한 생활습관 중재는 퇴행성 뇌질환의 기억력 및 인지 기능 감소를 완화시키는 것으로 알려진다[16-18]. 선행 연구에 의하면 알츠하이머형 마우스에 트레드밀 운동은 아밀로이드 베타와 pTau 감소를 통해 알츠하이머의 병리학적 진행을 억제하는 것으로 나타났고, 신경성장인자(nerve growth factor, NGF) 및 시냅스 가소성(synapse plasticity)를 증가시켜 신경세포 사멸을 억제하여 결과적으로 인지 기능 저하를 억제하는 것으로 보고했다[16,18,19]. 그러나 현재까지 트레드밀 운동이 알츠하이머 초기 단계 해마의 HSP 70단백질 변화에 대해 알려진 바가 거의 없다. 따라서 본 연구는 사람의 알츠하이머 질환의 병리학적 특성을 가장 유사하게 가지고 있는 알츠하이머 형 마우스 3xTg-AD를 이용하였고, 뇌의 부위 중 기억과 인지 기능을 담당하는 해마 조직을 이용하여 12주간 트레드밀 운동이 알츠하이머 초기 단계에 인지 기능 및 산화성 스트레스 단백질과 HSP70 단백질 발현에 미치는 영향을 규명하는 것을 목적으로 하였다.
연구 방법1. 실험동물실험 동물은 APPSwedish, PS1M146V, tauP301L의 세 가지 돌연변이 유전자를 가진 20주령 알츠하이머형 모델 수컷 마우스(3xTg-AD mice)를 사용하였으며[20], 비형질 전환 마우스(non-Tg mice)는 16주령의 C57BL/6 수컷 마우스를 오리엔트(ORIENT Bio, Suwon, Korea)에서 공급받아 사용하였다. 마우스는 케이지 당 5마리씩 넣어 사육하고 식이와 수분 섭취는 자유롭게 할 수 있도록 하였다. 실험 동물의 사육실 온도는 20-22°C로 유지하였고, 명기와 암기는 각각 12시간으로 조절하였다. 본 연구는 AAALAC International (Association for Assessment and Accreditation of Laboratory Animal Care International) 인증기관인 성균관대학교 의과대학 실험동물운영위원회(IACUC)의 검토와 승인을 거쳤으며, 위원회는 실험동물의 관리와 사용에 관한 지침을 준수하며 시행하였다.
2. 연구방법1) 연구 설계 및 운동 프로그램총 20마리의 20주령 알츠하이머형 모델 마우스를 무작위로 비운동 그룹(Tg+CON, n =10)과 운동 그룹(Tg+EX, n =10)으로 나누고, 실험의 대조군으로 C57BL/6 (n =10) 마우스를 사용하였다.
운동 트레이닝은 트레드밀(Columbus Instruments, Inc., Columbus, OH)을 이용하여 12주간 주당 5회 중강도 운동을 실시하였다. 운동 집단은 2주간 적응 기간을 거쳐 트레드밀 속도와 운동 시간을 점증적으로 증가시켜 3주차에는 15 m/min의 속도로 50분간 본 운동을 하였고, 본 운동 시작 전과 후에 각각 준비운동과 정리운동을 8 m/min의 속도로 실시하였다.
2) 행동 테스트(Novel object test)신물질탐색 테스트(novel object test)는 마우스가 친숙한 것보다 새로운 물체를 탐색하는데 더 많은 시간을 보내는 특성을 이용하여 인지기능 및 기억능력을 평가하는 행동실험이다. 본 연구에서는 Leger et al. [21]의 프로토콜을 수정하여 사용하였다. 행동테스트는 적응기, 탐색기 및 신물질 인식기로 세 단계로 진행되었다. 첫째 날 빈 정사각형의 개방장(33×33×20 cm)을 놓고 10분간 적응을 시킨 후 둘째 날 두 개의 동일한 물체를 일정한 간격으로 설치하여 5분간 탐색하게 하였다. 셋째 날 설치한 물체 중 하나는 새로운 물체로 대체하고 1분간 움직임을 측정하였다. 각 물체를 탐색하는데 소요된 시간을 백분율로 기록하였다.
3) 조직 적출동물 행동 실험이 끝난 뒤 졸레틸(Zoletil)과 럼푼(Rompun)을 이용하여 마취시킨 뒤, 완충 식염수를 주입하여 혈액을 제거한 후, 4%paraformaldehyde (PFA) 고정액을 관류하였다. 두개골을 제거한 뒤 뇌를 적출한 후 고정액에 담아 24시간 냉장 보관하였다. 고정된 조직은 30% sucrose용액에 3일간 침적 시킨 후, Cryostat (Leica, Nussloch, Germany)를 이용하여 50 μm두께로 절편을 제작하였다. Western blot을 수행하기 위한 단백질은 완충 식염수를 주입하여 혈액을 제거한 후 적출한 뇌를 분석 시까지 -80°C의 초저온 냉동기에 냉동 보관하였다.
4) Amyloid-β ELISA해마 조직의 soluble Aβ1-40과 Aβ1-42 단백질 수준은 ELISA 키트(IBL, Minneapolis, MN, USA)를 이용하여 측정하였다. 먼저, anti-human Aβ mouse IgG monoclonal antibody와 anti-human Aβ rabbit IgG가 코팅되어 있는 플레이트에 희석된 standard와 해마 단백질 샘플을 4°C에서 12시간 반응시킨 후 5번 세척하여 HRP conjugated anti-human Aβ mouse IgG를 4°C에서 1시간 반응시킨다. 항체를 세척한 후 TMB용액에 30분 실온에서 반응하여 1N H2SO4 용액으로 반응을 멈춘 후 ELISA reader (Tecan Systems, Inc., San Jose, CA, USA)를 이용하여 450 nm에서 흡광도를 측정하였다.
5) Western blot해마 조직의 단백질량을 Bradford 시약을 이용하여 농도를 잰 후 20μg의 단백질 샘플을 만든 후 10-12% SDS-Polyacrylamide gel에서 전기영동 후 PVDF membrane으로 전이 시켰다. 이후 단백질이 전이된 membrane을 5% skim milk/TBST용액으로 1시간 반응 한 후 1차 항체 rabbit anti-HSP70 (1:300, cell signaling, Beverly, MA), rabbit anti-SOD1 (1:300, abcam), mouse anti-HO1 (1:300, abcam), rabbit anti-BDNF (1:200, abcam), rabbit anti-PSD95 (1:200, abcam), rabbit anti-synaptophysin (1:200, abcam)를 4°C에서 12시간 반응시켰다. 그 다음 TBST용액으로 10분씩 3번 washing 한 뒤 2차 항체를 상온에서 한시간 반응 시킨 후 TBST용액으로 10분씩 3번 다시 washing후 ECL을 이용하여 필름에 발색 하였다. 필름에 발색된 밴드는 Image J (National Institutes of Health, Bethesda, MD)를 이용하여 단백질을 정량 하였다.
연구 결과1. 트레드밀 운동이 알츠하이머형 마우스의 인지 기능에 미치는 영향12주간의 트레드밀 운동 후 알츠하이머형 마우스의 인지 기능에 미치는 영향을 확인하기 위해 신 물질 탐색 테스트를 실시하였다. 그 결과 WT 그룹의 마우스의 경우 새로운 물체 주변에서 더 많은 시간을 보내는 것으로 나타났으나(Object vs. Novel, p = 0.001), AD+CON 그룹의 경우 새로운 물체 주변에서 보낸 시간이 기존 물체에서 보낸 시간과 통계학적으로 유의한 차이가 없는 것으로 나타났다. 즉, AD+CON 그룹 마우스의 경우 새로운 물체를 인지하는 능력이 거의 없는 것으로 나타났다(Fig. 1A, B). 그러나 12주간 트레드밀 운동을 한 그룹의 경우 새로운 물체 주변에서 보낸 시간이 기존 물체에서 보낸 시간에 비해 통계학적으로 유의하게 증가된 것으로 나타났다(Object vs. Novel, p =.020). Fig. 1B는 새로운 물체 주변에서 보낸 시간을 백분율로 나타낸 것이다(WT vs. AD+CON, p=.001; AD+CON vs. AD+EX, p=.031). 즉, 12주간 트레드밀 운동은 초기 AD마우스의 인지 기능 감소를 억제한 것으로 사료된다(Fig. 1A, B).
2. 트레드밀 운동이 알츠하이머형 마우스 해마의 수용성 Aβ 단백질에 미치는 영향수용성 Aβ는 Aβ plaque 축적보다 독성이 더 크고 시냅스를 손상시켜 알츠하이머의 병리학적 진행을 가속화는 것으로 알려지기에 본 연구에서는 12주간 운동 트레이닝이 해마의 수용성 Aβ1-40과 수용성 Aβ1-42에 미치는 영향을 확인하였다. 그 결과 WT 그룹에 비해 AD+CON 그룹 마우스 해마의 수용성 Aβ1-40 (WT vs. AD+CON, p=.041)과 Aβ1-42 (WT vs. AD+CON, p=.030)의 단백질 수준이 증가한 것으로 나타났다. 12주간 트레드밀 운동은 알츠하이머 형 마우스의 해마의 수용성 Aβ1-42의 단백질 수준의 증가를 유의하게 억제하는 것으로 나타났으나(AD+CON vs. AD+EX, p=.015) 수용성 Aβ1-40는 통계학적으로 유의한 변화가 없었다(Fig. 2).
3. 트레드밀 운동이 해마의 시냅스 단백질 발현과 신경 영양 인자에 미치는 영향12주간 운동 트레이닝이 신경세포 간 신호전달의 구조로 작용하는 신경가소성에 영향을 주었는지 알아보기 위해 시냅스 전과 시냅스 후 단백질인 PSD95 단백질과 synaptophysin 단백질 발현을 해마에서 관찰하였다. 그 결과 WT과 AD+CON 그룹은 PSD95와 synaptophysin 단백질에 통계학적인 유의한 변화는 없었다. 그러나 12주간 운동 트레이닝은 synaptophysin 단백질을 AD+CON에 비해 유의하게 증가시킨 것으로 나타났다(Fig. 3A-C). 또한, 트레드밀 운동이 해마의 신경 영양 인자 발현에 미치는 영향을 알아보기 위해 BDNF 단백질을 관찰하였다(Fig. 3). 그 결과, WT 그룹에 비해 AD+CON 그룹의 BDNF 발현이 감소하는 것으로 나타났으나 12주간 트레드밀 운동은 AD+CON 그룹에 비해 BDNF의 발현을 통계학적으로 유의하게 증가시키는 것으로 나타났다(Fig. 3A,D).
논 의본 연구는 알츠하이머 형 마우스인 3xTg-AD 마우스를 이용하여 12주간 트레드밀 운동이 알츠하이머 초기단계에 인지 기능과 산화성 스트레스 및 열쇼크 단백질 발현에 미치는 영향을 확인하여 알츠하이머 초기단계에 병리학적 진행을 최소화 하는데 있어 운동의 역할을 규명하고자 하였다. 그 결과 12주간 트레드밀 운동은 알츠하이머 초기단계 3xTg-AD 마우스의 인지 기능 저하를 억제하고 해마의 수용성 Aβ1-42 단백질을 감소시키는 것으로 나타났다. 또한 해마의 시냅스 단백질과 신경 영양 인자의 감소를 억제하는 것으로 나타났으며 항산화 관련 단백질과 HSP70 단백질의 감소를 억제하는 것으로 나타났다.
선행연구에 의하면 운동은 아밀로이드 베타의 축적을 억제하여 알츠하이머의 병리학적인 악화를 완화시킨다고 보고하였다[16]. Liu et al. [22]의 연구에 의하면 초기 APP/PS1 알츠하이머형 마우스를 이용하여 5개월간 트레드밀 운동을 중재한 결과 해마의 수용성 아밀로이드 베타 단백질 양과 아밀로이드 베타 축적 양의 감소를 통해 인지 기능이 향상된 것으로 보고하였다. Zhao et al. [23]의 연구에 의하면 후기 APP/PS1 알츠하이머형 마우스를 이용하여 5개월간 트레드밀 운동을 중재한 결과 해마의 수용성 아밀로이드 베타 단백질 양이 감소하는 것으로 나타났으나 아밀로이드 베타 축적 양은 변함이 없는 것으로 나타났다. Cho et al. [16]의 연구에서도 트레드밀 운동은 알츠하이머 초기와 말기 마우스 모델 모두에서 수용성 Aβ단백질 양과 아밀로이드 베타 축적을 억제하여 인지 기능의 악화를 억제하는 것으로 보고했다. 이와 유사하게 본 연구의 결과도 12주간 트레드밀 운동은 수용성 아밀로이드 베타 단백질의 증가를 억제하는 것으로 나타났다. 수용성 아밀로이드 베타는 시냅스의 독성을 일으켜 인지 기능을 악화시키는 것으로 보고되는데 운동은 수용성 아밀로이드 베타의 단백질 양의 증가를 억제하여 시냅스가소성의 기능 저하를 완화시키는 것으로 사료된다.
산화성 스트레스는 뇌의 시냅스 가소성에 부정적인 영향을 주는 요인 중 하나로 산화성 스트레스에 의해 증가하는 reactive oxygen species (ROS)는 미토콘드리아의 기능의 상실을 유도하고, 항산화 반응을 저하시켜 시냅스 가소성과 신경세포들 사이에 신호를 전달하는 신경전달(neurotransmission)에 이상을 일으켜 노화와 알츠하이머를 포함한 신경퇴행성 질환을 가속화 하는 것으로 알려진다[2,14]. Mota 등[15]의 연구에 의하면 3개월 3xTg-AD 마우스 대뇌피질과 경도인지장애를 가진 사람 혈액의 peripheral blood mononuclear cells (PBMC)에서 항산화 단백질인 SOD1과 HO-1의 발현이 낮아지는데 이는 알츠하이머 초기 산화성 스트레스와 관련 있다고 보고 하였고, Tg2576 마우스를 이용한 Apelt et al. [14]의 연구에 의하면 산화성 스트레스의 증가는 아밀로이드 베타의 축적 증가와 상관관계가 있다고 보고하였다. 본 연구의 결과도 이와 유사하게 8개월 3xTg-AD마우스의 경우 대조군 WT마우스에 비해 해마의 항산화 단백질이 감소된 것으로 나타나 초기 알츠하이머 모델 마우스의 항산화 스트레스 증가와 아밀로이드 베타 축적의 증가로 인해 인지 기능이 감소되는 것으로 사료된다.
운동 트레이닝은 알츠하이머 질환에 항산화 기능을 유도해 학습과 기억을 향상시키고 ROS의 증가를 억제하며 신경 영양 인자를 증가시키는 것으로 보고된다. Belviranli et al. [18]의 연구에 의하면 D-galactose/AlCl3을 주입하여 인지 기능 저하가 유도된 알츠하이머 동물 모델을 이용하여 자발적 운동과 수영 운동을 12주동안 중재했을 때, 자발적 운동과 수영 운동 모두에서 해마의BDNF와 NGF 단백질 양이 증가되는 것으로 나타났고, 산화성 스트레스 마커인 MDA (malodialdehyde)는 감소시키고 항산화 마커인 SOD (superoxide dismutase)와 GSH (glutathione) 수준은 증가시키는 것으로 보고했다. Lu et al. [19]의 연구에 의하면 streptozotocin으로 유도된 알츠하이머 랫 모델에 트레드밀 운동을 4주간 처치하였더니 산화성 스트레스가 감소되고 미토콘드리아의 기능 이상을 최소화 시키면서 인지 기능을 향상시키는 것으로 보고했다. 선행 연구를 종합해보면 알츠하이머 초기에 트레드밀 운동은 항산화 효과를 일으켜 초기 인지 기능 저하를 완화시키는 것으로 추측되고 알츠하이머 말기에 운동이 아밀로이드 베타 축적의 감소에 영향을 미치지 않는 것을 볼 때 초기 알츠하이머의 산화성 스트레스를 억제하는 것이 병리학적인 진행을 최소화 하는데 효과적일 것으로 사료된다.
HSP70 단백질은 운동에 의해 그 양이 증가되는 것으로 NSE/APPsw 마우스 모델과 Tg-NSE/hPS2m 마우스 모델을 이용한 실험에서 보고되었다[11,24]. Hoshino et al. [11]의 연구에 의하면 APPsw/HSP70유전자 변형 마우스는 수용성 아밀로이드 베타와 아밀로이드 베타 플라크의 축적이 APPsw마우스에 비해 감소한 것으로 나타났다. Moore et al. [24]의 연구에 의하면 12주령 Tg2576마우스를 트레드밀 속도에 따라세 그룹으로 나누어 하루 60분씩 12주간 운동을 실시했을 때 운동강도가 높을수록 HSP70단백질 농도가 증가하는 것으로 나타났다. 즉, 초기 알츠하이머 모델에 운동 처치에 의해 HSP70단백질의 증가는 아밀로이드 베타 축적을 감소시켜 인지 기능의 감소를 억제할 것으로 사료된다.
본 연구는 사람의 알츠하이머 병리학적 특징과 가장 유사한 3xTg-AD마우스 모델을 이용하여 운동이 항산화 단백질과 HSP70단백질에 긍정적인 영향을 주어 인지 기능 저하를 억제한다는 것을 밝혀 기존의 선행연구 결과를 확장했다는 점에서 연구의 의의가 있다.
Fig. 1.Fig. 1.Effect of treadmill running on Novel object recognition test. (A) Data are the mean exploration time of the Novel object during training and test session. (B) The percentage of time spent in the novel object. Values are means±SD. *p<.05 in spending time in Object vs. Novel; † p<.05 in WT vs AD+CON; ‡ p<.05 in AD+CON vs. AD+EX. 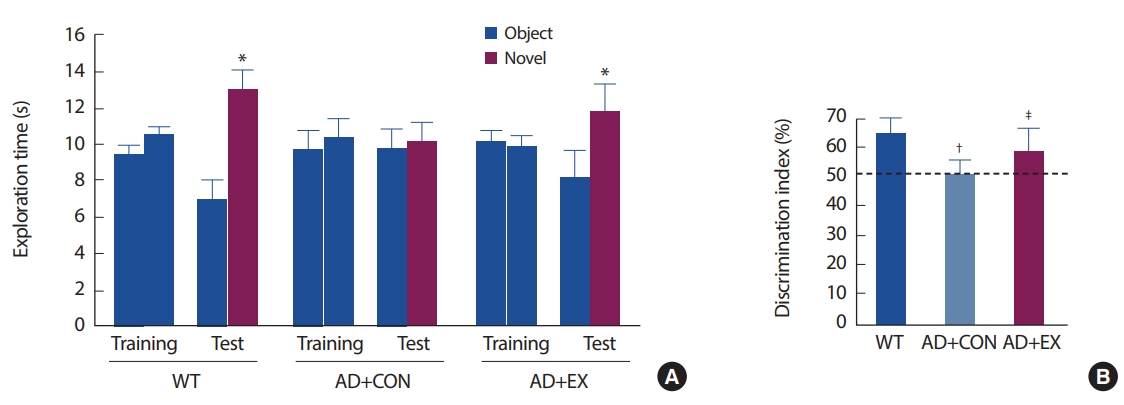
Fig. 2.Fig. 2. Effect of treadmill running on soluble Aβ1-42 and Aβ1-42 in the hippocampus. Values are means±SD. *p<.05 in WT vs. AD+CON; † p<.05 in AD+CON vs. AD+EX. 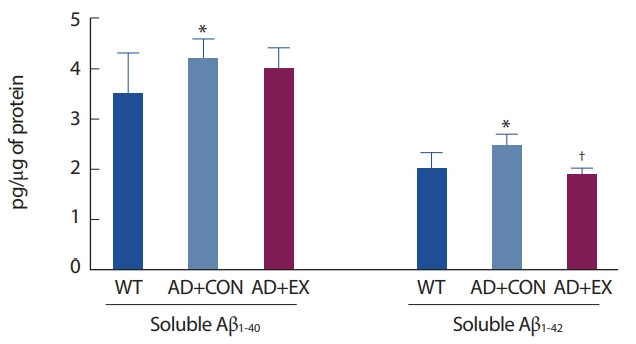
REFERENCES1. Scheltens P, Blennow K, Breteler MM, de Strooper B, Frisoni GB, Salloway S, et al. Alzheimer’s disease. Lancet. 2016;388(10043):505-17.
2. DeKosky ST, Scheff SW. Synapse loss in frontal cortex biopsies in Alzheimer’s disease: correlation with cognitive severity. Ann Neurol. 1990;27(5):457-64.
3. Davies CA, Mann DM, Sumpter PQ, Yates PO. A quantitative morphometric analysis of the neuronal and synaptic content of the frontal and temporal cortex in patients with Alzheimer’s disease. J Neurol Sci. 1987;78(2):151-64.
4. Kim YJ, Han JW, So YS, Seo JY, Kim KY, Kim KW. Prevalence and trends of dementia in Korea: a systematic review and meta-analysis. J Korean Med Sci. 2014;29(7):903-12.
5. Lim YY, Kalinowski P, Pietrzak RH, Laws SM, Burnham SC, Ames D, et al. Association of beta-Amyloid and Apolipoprotein E epsilon4 With Memory Decline in Preclinical Alzheimer Disease. JAMA Neurol. 2018;75(4):488-94.
6. Chong FP, Ng KY, Koh RY, Chye SM. Tau Proteins and Tauopathies in Alzheimer’s Disease. Cell Mol Neurobiol. 2018;38(5):965-80.
7. Maiti P, Manna J, Veleri S, Frautschy S. Molecular chaperone dysfunction in neurodegenerative diseases and effects of curcumin. Biomed Res Int. 2014;2014:495091.
8. Kakkar V, Meister-Broekema M, Minoia M, Carra S, Kampinga HH. Barcoding heat shock proteins to human diseases: looking beyond the heat shock response. Dis Model Mech. 2014;7(4):421-34.
9. Ellis RJ. Molecular chaperones: assisting assembly in addition to folding. Trends Biochem Sci. 2006;31(7):395-401.
10. Schmitt E, Parcellier A, Gurbuxani S, Cande C, Hammann A, Morales MC, et al. Chemosensitization by a non-apoptogenic heat shock protein 70-binding apoptosis-inducing factor mutant. Cancer Res. 2003;63(23):8233-40.
11. Hoshino T, Murao N, Namba T, Takehara M, Adachi H, Katsuno M, et al. Suppression of Alzheimer’s disease-related phenotypes by expression of heat shock protein 70 in mice. J Neurosci. 2011;31(14):5225-34.
12. Tonnies E, Trushina E. Oxidative Stress, Synaptic Dysfunction, and Alzheimer’s Disease. J Alzheimers Dis. 2017;57(4):1105-21.
13. Kamat PK, Kalani A, Rai S, Swarnkar S, Tota S, Nath C, et al. Mechanism of Oxidative Stress and Synapse Dysfunction in the Pathogenesis of Alzheimer’s Disease: Understanding the Therapeutics Strategies. Mol Neurobiol. 2016;53(1):648-61.
14. Apelt J, Bigl M, Wunderlich P, Schliebs R. Aging-related increase in oxidative stress correlates with developmental pattern of beta-secretase activity and beta-amyloid plaque formation in transgenic Tg2576 mice with Alzheimer-like pathology. Int J Dev Neurosci. 2004;22(7):475-84.
15. Mota SI, Costa RO, Ferreira IL, Santana I, Caldeira GL, Padovano C, et al. Oxidative stress involving changes in Nrf2 and ER stress in early stages of Alzheimer’s disease. Biochim Biophys Acta. 2015;1852(7):1428-41.
16. Cho J, Shin MK, Kim D, Lee I, Kim S, Kang H. Treadmill Running Reverses Cognitive Declines due to Alzheimer Disease. Med Sci Sports Exerc. 2015;47(9):1814-24.
17. Wu C, Yang L, Tucker D, Dong Y, Zhu L, Duan R, et al. Beneficial Effects of Exercise Pretreatment in a Sporadic Alzheimer’s Rat Model. Med Sci Sports Exerc. 2018;50(5):945-56.
18. Belviranli M, Okudan N. Voluntary, involuntary and forced exercises almost equally reverse behavioral impairment by regulating hippocampal neurotrophic factors and oxidative stress in experimental Alzheimer’s disease model. Behav Brain Res. 2019;364:245-55.
19. Lu Y, Dong Y, Tucker D, Wang R, Ahmed ME, Brann D, et al. Treadmill Exercise Exerts Neuroprotection and Regulates Microglial Polarization and Oxidative Stress in a Streptozotocin-Induced Rat Model of Sporadic Alzheimer’s Disease. J Alzheimers Dis. 2017;56(4):1469-84.
20. Oddo S, Caccamo A, Shepherd JD, Murphy MP, Golde TE, Kayed R, et al. Triple-transgenic model of Alzheimer’s disease with plaques and tangles: intracellular Abeta and synaptic dysfunction. Neuron. 2003;39(3):409-21.
21. Leger M, Quiedeville A, Bouet V, Haelewyn B, Boulouard M, Schumann-Bard P, et al. Object recognition test in mice. Nat Protoc. 2013;8(12):2531-7.
22. Liu HL, Zhao G, Zhang H, Shi LD. Long-term treadmill exercise inhibits the progression of Alzheimer’s disease-like neuropathology in the hippocampus of APP/PS1 transgenic mice. Behav Brain Res. 2013;256:261-72.
|
|
|||||||||||||||||||||||||||||||||||||