트레드밀 운동과 비타민D 복합처치가 고지방식으로 유도된 비만 마우스의 골격근 형태와 미토콘드리아 다이나믹스에 미치는 영향
Abstract
PURPOSE
The study aimed to investigate the effects of treadmill running and intraperitoneal vitamin D administration on the changes in skeletal muscle morphology and mitochondrial dynamics induced by a high-fat diet (HFD) in C57BL/6 mice.
METHODS
Fifty 5-week-old C57BL/6 mice were randomly assigned to either standard chow (SC, n=10) or HFD (n=40), and the ani-mals were maintained on each diet for 12 weeks. During the final 6 weeks on these diet, the HFD mice were further divided into four subgroups: HFD only (n=10), HFD plus treadmill running (HFD+EX, n=10), HFD plus vitamin D administration (HFD+VD, n=10), and HFD plus treadmill running plus vitamin D administration (HFD+VD+EX, n=10). The morphology and mitochondrial dynamics markers of the gastrocnemius were assessed with immunohistochemistry and western blot, respectively.
RESULTS
HFD resulted in morphological alterations in the muscle, such as decreased myocyte cross-sectional area and increased extramyocyte space. However, the HFD-induced morphological alterations were reversed by the combination of treadmill running and vitamin D administration (HFD vs. HFD+VD+EX). Furthermore, the combined treatment of treadmill running and vitamin D improved mitochondrial dynamics signaling pathways, such as mitochondrial fusion, fission, mitophagy, and mitochondria-mediated skeletal muscle apoptosis.
CONCLUSIONS
The findings of the study suggest that a combination of exercise and vitamin D supplementation might be an effective therapeutic strategy against HFD-induced morphological alterations and mitochondrial dysfunctions in skeletal muscle.
Keywords: Obesity, Mitochondria, Exercise, vitamin D, High-fat diet
색인어: 비만, 미토콘드리아, 운동, 비타민 D, 고지방식이
서 론
현대사회에 식생활의 서구화와 신체 활동 부족 등으로 인한 과체중 및 비만은 인슐린 저항성(insulin resistance)을 포함하는 대사 장애 (metabolic disorders)와 밀접하게 연관된 것으로 알려진다[ 1]. 일반적으로 인슐린은 간, 근육, 지방 조직과 같은 인슐린 감수성 조직에서 포도당과 지질 대사를 통하여 혈당을 조절하는 역할을 하며, 인슐린 저항성은 이러한 인슐린 감수성 조직에 대한 인슐린의 작용이 감소되어 혈액 중의 포도당을 효과적으로 연소하지 못하는 상태를 의미한다. 결과적으로 비만 관련 인슐린 저항성은 근육, 간 등의 표적 조직에서 인슐린의 혈당 항상성 조절 기능 장애를 유도함으로서 혈당 상승과 고혈압, 이상지질혈증에 의한 제2형 당뇨병과 심혈관질환을 발생시키는 것으로 보고되고 있다[ 2]. 한편, 최근 골격근 미토콘드리아의 형태 및 기능 이상이 제2형 당뇨병, 비만 및 인슐린 저항성과 관련성이 보고되고 있다[ 3– 6]. 일반적으로 골격근은 인슐린에 의해 흡수된 포도당과 더불어 혈중 지방산을 에너지 대사의 주요한 원료로 이용하며, 이러한 과정은 미토콘드리아에서 산화적 인산화 과정을 통해 ATP를 생산하는 것으로 알려져 있다[ 7]. 한편 비만은 지방산 산화능력이 감소됨에 따라 long-chain fatty acyl-CoA (LCFA-CoA)와 diacylglycerol (DAG)과 같은 대사성 지질 산물이 축적되고, 이는 미토콘드리아의 과부하(mitochondrial overload)를 발생시켜 불완전한 지방산 산화 유발 및 미토콘드리아의 산화 스트레스를 유발하고 결과적으로 인슐린 신호전달 체계를 방해하게 된다. 과도한 세포 스트레스는 미토콘드리아의 막 전위를 상실시켜서 미토콘드리아를 매개로 한 세포 사멸 신호가 활성화됨으로써 골격근의 위축과 함께 대사 장애를 유발한다[ 8]. 따라서 비만으로 인한 골격근 미토콘드리아 구조 및 기능 이상은 인슐린 저항성을 유발하여 혈당 상승과 고혈압, 이상지질혈증에 의한 제2형 당뇨병과 심혈관질환을 발생시키는 주요 요인으로 보고되고 있다[ 9]. 운동은 심혈관질환, 대사 증후군, 당뇨병 등 다양한 대사 질환을 예방하고 치료할 수 있는 효과적인 비약물적 수단으로, 그 효과가 입증되었다[ 10, 11]. 이러한 운동의 대사 조절 효과는 골격근의 포도당 및 지질 대사의 항상성 조절로 설명되는데, 구체적으로, 규칙적 운동은 골격근의 insulin-regulated glucose transporter (GLUT4) 수용체의 발현을 증가시켜 포도당 흡수를 증가시킴으로써 당 내성과 인슐린 감수성을 증가시켜 혈당을 조절하고, 골격근의 산화 능력을 향상시켜서 세포 내 지질 대사를 조절하는 것으로 알려져 있다[ 12]. 특히, 이러한 포도당 및 지질 대사 조절에 대한 운동의 효과는 잠재적으로 미토콘드리아의 기능 및 구조 개선에 기인한다. 구체적으로, 운동은 AMP-activated pro-tein kinase (AMPK) 신호전달 경로를 활성화하여 미토콘드리아의 생합성(biogenesis)을 촉진함으로써 미토콘드리아의 수를 증가시키고, 지방 대사를 촉진하는 것으로 알려져 있다. 이와 더불어 운동은 미토콘드리아의 융합(fusion), 분열(fission), 마이토파지(mitophagy) 등의 형태 변화 조절을 통한 미토콘드리아의 양적, 질적 기능을 높은 수준으로 유지시켜 세포 대사 항상성을 조절하는 것으로 보고된다[ 12]. 한편, 운동과 더불어 비타민 D는 인슐린 저항성 및 제2형 당뇨병의 개선 방안으로 관심을 받고 있다. 일반적으로 비타민 D는 음식물을 통한 섭취 혹은 햇빛의 자외선 노출에 의해 피부에서 합성되어 간에서 25-hydroxyvitamin D 3 (25-(OH)D 3)로 전환된 후 신장에서 활성형인 1,25-dihydroxyvitamin D 3 (1,25-(OH)2 D 3)로 전환되어 여러 대사 조절에 관여하는 것으로 알려져 있다[ 13]. 비타민 D 결핍과 제2형 당뇨 및 심혈관질환 등을 동반한 대사 합병증과의 연관성이 여러 선행 연구에서 보고됨에 따라, 비만으로 인한 대사 질환 개선을 위한 적절한 비타민 D 섭취의 중요성이 강조되고 있다[ 14, 15]. 구체적으로, 비타민 D는 칼슘 대사와 더불어 인슐린의 합성과 분비 및 인슐린 감수성 증가를 통한 포도당 대사 조절에 관여하는 것으로 보고되고 있으며[ 16], 비만 지방 세포에서의 염증성 사이토카인의 분비를 조절하여 염증을 억제[ 17]하는 것으로 보고된다. 또한, 비타민 D는 단백질 합성과 골격근 미토콘드리아의 기능 조절을 통하여 골격근 기능 향상에 관여하는 것으로 보고된다[ 18]. 이처럼 여러 연구에서 운동과 비타민 D의 대사 장애 개선 효과가 보고되는 한편, 비타민 D와 규칙적 유산소 운동 복합처치가 비타민 D 및 운동 단일처치에 비해 인슐린 저항성, 심혈관계 질환 위험인자 개선에 긍정적 효과가 있다는 연구 결과가 보고됨에 따라[ 19], 비타민 D와 운동 트레이닝이 대사 장애로 유도된 근육 기능 저하에 복합처치 효과를 가질 것이라 판단된다. 따라서, 본 연구에서는 고지방식으로 유도된 비만 마우스에 운동과 활성형 비타민 D 복강 투여가 골격근의 형태학적 변화 및 미토콘드리아 역동성에 미치는 영향을 규명하는 데 목적이 있다.
연구 방법
1 실험동물
본 연구의 대상은 총 50두의 5주령 C57BL/6를 사용하였으며, 실험 동물은 오리엔트바이오(Orient Bio, Seongnam, Korea)에서 구입하였다. 모든 동물은 멸균된 케이지에서 사육되었다. 온도와 습도를 일정하게 조절하였고 12 hours light/dark cycle을 유지하였으며, 물과 먹이는 자유롭게 접근할 수 있도록 하였다.
2 연구설계
실험동물은 사육실에 적응 기간을 가진 후 standard chow (SC)집단과 High-fat diet (HFD) 집단으로 나누어 식이처치를 하였다. SC 집단은 일반 식이(11 kcal% fat w/sucrose, D12329, Research Diets, Inc., New Brunswick, NJ, USA), HFD 집단은 고지방 식이(58 kcal% fat w/sucrose, D12331, Research Diets, Inc., New Brunswick, NJ, USA)와 함께 fructose (Junsei, Japan, CAS 57-48-7)와 sucrose (Sigma-Aldrich, St. Louis, MO, S1888, CAS 57-50-1)로 구성된 탄수화물을 물에 42 g/L 농도로 혼합하여 처치하였다. 6주 후, SC 집단은 정상식이를 유지하고 HFD 집단의 경우 고지방 식이(HFD), 고지방식+운동(HFD+EX), 고지방식+비타민 D (HFD+VD), 고지방식+복합처치(HFD+EX+VD)로 구분하여 총 5집단(n=10 per group)으로 나누어 6주간 트레드밀 운동과 비타민 D 처치를 하였다. 체중은 매주 1회 동일한 요일에 측정하였다.
3 운동처치
6주간 식이 처치 후 마우스용 트레드밀(Exer-3/6 Treadmill, Columbus Instruments, Columbus, Ohio, USA)을 이용하여 1일 1회, 주 5회, 총 6주간 운동 처치를 실시하였다. 속도와 운동 시간을 점진적으로 증가시켜 최종 13 m/min의 속도로 본 운동을 40분간 실시하였다. 운동 시작 전과 후에는 8 m/min의 속도로 각각 5분간 준비운동과 정리운동을 실시하였다.
4 비타민 D 처치
비타민 D 처치는 활성형 비타민 D (1,25-dihydroxyvitamin D)를 주 2회 복강 내 주사로 총 6주간 실시하였다. 투여량은 1회당 5 μL/kg body weight을 기준으로 하였으며, 1 mL Syringe (Kovax-Syringe 1 mL, Korea Vaccine Co., Ltd, Ansan, Korea)를 사용하여 주사하였다.
5 조직학적 분석
파라핀에 고정된 비복근 조직은 5 μm 두께로 잘라 glass slides에 위치시켰다. 조직 절편은 xylene 처치하여 탈수하고, 2분간 흐르는 증류수에 세척하였다. 절편 조직은 hematoxylin에 5분간 염색 후 흐르는 물에 세정 후 2분간 eosin 염색하였다. 절편을 absolute alcohol에 헹군 뒤 synthetic resin을 이용하여 봉입, overnight 실온 건조하였다. 절편은 Axioplan 2 (Carl Zeiss, Jena, Germany)를 이용하여 이미지화하였고, ImageJ 프로그램을(NIH, Bethesda, MD, USA) 이용하여 정량하였다.
6 단백질 분석(western blot)
비복근 조직은 RIPA buffer (20 mM Tris-HCl, pH 7.5, 150 mM NaCl, 1 mM Na2EDTA, 1 mM EGTA, 1% NP-40, 1% sodium deoxycholate, 2.5 mM sodium pyrophosphate, 1 mM β-glycerophosphate, 1 mM Na-3VO4 and 1 μg/mL leupeptin)에 균질화하여 14,000 rpm/20 min로 원심분리 후 상층액을 취하였다. 총 20 μg의 단백질은 7.5-15% SDS (sodium dodecyl sulfate)-polyacrylamide gel electrophoresis에 전기영동 후, PVDF 막으로 트랜스퍼 하였다. 1차 항체는 4°C에 overnight 인큐베이션 하였다. GAPDH (sc-47724; Santa Cruz Biotechnology, Dallas, TX, USA)으로 단백질 양을 정량화 하였으며, 이용된 항체는 다음과 같다; Mfn2 (9482S; Cell Signaling Technology, Beverly, MA, USA), OPA1 (sc-393296; Santa Cruz Biotechnology, Dallas, TX, USA), Drp1 (14647S; Cell Signaling Technology, Beverly, MA, USA), Bax (sc-7480; Santa Cruz Biotechnology, Dallas, TX, USA), Bcl2 (sc-7382; Santa Cruz Biotechnology, Dallas, TX, USA), Parkin (sc-32282; Santa Cruz Biotechnology, Dallas, TX, USA), PINK1 (sc-517353; Santa Cruz Biotechnology, Dallas, TX, USA). 최종적으로, 밴드의 강도는 Molecular Imager® ChemiDoc XR System 을 이용하여 시각화하였다. 이후, 단백질 발현량 비교를 위하여, Im-age-Pro® Plus analysis system (Media Cybernetics, Inc., Silver Spring, MD, USA)를 통해 밴드의 강도를 정량화하였다.
7 자료처리
자료 분석은 SPSS (version 21.0) 프로그램을 활용하였다. 모든 자료는 각 항목에 대한 평균 및 표준편차(Mean±SD)로 표기하였다. 그룹 간 통계적 비교는 one-way ANOVA를 이용하였으며, 세부 집단 간 비교를 위해 Turkey 사후검증(post-hoc)을 이용하였다. 가설 검정을 위한 통계적 유의 수준은 p <.05를 따랐다.
연구 결과
1 골격근 형태에 대한 트레드밀 운동과 비타민 D 복합처치 효과
운동 트레이닝과 비타민 D 처치가 골격근 형태학적 특징에 미치는 영향을 확인하기 위하여 비복근 조직의 근섬유 단면(myocyte cross-sectional)의 면적과 extramyocyte space 면적을 H&E 염색을 통해 분석하였다( Fig. 1A, B). 그 결과, 12주간 고지방식이는 SC 집단에 비해 비복근 조직의 근섬유 단면적을 유의하게 감소시키고( p <.001), extramyocyte space를 증가시키는 것으로 나타났다( p =.042).
Fig. 1
Fig. 1Combined effects of treadmill running and vitamin D administration on muscle morphology in HFD-induced mice model (A) H&E stained sections of gastrocnemius (amplification: 20x). (B) Myocyte cross-sectional area. (C) Extramyocyte space. scale bar: 20 μm. * p<.05, ** p<.001 as compared with the SC group. # p<.05, ## p<.001 as compared with the HFD group. † p<.05, ‡ p<.001 between groups. 
그러나 6주간의 운동과 비타민 D 처치에 의한 근섬유 단면적의 경우 HFD+VD+EX 집단에서 고지방식이에 의한 감소를 통계학적으로 유의하게 회복되는 것으로 나타났다. 이와 유사하게 고지방식 식이에 의한 증가된 extramyocyte space는 HFD+VD+EX 집단에서 유의하게 증가가 완화된 것으로 나타났다(p <.001).
2 미토콘드리아 융합과 분열(fusion and fission)에 대한 트레드밀 운동과 비타민 D 복합처치 효과
운동 트레이닝과 비타민 D 복합 처치가 골격근 내 미토콘드리아 역동성에 미치는 영향을 분석하기 위하여, 미토콘드리아 융합 단백질(Mfn2, Opa1)과 분열 단백질(Drp1)을 웨스턴 블랏을 통하여 측정하였다( Fig. 2). 12주간 고지방처치는 골격근 내 미토콘드리아 결합 단백질인 Mfn2를 유의하게 감소시키는 것으로 나타났다( p <.05). 그러나 6주간의 운동과 비타민 D 처치에 의한 Mfn2 수준은 HFD 집단에 비해 HFD+VD ( p <.05) 혹은 HFD+VD+EX ( p <.001) 집단에서 고지방식이에 의해 감소된 Mfn2수준을 유의하게 완화시키는 것으로 나타났다( Fig. 2A). OPA1은 고지방식이로 인한 변화가 있지 않았지만 HFD+ VD+EX ( p <0.05) 그룹에서 HFD 그룹에 비해 유의하게 증가되는 것으로 나타났다( Fig. 2B).
Fig. 2
Fig. 2Combined effects of treadmill running and vitamin D administration on Mfn2, OPA1, and Drp1 protein levels in HFD-induced mice model. (A-C) Representative blot of western bands and Densitometry quantification of Mfn2, OPA1 and Drp1. GAPDH was probed as housekeeping gene. All values are expressed the means±SD * p<.05 as compared with the SC group. # p<.05, ## p<.001 as compared with the HFD group. † p<.05, ‡ p<.001 between groups. 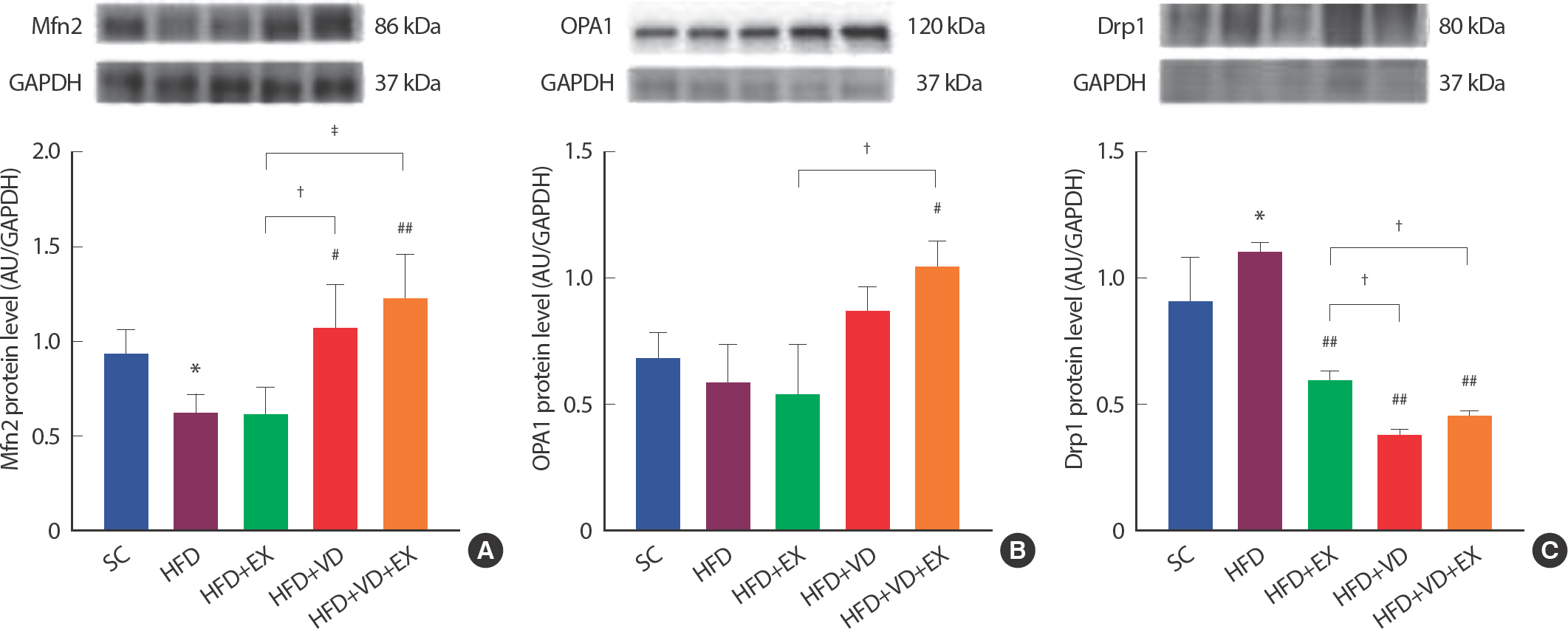
미토콘드리아 분리 단백질인 Drp1은 12주간 고지방식이 처치로 인해 SC 집단에 비해 HFD 집단에서 유의하게 증가하는 것으로 나타났으나 HFD+EX ( p <.001) 집단, HFD+VD( p <.001) 집단과 HFD+VD+ EX ( p <.001) 집단 모두에서 고지방식이 집단에 비해 유의하게 감소하는 것으로 나타났다( Fig. 2C). 특히, HFD+VD+EX 집단의 경우 HFD+ EX 집단에 비해 감소가 배가되는 것으로 나타났다( p <.001).
3 마이토파지(Mitophagy)에 대한 트레드밀 운동과 비타민 D 복합처치 효과
운동 트레이닝과 비타민 D 처치가 미토콘드리아의 자가포식 작용에 미치는 영향을 분석하기 위해, 자가포식 인자인 PINK1, Parkin을 웨스턴 블랏을 통하여 측정하였다( Fig. 3). 12주간 고지방식이 결과 Parkin 과 PINK1은 SC 집단에 비해 HFD 집단( p <.05)에서 유의하게 증가하는 것으로 나타났다.
Fig. 3
Fig. 3Combined effects of treadmill running and vitamin D administration on Parkin and PINK1 protein levels in HFD-induced mice model. (A, B) Representative blot of western bands and Densitometry quantification of Parkin1 and PINK1. GAPDH was probed as housekeeping gene. All values are expressed the means±SD * p<.05 as compared with the SC group. # p<.05, ## p<.001 as compared with the HFD group. † p<.05, ‡ p<.001 between groups. 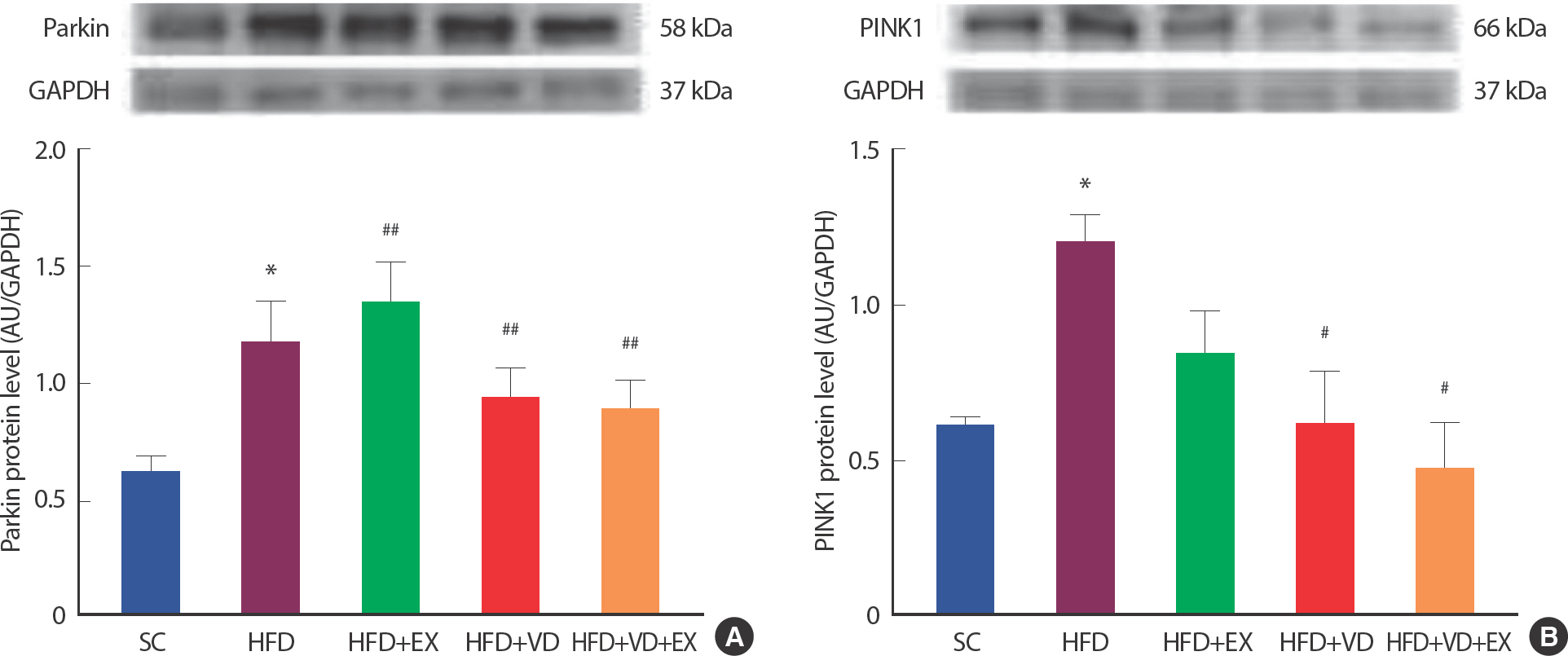
그러나 6주간의 운동과 비타민 D 처치 결과, Parkin의 경우 HFD 집단에 비해 HFD+VD 집단( p <.001)과 HFD+VD+EX 집단( p <.001)에서 유의하게 감소하는 것으로 나타났다( Fig. 3A). PINK1의 경우, HFD 집단에 비해 HFD+VD 집단( p <.001)과 HFD+VD+EX 집단( p <.001)에서 유의하게 감소하는 것으로 나타났다( Fig. 3B).
4 세포사멸(apoptosis)에 대한 트레드밀 운동과 비타민 D 복합처치 효과
운동 트레이닝과 비타민 D 처치가 골격근 미토콘드리아를 매개로 한 세포 사멸에 미치는 영향을 측정하기 위해 세포사멸 인자인 Bax, Bcl2를 웨스턴 블랏을 통하여 측정하였다( Fig. 4). 12주간 고지방식이 처치 결과 pro-apoptotic protein인 Bax는 SC 집단에 비해 HFD 집단( p <.001)에서 유의하게 증가하는 것으로 나타났고, Anti-apoptotic pro-tein인 Bcl2는 SC 집단에 비해 HFD 집단( p <.05)에서 유의하게 감소하는 것으로 나타났다.
Fig. 4
Fig. 4Combined effects of treadmill running and vitamin D administration on Bax and Bcl2 protein levels in HFD-induced mice model. (A, B) Representative blot of western bands and Densitometry quantification of Bax and Bcl2. GAPDH was probed as housekeeping gene. All values are expressed the means±S.D. * p<.05 as compared with the SC group. # p<.05, ## p<.001 as compared with the HFD group. † p<.05, ‡ p<.001 between groups. 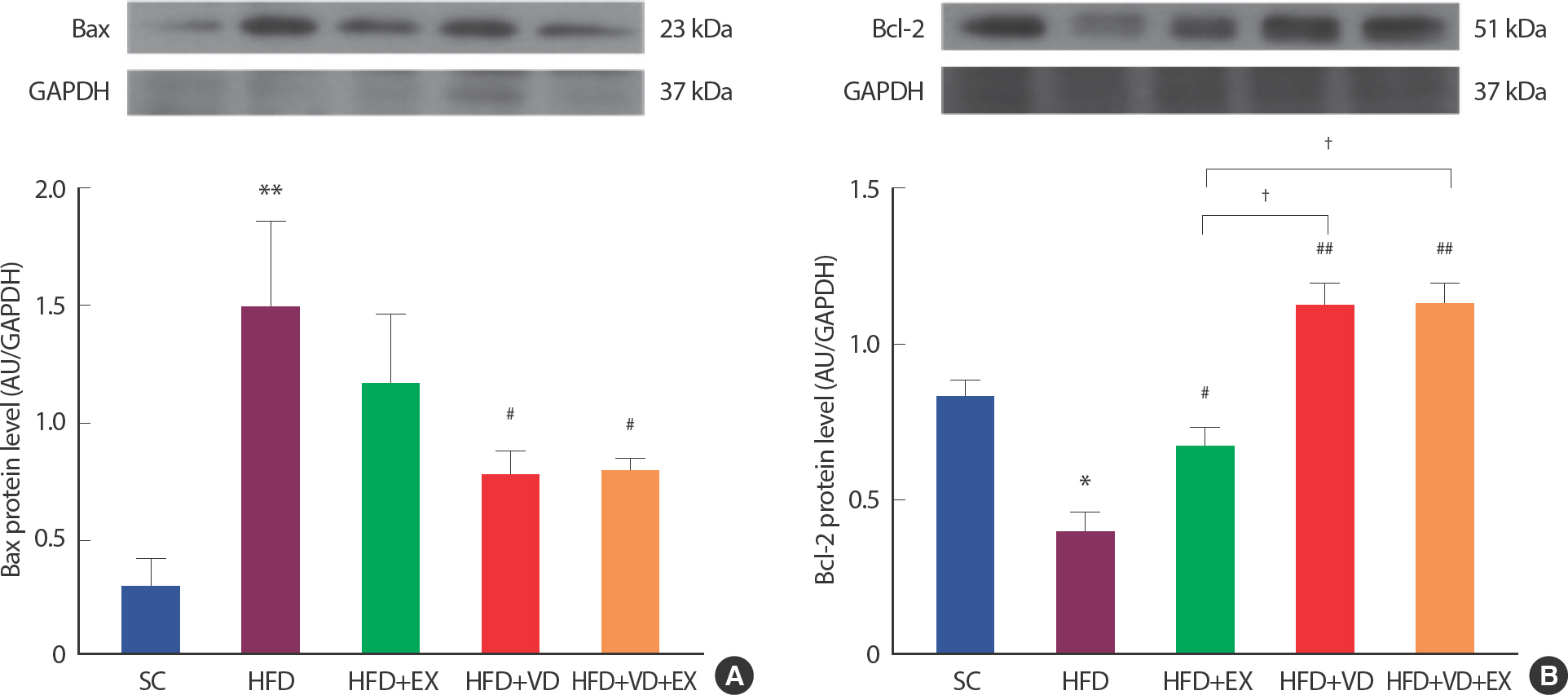
그러나 6주간 운동과 비타민 D 처치는 Bax의 경우 HFD+VD (p<.05), HFD+VD+EX (p <.05) 집단에서 HFD 집단에 비해 유의하게 감소하는 것으로 나타났고, anti-apoptotic protein인 Bcl2는 HFD 집단에 비해, HFD+EX (p <.05), HFD+VD (p <.001), HFD+VD+EX (p <.001) 집단에서 유의하게 증가하는 것으로 나타났다.
논 의
본 연구는 골격근에서 식이 처치로 유도된 대사 장애에 대한 운동과 비타민 D 처치의 효과를 규명하는 것을 연구 목적으로 하며, 골격근의 형태학적 분석, 미토콘드리아 역동성, 미토콘드리아 자가포식, 세포 자멸사를 중심으로 분석하였다. 고지방식으로 유도된 대사 장애로 인해 골격근의 세포 수가 감소하고 세포 외 공간의 면적이 증가하는 것으로 나타났다. 그러나 운동과 비타민 D 처치는 대사 장애로 유도된 골격근의 형태학적 변화를 완화시키는 것으로 나타났고 운동과 비타민 D 복합 처치는 배가 효과가 있는 것으로 나타났다. 또한 고지방식으로 인한 미토콘드리아 역동성과 마이토파지의 불균형은 운동과 비타민 D 처치로 인해 골격근 내 미토콘드리아 융합 단백질(e.g., Mfn2, OPA1)의 향상과 분열(e.g., Drp1) 및 마이토파지(e.g., PINK1, Parkin,) 단백질이 감소되는 것을 확인하였으며 미토콘드리아 매개 세포사멸 관련 단백질(e.g., Bax, Bcl2)의 발현 조절을 통해 세포사멸 기전을 감소시켰음을 확인하였다.
본 연구에서는, 운동과 비타민 D 처치가 골격근 내 대사 장애로 인한 extramyocyte space 증가와 myocyte cross-sectional 면적 감소를 완화하였음을 확인하였다. 선행 연구에 의하면, Wistar rats을 대상으로 16주 동안의 고지방 식이로 유도된 비만 모델에서, 골격근의 근 위축이 유발되었다고 보고된다[ 20]. 이러한 연구와 상응하게, 본 연구에서는 12주간의 식이 처치로 인해 골격근 조직의 extramyocyte space의 증가와 myocyte cross-sectional 면적 감소를 확인하였다. 한편, 본 연구에서는 6주간의 운동 및 비타민 D 처치가 비만으로 인한 골격근 조직의 extramyocyte space와 myocyte cross-sectional 면적을 증가시켰다. 일반적으로, 운동 트레이닝은 단백질 합성과 골격근 세포사멸 기전의 억제를 통해 근 위축을 억제하는 것으로 알려져 있다[ 21]. 선행 연구에 따르면, 21명의 제2형 당뇨 및 비만, 인슐린 저항성 환자를 대상으로 한 연구에서, 제2형 당뇨병 환자에서 VO 2 peak와 골격근의 p-STAT3/STAT3 비율이 음의 상관관계를 가짐으로써, 유산소성 운동 수행 능력이 골격근의 염증과 근 위축 신호의 억제에 효과적인 것으로 보고하였다[ 22]. 또한, 2-6주간의 비타민 D와 운동, 그리고 비타민 D와 운동의 복합처치가 제2형 당뇨병 모델 rat의 myocyte cross-sectional 면적을 증가시켰으며, 근육의 단백질 합성에 관여하는 단백질 myoblast determination protein 1가 증가, 분해에 관여하는 단백질인 muscle RING-finger pro-tein-1과 Atrogin1가 감소하였다고 보고하였다[ 23]. 또한, 38명의 백인 요통 환자를 대상으로 5주간 비타민 D 처치를 한 연구에서, 비타민 D 섭취군에서 비타민 D 결핍군에 비해 근 위축에 관여하는 단백질인 pAkt, Forkhead box protein O3 발현량이 유의하게 감소되었다는 결과를 통해, 비타민 D 결핍이 근 위축과 밀접하게 연관되어 있다고 보고하였다[ 24]. 본 연구의 6주간의 운동과 비타민 D 복합처치로 인한 extramyocyte space 감소와 myocyte cross-sectional 면적 증가는 이러한 선행 연구 결과와 일치함을 알 수 있다. 따라서 운동과 비타민 D 처치가 대사 장애에 따른 골격근 조직의 위축을 억제하고, 골격근 세포 크기를 효과적으로 증가시키는 것으로 판단된다. 미토콘드리아는 융합 작용을 통해 미토콘드리아의 구성 성분 즉, 단백질, 대사 산물, mtDNA 등을 재분배하는 반면, 분열 작용을 통해 미토콘드리아를 작은 단위로 분열시킨다. 이러한 미토콘드리아의 융합/분열 작용의 불균형은 여러 대사 질환을 유발하기에 미토콘드리아의 적절한 형태 유지는 정상적인 세포의 기능을 유지하는데 중요한 것으로 알려져 있다[ 25]. 본 연구에서는, 6주간의 식이 처치로 Mfn2이 유의하게 감소, Drp1이 유의하게 증가된 결과를 통해, 대사 장애로 인한 비만으로 미토콘드리아의 결합이 감소하고, 분리가 촉진되었음을 확인하였다. 선행 연구에 따르면, 고지방식으로 유도된 비만 마우스에서 Mfn1, Mfn2가 유의하게 감소하였으며, Fis1, Drp1이 유의하게 증가하였다고 보고된다[ 26]. 6주간의 운동과 비타민 D 처치는 미토콘드리아 결합 단백질 Mfn2, Opa1을 유의하게 증가시키고 분리 단백질 Drp1을 유의하게 감소시켰다. 선행 연구에 따르면, 사람 골격근 세포에 활성형 비타민 D인 1,25-(OH)2 D 3 처치 시, OPA1이 증가하였고, Drp1, Fis1이 감소하였다고 보고되었다[ 27]. 또한, 17명의 좌식 생활패턴의 비만 노인을 대상으로 골격근 생검을 진행한 연구에서, 12주간 유산소 운동 처치가 p-Drp1 Ser616을 유의하게 감소시켰다고 보고하였다[ 28]. 이를 통해 운동과 비타민 D가 미토콘드리아의 결합을 증가시키고, 분리를 감소시킴으로써 결합, 분리 간 균형 유지를 통해 정상적인 미토콘드리아를 유지할 수 있음을 확인할 수 있다. 본 연구에서는, 6주간의 운동과 비타민 D 처치로 마이토파지 관련 단백질의 발현을 감소시킴으로써 대사 장애로 인한 세포 내 미토콘드리아 자가포식 기전을 억제하였음을 확인하였다. 미토콘드리아의 자가포식 기전은 미토콘드리아의 융합과 분열 작용과 밀접하게 연관되며, 미토콘드리아의 분열 단백질 Drp1은 손상된 미토콘드리아를 분리하여 미토콘드리아 자가포식 작용을 개시하는 것으로 알려져 있다[ 6]. 본 연구에서는, 6주간의 식이 처치로 유도된 대사 장애가 미토콘드리아 자가포식 관련 단백질인 PINK1과 Parkin을 유의하게 감소시켰음을 확인하였다. 선행 연구에 따르면, Drp1의 감소가 마이토파지를 억제한다고 보고되며[ 29], 미토콘드리아 분열의 억제가 미토콘드리아의 자가포식을 감소시키며, OPA1의 과발현이 미토콘드리아의 자가포식을 감소시킨다고 보고하였다[ 30]. 이러한 결과는 마이토파지 단백질 발현의 감소가 미토콘드리아 분열 단백질 발현의 감소와 밀접한 관련이 있는 것으로 해석된다. 비타민 D와 운동이 대사 장애로 인한 미토콘드리아 자가포식 활성 억제에 복합처치 효과가 있음을 나타낸다. 한편, 이러한 결과는 비타민 D의 섭취가 미토콘드리아 자가포식을 촉진하여 세포 생존 신호를 활성화한다는 선행 연구 결과와 상이하다. 한편, 본 연구에서는 6주간의 운동과 비타민 D 처치가 세포사멸에 관련된, pro-apoptotic protein인 Bax를 감소시키고, anti-apoptotic pro-tein인 Bcl2를 증가시킴으로써, 식이 처치로 유도된 대사 장애의 미토콘드리아 매개 세포사멸 기전을 억제하였다는 것을 확인하였다. 본 연구에서는, 전체 12주간의 식이 처치로 유도된 대사 장애가 Bax를 증가, Bcl2를 감소시켰음을 확인하였다. 이는 Wistar rat을 대상으로 16주간 고지방 식이 처치가 근 위축과 세포사멸 기전을 활성화하였다는 선행 연구 결과[ 20]와 일치하며, 식이 처치로 인한 비만이 골격근 미토콘드리아를 매개로 한 세포의 사멸을 유도한 것으로 판단된다. 또한, 본 연구에서는 운동과 비타민 D 처치를 통한 Bax의 감소, Bcl2의 증가를 확인하였다. 선행 연구에 따르면, 비타민 D의 처치가 심혈관계의 세포사멸을 조절하며, Bcl2의 발현을 증가시키고, Bax의 발현을 감소시켰다고 보고하였다[ 31]. 또한, 24월령의 노화 Fischer-344 rat을 대상으로, 12주간의 운동 트레이닝 처치가 Bax의 발현을 낮추고 Bcl2의 발현을 증가시킴으로써 노화로 인한 세포 사멸을 억제하는 것으로 보고되었다[ 32]. 이러한 결과를 통해 운동과 비타민 D 처치가 미토콘드리아를 매개한 세포사멸 기전을 억제함으로써 대사 장애를 개선한다는 것을 의미한다.
결 론
고지방식으로 유도된 골격근의 근 형태학적 변화 및 미토콘드리아 기능 장애에 6주간의 운동과 비타민 D 복합처치가 골격근의 형태학적 특성, 미토콘드리아 역동성, 미토콘드리아 자가포식, 세포 자멸사에 미치는 영향을 확인하고 다음과 같은 결론을 도출하였다. 6주간 트레드밀 운동 혹은 비타민 D 단일처치에 비해 운동과 비타민 D 복합처치는 골격근 형태학적 변화 완화에 배가효과가 있는 것으로 나타났고 이는 미토콘드리아 역동성 단백질(Mfn2, OPA1)을 증가시켜 고지방식이로 인한 미토콘드리아 역동성 불균형을 완화시키는 것으로 사료된다. 따라서 운동과 비타민 D 복합 처치는 비만으로 인한 골격근의 위축을 개선시킬 수 있는 효과적인 처치 방법이라고 판단된다.
REFERENCES
2. Ginsberg HN. Insulin resistance and cardiovascular disease. J Clin In-vestig.. 2000;106(4):453-8.  3. Turner N, Heilbronn LK. Is mitochondrial dysfunction a cause of insulin resistance? Trends Endocrinol Metab.. 2008;19(9):324-30.   7. Russell AP, Foletta VC, Snow RJ, Wadley GD. Skeletal muscle mitochon-dria: a major player in exercise, health and disease. Biochim Biophys Acta Gen Subj.. 2014;1840(4):1276-84.  8. Kroemer G, Galluzzi L, Brenner C. Mitochondrial membrane perme-abilization in cell death. Physiol Rev.. 2007;87(1):99-163.   9. Gonzalez-Franquesa A, Patti ME. Insulin resistance and mitochondrial dysfunction. Adv Exp Med Biol.. 2017;465-520.  10. Kelley DE, Goodpaster BH. Effects of physical activity on insulin action and glucose tolerance in obesity. Med Sci Sports Exerc.. 1999;31(11 Suppl):S619-23.   11. Venkatasamy VV, Pericherla S, Manthuruthil S, Mishra S, Hanno R. Effect of physical activity on insulin resistance, inflammation and oxidative stress in diabetes mellitus. J Clin Diagn Res.. 2013;7(8):1764.   13. Zhu GD, Okamura WH. Synthesis of vitamin D (calciferol). Chem Rev.. 1995;95(6):1877-952.  14. Wimalawansa SJ. Associations of vitamin D with insulin resistance, obesity, type 2 diabetes, and metabolic syndrome. J Steroid Biochem Mol Biol.. 2018;175:177-89.   15. Botella-Carretero JI, Alvarez-Blasco F, Villafruela JJ, Balsa JA, Vázquez C, et al. Vitamin D deficiency is associated with the metabolic syndrome in morbid obesity. Clin Nutr.. 2007;26(5):573-80.   16. Alvarez JA, Ashraf A. Role of vitamin D in insulin secretion and insulin sensitivity for glucose homeostasis. Int J Endocrinol. 2010.   17. Sung CC, Liao MT, Lu KC, Wu CC. Role of vitamin D in insulin resistance. J biotechnol biomed. 2012.   20. Sishi B, Loos B, Ellis B, Smith W, du Toit EF, et al. Diet‐ induced obesity alters signaling pathways and induces atrophy and apoptosis in skeletal muscle in a prediabetic rat model. Exp Physiol.. 2011;96(2):179-93.  22. Perry BD, Caldow MK, Brennan-Speranza TC, Sbaraglia M, Jerums G, et al. Muscle atrophy in patients with Type 2 Diabetes Mellitus: roles of inflammatory pathways, physical activity and exercise. Exerc Immunol Rev.. 2016;22:94.   24. Dzik KP, Skrobot W, Kaczor KB, Flis DJ, Karnia MJ, et al. Vitamin D deficiency is associated with muscle atrophy and reduced mitochondrial function in patients with chronic low back pain. Oxid Med Cell Longev. 2019.   25. Chan DC. Mitochondrial fusion and fission in mammals. Annu Rev Cell Dev Biol.. 2006;22:79-99.   27. Ryan ZC, Craig TA, Folmes CD, Wang X, Lanza IR, et al. 1α, 25-dihy-droxyvitamin D3 regulates mitochondrial oxygen consumption and dynamics in human skeletal muscle cells. J Biol Chem.. 2016;291(3):1514-28.   28. Fealy CE, Mulya A, Axelrod CL, Kirwan JP. Mitochondrial dynamics in skeletal muscle insulin resistance and type 2 diabetes. Transl Res.. 2018;202:69-82.   29. Ikeda Y, Shirakabe A, Brady C, Zablocki D, Ohishi M, et al. Molecular mechanisms mediating mitochondrial dynamics and mitophagy and their functional roles in the cardiovascular system. J Mol Cell Cardiol.. 2015;78:116-22.   31. Tabasi N., Rastin M, Mahmoudi M, Ghoryani M, Mirfeizi Z, et al. In-fluence of vitamin D on cell cycle, apoptosis, and some apoptosis relat-ed molecules in systemic lupus erythematosus. Iran J Basic Med Sci.. 2015;18(11):1107.  
|
|









